AACG合并白内障患者急性发作期行超声乳化联合小梁切除手术后房角功能及临床疗效观察
张进松 刘少勤 杨南
原发性急性闭角型青光眼(acute angle-closure glaucoma,AACG)是眼科常见的致盲性眼病,早期诊断并给予有效的干预对患者的视功能的保护至关重要。AACG发作时,由于房角的急性关闭,虹膜与小梁网组织粘附,眼内压急剧升高,导致视神经损伤和视野的缺损,严重时可完全失明。AACG目前最有效的手术方式是抗青光眼滤过术,而小梁切除术为首选的治疗方式。急性发作期的原发性AACG的患者需要降低眼压,打开关闭的房角。然而许多患者用降眼压药物无法控制眼压或者不愿长期使用降眼压药物,需手术干预。对AACG合并白内障患者行白内障超声乳化吸出人工晶状体植入联合小梁切除术,不仅能很好的控制眼压和快速恢复视力,还能长久保持滤过功能,避免二次手术[1]。本研究通过对AACG患者行双切口白内障超声乳化吸出人工晶状体植入联合小梁切除术,术后随访6个月,观察术后的临床疗效以及前房角的开放情况,来评价AACG治疗效果。
资料及方法
一、患者的临床资料
回顾性病例研究。收集了2015年1月至2019年12月就诊于我院的AACG急性发作患者53例(53只眼);其中男性26例(26只眼),女性27例(27只眼);年龄(71±12.6)岁(60~83岁),术前平均眼压(45.7±10.6)mmHg(1 mmHg=0.133 kPa)。经常规降眼压药物治疗后,所有患者的眼压均高于21 mmHg,药物不能将其眼压控制在正常范围内。晶状体核混浊度≥Ⅲ级。病例纳入标准:(1)原发性闭角性青光眼;(2)既往未行抗青光眼滤过手术及其他眼科手术;(3)不伴眼病其他疾病;(4)无影响手术的全身禁忌证如糖尿病、高血压等。观察指标分别进行术后1 周、1个月及6个月的随访。
本项目手术适应证选择:参考2014年中华医学会青光眼学组专家共识,同时结合我院青光眼科治疗体会,手术适应证如下:(1)所有患者均为青光眼急性期发作经药物治疗2~4 d,术前眼压高于21 mmHg;所有患者使用多种抗青光眼药物,眼压仍不能控制正常(主要使用药物有卡替洛尔滴眼液、布林佐胺滴眼液,口服醋甲唑胺,全身静脉滴注甘露醇等);(2)房角镜下检查:房角关闭范围≥3象限;(3)超声生物显微镜(ultrasound biomicroscopy,UBM):前房变浅,周边虹膜根部与小梁网贴附范围>2象限;(4)晶状体核混浊度≥Ⅲ级。所有患眼均行超声乳化白内障吸除人工晶状体植入联合小梁切除术,术中均未使用抗代谢药物,巩膜瓣边缘不出现房水渗出,前房深浅稳定。
二、术前相关检查及观察指标
眼科的相关检查:所有患者均行裂隙灯显微镜检查、最佳矫正视力(best corrected visual acuity,BCVA)、眼压、房角、眼底检查、视野、A/B型超声、相干光断层成像术(optical coherence tomography,OCT)、UBM、角膜内皮镜、角膜曲率等检查。全身检查:术前检查胸片、心电图、生化系列检测等,排除手术禁忌证。
术前术后观察指标:局部应用抗生素滴眼液、糖皮质激素眼药水及眼膏。前房反应重的患者浅眶多次注射甲基强的松龙。炎性渗出形成人工晶状体前膜者,行YAG激光切开。眼压高者按摩眼球,酌情加用降眼压滴眼液点眼。随访术前、术后1周、1个月和6个月时术眼的BCVA、平均眼压、前房角开放程度、平均前房深度及滤过泡功能的情况。
三、患者的治疗方法
患者入院后使用多种抗青光眼药物,眼压仍不能控制正常。手术由同一位技术娴熟的手术医生完成,手术设备为博士伦Stellaris超声乳化玻璃体切除一体机,植入眼力健AR40e折叠式IOL或博士伦ADAPT-AO折叠式人工晶状体。术前予以左氧氟沙星滴眼液、妥布霉素地塞米松滴眼液点眼,全身及局部降眼压药物治疗。
手术方法:常规消毒铺巾固定,开睑器开睑,0.75%布比卡因行球周麻醉,2%利多卡因行结膜下浸润麻醉,固定上直肌,作以上穹隆为基底的结膜瓣,烧灼止血后作一4 mm×4 mm、1/2巩膜厚度以角膜缘为基底的巩膜瓣(巩膜瓣作至透明角膜内1.5 mm)。在颞侧作宽3.2 mm透明角膜隧道切口,15°穿刺刀于1点方位角膜缘作侧切口。前房注入黏弹剂,行直径约5.5 mm连续环形撕囊,行白内障超声乳化手术,吸出皮质。注入黏弹剂,植入人工晶状体,吸尽黏弹剂,将人工晶状体襻调至水平位,10-0丝线缝合白内障主切口1针,前房注入卡米可林缩小瞳孔。切除巩膜瓣下2 mm×2 mm包含小梁组织在内的角巩膜组织,作周边虹膜作切除。10-0尼龙线间断缝合巩膜瓣的两个顶角(前房浅者加缝2针调整缝线),间断缝合结膜切口2针,侧切口注入BSS恢复前房。
四、统计学分析方法
本研究采用SPSS 17.0软件进行统计学分析。采用Wilcoxon秩和检验对术前及术后BCVA进行比较,重复测量资料方差分析对术前及术后各随访时间点的平均眼压进行统计学分析,配对t检验对术前及术后中央前房深度进行统计学分析,术后平均眼压与房角粘连程度的相关性采用Pearson相关分析检验以P<0.05为差异有统计学意义。
结 果
一、患者术前的基本临床资料
本研究的患者均诊断为原发性闭角性青光眼,其术前应用降眼压药种数,BCVA、平均眼压、前房角开放程度、平均前房深度,房角关闭范围,晶状体核混浊度的分级等如表1所示。本研究的患者术前应用降眼压药物的种类为(2.4±1.8)种,最佳矫正视力为0.19±0.12,平均眼压为(45.7±10.6)mmHg,中央前房深度为(1.41±0.32)mm,房角关闭范围为(3.4±0.3)象限,晶状体核混浊度程度分级为(3.1±1.5)级。
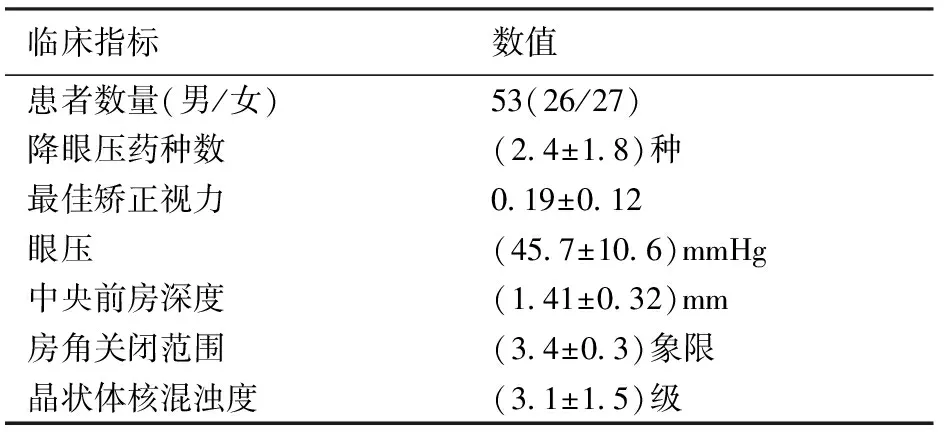
表1 53例急性闭角型青光眼急性发作患者术前的基本临床资料
二、术前及术后眼压、视力比较
本研究53例患者术前眼压为(45.7±10.6)mmHg,术后1周、1个月、6个月的眼压分别是(13.7±5.6)mmHg、(14.4±6.2)mmHg、(14.9±6.8)mmHg。患者术前及术后的眼压的均数如表2所示。各检测时间点的眼压均具有统计学差异(F=183.5,P<0.01);术前术后的眼压比较,术后1周、1个月、6个月眼压较术前均有统计学意义(t1=10.3、t2=11.5、t3=13.7,P1=0.018,P2=0.012,P3=0.009)。术后各种随访时间的比较,术后6个月眼压较术后1周显著降低,差异具有统计学意义;但较术后1个月时眼压差异无统计学意义。50例患者术后眼压均控制在正常范围内,仅3例患者术后1个月眼压仍高,予以布林佐胺滴眼液治疗能够有效控制眼压,且长期平稳。
本研究中51例患者术后1周、1个月、6个月的最佳矫正视力均提高,2例患者的术后的BCVA无明显改善。患者术前及术后的最佳矫正视力的数值如表2所示。术前最佳矫正视力均数为(0.19±0.12),术后1周为(0.67±0.31),术后1个月为(0.74±0.25),术后6个月为(0.72±0.28)。本研究的患者术前术后的BCVA比较,术后1周、1个月、6个月眼压较术前均有统计学意义(t1=14.6、t2=16.1、t3=18.3,P1=0.008,P2=0.005,P3=0.001);而术后各组中的差异无统计学意义。
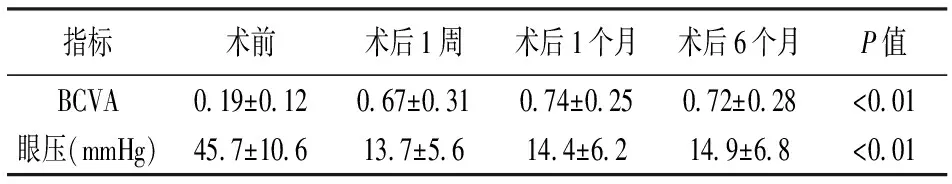
表2 53例急性闭角型青光眼急性发作术前及术后的最佳矫正视力比较
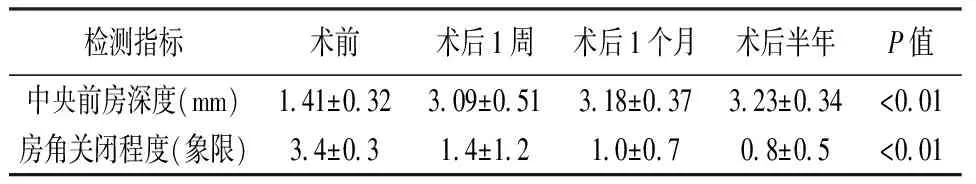
表3 患者术前及术后中央前房深度和房角变化的比较
三、术前及术后中央前房深度和房角的变化
术前所有患者的术眼的房角关闭的范围均≥3个象限,术后房角均有不同程度的开发,到术后6个月51例患者的房角开放的范围≥3个象限,2例患者的房角开放范围仅为2个象限。术后房角关闭在1周、1个月及6个月时较术前的差异有统计学意义(t1=5.9、t2=7.4、t3=8.3,P1=0.031,P2=0.023,P3=0.016)。
53例患者的平均中央前房深度(3.23±0.34)mm。所有患者术后各随访时间点的前房深度如表3所示。术后各随访时间点的前房深度较术前显著提高。术后1周有6例术眼出现浅前房,经治疗后均好转。术后前房深度在1周、1个月及6个月时较术前的差异有统计学意义(t1=6.7、t2=8.4、t3=9.5,P1=0.024,P2=0.019,P3=0.013)。见表3。
四、术后滤过泡情况,术中及术后并发症观察
术中出现角膜水肿者10只眼,但不影响手术操作。前房少量出血7只眼,冲洗后出血消失。术后1周浅前房者6只眼,患眼眼压低,予以散瞳、胶布固定棉球压迫滤过泡,前房加深。术后1个月时,45只眼存在功能性滤过泡。术后6个月时,39只眼存在功能性滤过泡。脉络膜脱离者4只眼,全身及局部激素治疗后,脉络膜脱离治愈。高眼压者3只眼,滴用布林佐胺滴眼液均能降至正常。无视网膜脱离、脉络膜出血等严重并发症发生。
讨 论
原发性闭角型青光眼合并白内障是我国常见的致盲眼病之一,其发病机制目前尚不完全清楚。各种因素导致的瞳孔阻滞是其重要的原因,目前主要治疗方式是手术治疗解除瞳孔阻滞,包括青光眼小梁切除术,白内障超声乳化摘除+IOL植入+小梁切除术等[2]。小梁切除术是通过建立房水流出通道增加房水的外引流实现降眼压的目的,是临床上主要的抗青光眼手术方式。然而,原发性闭角型青光眼行小梁切除术后早期常出现浅前房、前房出血、低眼压,甚至脉络膜脱离等并发症;晚期可出血高眼压、滤过泡疤痕化、滤过泡变薄、加速白内障形成等并发症。研究表明,闭角型青光眼术后浅前房发生率高[3],合并白内障的患者,由于晶状体膨胀,导致虹膜前移,术后浅前房更易发生。行小梁切除术后,由于内环境的改变,晶状体混浊加速,需行白内障摘除手术。近年来,白内障超声乳化摘除+IOL植入+小梁切除术方式越来越多的用于治疗原发性急性闭角性青光眼。白内障超声乳化摘除联合人工晶状体植入术因其创伤小、反应轻、散光小的特点,已被广泛应用于临床治疗白内障,且联合小梁切除手术已被证实是安全、有效[4]。研究发现,在控制原发性急性闭角性青光眼眼压方面,联合手术和小梁切除术是相当的。通过摘除膨胀的晶状体并植入人工晶状体后可以使膨隆的虹膜后退,中央前房加深,关闭房角开放[5,6],不仅减少术后浅前房发生,同时能够有效控制眼压。
原发性急性闭角型青光眼患者行青光眼白内障联合手术,需要注意以下几点。首先手术者需经验丰富,具有娴熟的超声乳化技术,有处理术中及术后并发症的能力。其次,青光眼白内障联合手术采用双切口,从而减少对滤过通道的刺激,避免因单切口切除巩膜瓣下角巩膜组织而导致巩膜内切口张力降低,影响切口愈合。而且双切口在降低术后散光及减轻角膜内皮损伤方面明显优于单切口[7]。再次,患者术前眼压难以控制,部分患者角膜水肿不能消退,影响手术操作。可先行前房穿刺,缓慢放出部分房水,用高渗糖滴眼,或23G穿刺刀于睫状体平坦部穿刺放液[8],等待角膜水肿减轻后再行白内障手术。本研究的患者术前的眼压控制在可行白内障摘除手术的范围内,所有患者均顺利完成手术。术后半年时患者的眼压较术前显著降低,BCVA显著提高,术眼的前房深度显著增加,房角开放程度显著改善(≥3个象限)。术中有10例患者因角膜水肿,采用降低眼压后顺利完成手术;有7例患者因眼压降低出现前房出血,关闭切口并冲洗前房后好转。术后早期(1周)6只术眼出现浅前房,予以散瞳、胶布固定棉球压迫滤过泡,前房加深;脉络膜脱离者4只眼,全身及局部激素治疗后,脉络膜脱离治愈;高眼压者3只眼,滴用布林佐胺滴眼液均能降至正常。无视网膜脱离、脉络膜出血等严重并发症发生。术后前房炎性反应较重,予以散瞳、激素类滴眼液、球周注射甲强龙等抗炎,抗疤痕化治疗,提高功能性滤过泡的成功率。
青光眼白内障联合术在治疗原发性急性闭角性青光眼合并白内障的患者应用较为广泛。然而手术时机的选择在该病的治疗过程中起到至关重要的作用。术前需要控制过高的眼压,避免术眼眼压迅速降低导致爆发性脉络膜出血等严重并发症。由于患眼瞳孔阻滞导致房角关闭眼压增高,眼内炎症介质显著增高,逐渐导致房角粘连,小梁网结构的破坏等。因此,迅速的解除瞳孔阻滞状态对患眼房角的开放,小梁网结构的恢复具有重要意义。研究表明,瞳孔阻滞所致房角关闭导致房角粘连,以及小梁网滤过功能降低一般发生在发作期后2周至1个月内。当房角出现疤痕化的粘连后,房角不能重新开放;而小梁网的结构出现破坏后,滤过功能显著降低,眼压升高。本研究选择在发作期控制眼压后行手术治疗的目的是为了尽快解除瞳孔阻滞,开放房角,恢复小梁网的功能,从而降低眼压。
综合上述,白内障超乳摘除人工晶状体植入联合小梁切除术治疗原发性闭角性青光眼合并白内障的患者具有显著降低眼压、开放房角、改善视力、术中及术后并发症少等优点。尽管如此,由于本研究为单一中心的回顾性临床研究,其随访时间相对较短,病例数相对较少,需要多中心、大样本和更长时间的随访来验证本研究的结果。

