色素上皮基因在大鼠虹膜睫状体中的表达研究
赵丽 卢弘 胡晓凤
临床医学将虹膜睫状体、脉络膜组织炎症疾病统称为葡萄膜炎,是一种临床较为常见的眼科疾病[1,2]。有研究表示,葡萄膜炎症状发病机制较为复杂,具有临床治疗难度大、病情易反复发作的特点,甚至有些患者治疗过程中因出现其他并发症而导致严重视力损伤甚至失明,因此越来越多的专家学者致力于葡萄膜炎临床治疗的研究[3,4]。色素上皮衍生因子(pigment epithelium derived factor,PEDF)具有抑制新生血管、抗炎、神经营养等多种作用,目前PEDF的抗炎作用是许多专家学者的主要研究方向[5,6]。本研究使用腺病毒载体介导PEDF基因转染大鼠,探究PEDF在大鼠虹膜睫状体中的表达,及PEDF基因表达的干预机制,为进一步研究PEDF的作用提供基础研究数据。
资料与方法
一、材料
实验研究。选取60只健康Wister大鼠,购自北京维通利华实验动物技术有限公司,年龄7~11个月,平均(9.0±1.6)个月;体重219~242 g,平均体重(230.5±9.2)g。在光照12 h/d、相对湿度48%~55%、温度(22.7±2.3)℃环境中饲养。本研究获我院伦理委员会批准。霍乱弧菌内毒素LPS(18 001株,古典生物型,小川血清型,兰州生物制品研究);PEDF、Notch1、DLL4、VEGF抗体(英国abcam 公司),TLR4抗体、MyD88抗体、NF—KB p65抗体(美国Santa Cruz公司)
二、建模及处理
1.AV-PEDF构建:依据人PEDF基因信息原始质粒GV314Z设计酶切位点,由吉凯基因公司设计引物序列,使用T4DNA连接酶将回收PCR产物、载体进行连接,并进行转化、筛选获得重组质粒,并用过PCR、酶切及测序分析进行测序鉴定。
使用胰消化酶对293TN细胞进行消化后接种至培养皿,1.5×100/皿,添加10%FBS DMEM培养基,使用37 ℃ 5% CO2培养箱进行培养,接种至24孔板,293TN细胞生长至70%融合后转染,取转染复合物,6孔板(含细胞及完全培养基)内混合,静置6 h,换培养液后置于37 ℃ 5% CO2培养箱内孵育。转染2d后显微镜观察,显示细胞液发黄,贴壁细胞密度达90%,细胞贴壁状态较好(图1)。取细胞上清液进行离心处理,将细胞碎片沉淀去除后使用PVDF膜过滤,冰浴保存,次日取50%上清再次感染HEK293细胞,50%左右细胞漂起后再次采集病毒上清,反复于HEK293细胞中扩增病毒至所需滴度。将HEK293细胞添加至48孔板,3×104/孔,1 d后,使用DMEM培养基10倍梯度稀释病毒:第一排每孔添加10 μl病毒原液,充分混合后取10 μl混合液添加至第二排,在此过程中避免产生气泡,按此步骤操作直至第八排孔,感染2 d后对荧光细胞计数进行统计,病毒滴度为1×1011PFU/ml。
图1 转染后细胞荧光观察
2.建模及分组处:60只Wistar大鼠随机数字表法分为3组(模型组、模型+AV-blank组、模型+AV-PEDF组),每组20只。所有大鼠参照文献[3]的方法制作EIU动物模型。将霍乱弧菌内毒素LPS溶于无菌生理盐水中,配成质量浓度为2 g/L的注射液。模型组每只大鼠足底注射0.1 ml霍乱弧菌内毒素LPS注射液。同时模型+AV-blank组和模型+AV-PEDF组大鼠,经20%戊巴比妥钠(1 ml/kg)腹腔注射麻醉,微量加样器向右眼前房分别注射等量AV-blank和AV-PEDF10Ul(AV-PEDF109 Pfu)。7 d后大鼠心脏灌注4%多聚甲醛,颈椎脱臼法处死,取每组大鼠右眼球虹膜睫状体组织。
3.Western blot法检测:PEDF、VEGF、Notch1、DLL4、TLR4、MyD88、NF-κB p65相对表达量检测,取各组大鼠虹膜睫状体组织,添加细胞裂解液后机械匀浆、离心处理,取上清BCA法蛋白定量并调节蛋白浓度。取50 μg总蛋白用12%SDS-PAGE凝胶电泳,分离蛋白,切开凝胶转膜2 h至PVDF膜上,室温封闭膜6 0min后洗膜,添加一抗PEDF、VEGF、Notch1、DLL4、TLR4、MyD88、NF-κB p65,孵育(用0.02% Triton X一100按1:50稀释)后4 ℃过夜保存,次日使用TBST清洗,加入对应二抗,室温孵育2 h,Western洗涤液洗涤后显色、曝光、成像。
三、统计学分析方法
采用SPSS21.0软件分析,蛋白免疫印迹法数据资料经D检验(P=0.174)和w检验(P=0.184)呈正态分布,用均数±标准差表示,组间比较行单因素方差分析,组间均数比较采用turkey检验,采用双尾检测法,P<0.05有统计学差异。
结 果
一、各组大鼠PEDF、VEGF表达对比
如表1,图2所示,与模型组、模型+AV-blank组比较,模型+AV-PEDF组大鼠PEDF表达较高,差异具有统计学意义(P<0.05)。与模型组、模型+AV-PEDF组比较,模型+AV-blank组大鼠PEDF表达较低,差异具有统计学意义(P<0.05)。与模型组、模型+AV-blank组比较,模型+AV-PEDF组大鼠VEGF表达较低,差异具有统计学意义(P<0.05)。与模型组、模型+AV-PEDF组比较,模型+AV-blank组大鼠VEGF表达较高,差异具有统计学意义(P<0.05)。

表1 各组大鼠PEDF、VEGF表达对比
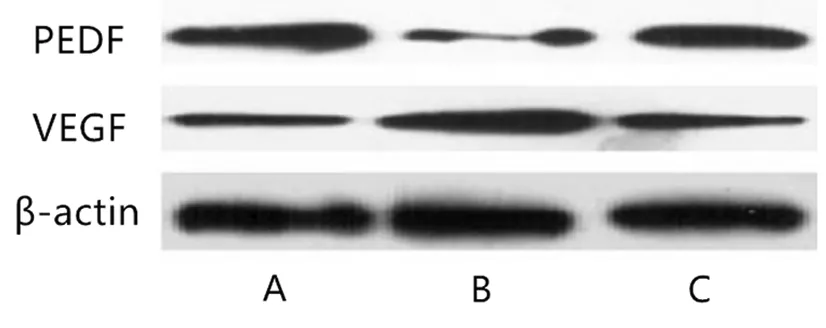
图2 PEDF、VEGF表达WB图

表2 各组大鼠Notch1、DLL4表达对比
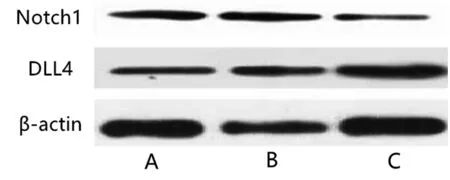
图3 Notch1、DLL4表达WB图
二、各组大鼠Notch1、DLL4表达对比
如表2、图3所示,与模型组、模型+AV-blank组比较,模型+AV-PEDF组大鼠Notch1相对表达量较低,差异具有统计学意义(P<0.05)。与模型组、模型+AV-blank组比较,模型+AV-PEDF组大鼠DLL4相对表达量较高,差异具有统计学意义(P<0.05)。
三、各组大鼠TLR4、MyD88、NF-κB通路蛋白表达比较
如表3、图4所示,与模型组、模型+AV-blank组比较,模型+AV-PEDF组大鼠TLR4、MyD88、NF-κB p65相对表达量较低,差异具有统计学意义(P<0.05)。

表3 各组大鼠TLR4/MyD88/NF-κB通路蛋白表达比较
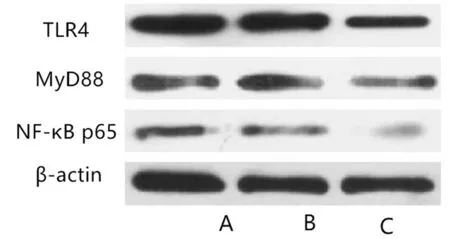
图4 TLR4/MyD88/NF-κB通路蛋白表达WB图
讨 论
葡萄膜炎是一种常见的致盲性眼科疾病,对患者身体健康、生活质量造成严重影响[7,8]。据相关流行病学调查数据显示,近年来我国葡萄膜炎发病率未出现下降趋势,每年新增葡萄膜炎病例数居高不下,引起广大专家学者的关注[9,10]。目前临床常用的治疗葡萄膜炎的手段为免疫抑制剂、抗生素、糖皮质激素治疗,但临床疗效并不理想,具有较高的复发率,甚至许多患者因此失明,因此越来越多专家学者开始致力于葡萄膜炎临床治疗的研究[11,12]。
PEDF为丝氨酸蛋白酶超家族的主要组成成员,大量实验研究表明,PEDF具有抗氧化、神经营养、抑制新生血管、抗炎、抗肿瘤等多种作用,同时越来越多的研究表明PEDF参与了炎症前和炎症反应过程。其表达变化参与炎症反应,在诸多眼科疾病发生发展过程中具有重要作用。研究表明单独其表达的下调即可以诱导炎症反应,提示其具有高效的抗炎作用[13]。其在眼内组织中分布广泛,角膜、睫状体、晶状体、脉络膜、视网膜均可以检测到PEDF mRNA和蛋白的表达,提示这些部位的某些细胞具有合成和分泌PEDF的能力,同时也反映出PEDF在这些中可能具有重要的功能作用[14]。
Notch信号通路对机体免疫应答、新生血管生长、发育具有调控作用,调控Notch通路蛋白Notch1、DLL4表达能够对树突状细胞免疫应答。在信号 通 路 中 Notch1 可 促 进 血 管 新 生 及 血 管 发 展, DLL4 可抑制血管出芽过程中端细胞的形成从而抑制血管 新生。DLL4是 Notch 信号通路中重要配体,在血 管形成中呈相反表达。同 时 还 发 现Notch 信号通路的激活可刺激VEGF上调[15]。但是尚未发现 Notch 信号通路在葡萄膜炎 中相关 研究。在眼部Zhang 研究发现PEDF可以通过稀释视网膜血管中VEGF的表达发挥抗炎作用[16]。本研究发现,与对照组相比,给与PEDF组 Notch1蛋白表达降低,DLL4 蛋白表达升高, VEGF的表达降低,提示PEDF可能通过抑制 Notch 信号通路,下调VEGF表达参与葡萄膜炎的发病过程。
TLR4/MyD88/NF-κB通路蛋白表达与机体炎症反应具有密切联系[17]。李上等[18]研究发现内毒素可以通过过度激活TLR4介导的天然免疫和获得性免疫,从而启动急性前葡萄膜炎,内毒素诱导的EIU虹膜内,TLR4及其下游信号传导分子MyD88/NF-κB的表达量发生改变,提示TLR4-MyD88依赖传导途径可能参与了EIU的发病.
本研究显示,腺病毒载体介导PEDF基因转染虹膜睫状体的大鼠TLR4、MyD88、NF-κB p65呈现降低,出现这一研究结果的原因可能是上调PEDF表达能够靶向调控TLR4/MyD88/NF-κB通路蛋白表达,从而起到抗炎作用,抑制葡萄膜炎症状的发生发展。Notch信号通路与TLR4-MyD88依赖传导途径的变化提示PEDF可能分别通过机体免疫应答、新生血管生长、机体炎症反应等多方面参与葡萄膜炎的病理过程。在今后的研究中心我们将进一步深入研究PEDF在每一种信号通路中的调控作用。
综上所述,腺病毒载体介导PEDF基因转染的大鼠虹膜睫状体组织中PEDF变化与Notch 信号通路,和TLR4/MyD88/NF-κB通路蛋白表达相关,这有助于人们对葡萄膜炎发病机理的认识,为葡萄膜炎的治疗提供基础依据。

