低氧对体外人子宫内膜蜕膜化基质细胞内膜崩解相关因子mRNA表达水平的影响
张欣,武斌,陈西华,王树芳,鲁聪,刘婷婷,杨旭清,贺斌,徐祥波*
(1.国家卫生健康委科学技术研究所,北京 100081;2.北京协和医学院研究生院,北京 100730;3. 山东大学附属济南市中心医院,济南 250013;4.新乡医学院,新乡 453003;5. 遵义医科大学,遵义 563006)
月经是女性体内重要的生理现象,自青春期开始至绝经结束,在雌激素和孕激素的严密调控下,子宫内膜可发生周期性变化即月经周期,月经周期通常分为增生期、分泌期、月经期。月经周期过程中子宫内膜、血管腺体发生动态变化,子宫内膜经历大规模崩解出血和重塑,但对于月经发生机制的研究目前仍不明确。经典的月经发生假说为Markee[1]利用恒河猴对月经发生开展的研究。在恒河猴的眼前房中植入人子宫内膜外植体,研究发现在月经产生前,螺旋动脉血管节律性舒张和收缩,螺旋动脉持续收缩约24 h后,子宫内膜组织发生崩解并出血。因此推测,月经可能是由于子宫内膜螺旋动脉持续收缩导致低氧,组织血供减少,缺血坏死从而崩解出血。
不同研究组关于低氧是否直接导致子宫内膜崩解等关键问题众说纷纭。子宫内膜的低氧状态可以通过子宫内膜血流减少、血氧分压降低和检测低氧标志物(派诺硝唑)判定。根据一项利用核素133氙(133Xe)清除技术的研究发现,子宫内膜血流在临月经期前或月经期间并未减少[2]。Gannon等[3]使用激光多普勒技术也未在人类月经周期各个时间发现子宫内膜组织低氧缺血或月经期出血的证据。Zhang等[4]研究发现,低氧条件下,与子宫内膜崩解密切相关的基质金属蛋白酶proMMP-1、proMMP-3和MT1-MMP的生成以及MMP-2的活化受抑制,低氧诱导因子(HIF)1A仅在少数人子宫内膜围月经期标本的基质细胞中存在。Coudyzer等[5]研究发现人子宫内膜异体移植物在激素撤退处理时会发生蜕膜化并崩解,但并未发现氧分压显著变化,只在部分移植物中发现低氧标志物派诺硝唑的表达。以上研究显示低氧状态并未在子宫内膜组织大范围存在,在子宫内膜崩解前并未出现低氧。然而,也有多项研究支持月经期间存在低氧现象。Fan等[6]发现在小鼠月经模型中,孕酮撤退后2 d,在组织边缘发现低氧标志物阳性显色。有研究发现孕酮撤退后8 h和24 h在子宫内膜的分离区和蜕膜化细胞中发现低氧状态存在[7-8]。本研究室前期研究利用小鼠月经模型发现在子宫内膜崩解期间HIF1A存在[9]且表达增加[10]。上述研究提示低氧与子宫内膜崩解相关,但是否存在始动关系并不明确。
本研究以体外人蜕膜基质细胞模型为基础,分别进行孕酮撤退/维持与不同氧浓度培养联合处理,探索HIF1A的表达与激活状态,以及不同孕酮浓度与氧分压条件下崩解相关基因MMPs的表达变化,以期探究低氧和HIF1A与子宫内膜崩解的始动关系。
材料与方法
一、研究对象
人子宫内膜组织样本取自月经周期10~15 d、因医学指征行子宫切除术的正常月经周期妇女(38~45岁,6例),所有对象在过去3个月未接受任何激素治疗。样本在组织学上被指定为增生晚期或分泌早期。根据之前文献方法[11-12]分离和培养人子宫内膜基质细胞(hESCs)。
二、主要试剂与仪器
孕酮(Sigma-Aldrich,美国),密封细胞培养箱(Thermo Fisher Scientific,美国),兔抗催乳素(PRL)多克隆抗体(1∶250,A0569,Dako,丹麦),苏木素伊红染液(珠海贝索)、山羊抗兔增强二步法检测试剂盒(PV-6001,北京中杉金桥)和DAB显色试剂盒(ZLI-9018,北京中杉金桥),核蛋白提取试剂盒(NE-PER,Thermo Fisher Scientific,美国),兔抗HIF1A单克隆抗体(1∶500,NB100-134,Novus,美国),兔抗β-Actin单克隆抗体(1∶2 000,北京科温),小鼠抗LAMIN-B1单克隆抗体(1∶200,SC-20682,Santa Cruz,美国),兔抗PRL单克隆抗体(1∶200,MA1-610,Invitrogen,美国),山羊抗兔二抗(proteintech,美国),山羊抗小鼠二抗(proteintech,美国),PRL检测试剂盒(SCA846Hu,武汉克隆科技),StepOneTM实时PCR系统(ABI,美国),Trizol(Invitrogen,美国),逆转录试剂盒(Takara,日本),SYBR Premix Ex TaqTMⅡ(Takara Bio,日本),Bis-Tris凝胶(Nu-PAGE Novex,Invitrogen,美国),聚偏二氟乙烯膜(PVDF,Millipore,英国),辣根过氧化物酶(HRP)标记小鼠抗兔IgG(1∶10 000,Sigma,英国),增强型化学发光(ECL)系统(P2300,苏州新赛美),化学发光仪(K3Plus,上海宝予德)。
三、研究方法
1.实验分组:将人子宫内膜蜕膜基质细胞按孕酮撤退(PW+)、孕酮维持(PW-)、正常氧培养(低氧-)、低氧培养(低氧+)联合处理,共分为4个实验组:PW-低氧-组,PW-低氧+组,PW+低氧-组,PW+低氧+组。孕酮撤退即使用无激素培养基替换原含激素的蜕膜化诱导培养基;孕酮维持即继续使用含激素的蜕膜化诱导培养基培养细胞。正常氧培养为21%O2的常规体外细胞培养条件;低氧培养为2%O2的低氧培养条件。除此之外,其他均按常规的体外细胞培养条件,即37℃、5%CO2和93%N2。
2.hESCs分离:将术中取下的人子宫内膜组织,在无菌条件下使用Hank’s缓冲液冲洗子宫内膜,洗净血凝块。将组织剪成1 mm×1 mm×1 mm左右的组织块,滤净缓冲液,加入3~5倍体积的0.25%胶原酶Ⅳ(Sigma,美国)混匀,置于37℃培养箱中60 min,每隔15 min混匀,使细胞充分分离。加入DNA酶(Merkur,美国),并用200目(孔径68 μm)、400目(孔径37 μm)和500目(孔径30 μm)的无菌不锈钢筛网依次过滤,收集过滤液,1 500 r/m离心5 min,弃去上清,沉淀主要为hESCs。
3.细胞培养与纯化:往沉淀中加入含10%活性炭吸附胎牛血清(charcoal stripped FBS,Gibco,Thermo Scientific,美国)、100 U/ml青霉素(Merkur,美国)和100 mg/ml链霉素(Merkur,美国)的无酚红DMEM/F12培养基(Gibco,Thermo Scientific,美国)重悬,台盼蓝染色计数,以5×106细胞量接种于25 cm2培养瓶(Corning,美国),培养瓶置于37℃、5%CO2培养箱中培养。利用子宫内膜基质细胞与上皮细胞贴壁时间的差异进行基质细胞纯化。细胞接种90~120 min后,更换新的培养基继续培养。
4.hESCs体外诱导蜕膜化:蜕膜化组处理方式为用含2%活性炭吸附胎牛血清(Gibco,Thermo Scientific,美国)、100 nmol/L甲羟孕酮(MPA)(Merkur,美国)、10 nmol/L雌二醇(E2)(Sigma,美国)、加入抗生素的无酚红DMEM/F12培养基(Gibco,Thermo Scientific,美国)联合培养hESCs 11 d,每48 h更换1次培养基。使用无激素基础培养基培养hESCs作为诱导对照组,培养11 d,每48 h更换1次培养基。
5.hESCs蜕膜化验证:采用细胞免疫组织化学法。用无菌多聚赖氨酸预处理玻璃片5 min,风干后,放入24孔或6孔板中,铺平。将细胞悬液滴入24孔板或6孔板中,待细胞长到一定时间,取出爬片。用PBS缓冲液清洗爬片10 s/次,使用4%甲醛固定15 min;PBS清洗5 min/次,洗2次,使用封闭液封闭10 min;加入兔抗PRL单克隆抗体4℃孵育过夜,PBS清洗5 min/次,洗2次;加入山羊抗兔增强二步法检测试剂盒(PV-6001,北京中杉金桥),37℃孵育1 h,PBS清洗5 min/次,洗2次;进行DAB显色、复染、脱水、透明、封片,在显微镜下进行阅片。
6. 细胞培养上清液中PRL的检测:使用化学发光免疫分析方法(CLIA)试剂盒(SCA846Hu,武汉克隆科技)。吸取蜕膜化组与诱导对照组的0、2、4、6、8和9 d细胞培养上清液,低温离心机12 000 r/m 离心5 min,吸取上清待测。标准品与待测样本在相同条件下,37℃孵育1 h;吸弃板中液体,加入检测溶液A 100 μl,37℃孵育1 h;洗板3次;加检测液B 100 μl,37℃孵育30 min;洗板5次;加底物100 μl,37℃孵育10 min;将测试板加入化学发光仪进行读数。
7. 实时定量PCR检测:利用Trizol从培养的hESCs中提取总RNA。用大约2 μg总RNA,通过逆转录酶合成cDNA。使用SYBR Premix Ex TaqTMⅡ试剂在StepOneTM实时定量PCR系统(Applied Biosystems,美国)上进行PCR检测,各基因使用特定的引物(引物序列详见表1)。使用β-Actin作为内部对照。热循环条件如下:启动激活周期95℃ 5 min,之后40个变性周期(95℃ 10 s),退火,扩增(60℃ 34 s)。测定人MMP-1、MMP-2、MMP-3、MMP-7、MMP-9和MMP-13的相对mRNA表达水平。所有反应重复3遍。使用2-ΔΔCt法进行定量计算,其中ΔΔCt为校准Ct值。

表1 实时定量PCR分析的引物序列
8.免疫印迹分析(Western blot):通过免疫印迹法分析检测HIF1A蛋白。使用核质提取试剂盒(Thermo Scientific,美国)提取胞核和胞浆蛋白。之后,以2∶1的比例将15 μg胞浆或胞核蛋白悬于Laemmli缓冲液(125 mmol/L Tris-HCl,4%十二烷基硫酸钠、5% 2-巯基乙醇、20%甘油和0.05%溴酚蓝)(上海碧云天),在95℃变性5 min。使用4%~12% Bis-Tris凝胶分离蛋白,转移到PVDF膜上。用含有吐温-20的5%脱脂奶粉Tris缓冲盐水(北京索莱宝)在室温下封闭膜1 h。将PVDF膜与抗HIF1A抗体4℃孵育过夜。对于胞浆蛋白,使用抗β-Actin抗体作为内参;对于胞核蛋白,使用抗-LAMIN-B1抗体作为内参。洗涤后,将膜与HRP标记的小鼠抗兔IgG室温孵育2 h。之后在PVDF膜上滴加ECL,使用发光仪进行蛋白显影。
四、统计学分析
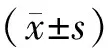
结 果
一、hESCs体外诱导蜕膜化
1.形态学观察:将纯化的hESCs接种到6孔板后,待细胞长到70%~80%(约3 d),然后进行诱导蜕膜化处理。诱导前,hESCs呈梭形,散落铺在6孔板上(图1A)。将hESCs诱导蜕膜化后,细胞形态开始变大变圆,细胞界限逐渐模糊(图1B),同时与诱导对照组的hESCs进行对比,诱导对照组细胞仍呈现梭形(图1C),细胞形态与诱导前细胞(图1A)几乎没有发生变化。
2.免疫组化法检测PRL蛋白的表达:结果显示,蜕膜化诱导后在细胞的胞浆中检测到PRL阳性信号(图1D)。
3.蜕膜化细胞上清液中PRL的浓度:诱导对照组PRL表达量一直维持在极低水平。蜕膜化诱导后,细胞上清液中PRL浓度随着时间延长逐渐增加,在蜕膜化诱导第8天达到峰值,第9天的表达量有所下降(图1E)。

A:hESCs蜕膜化诱导前;B:hESCs蜕膜化诱导后;C:hESCs诱导对照组;D:hESCs蜕膜化诱导后PRL蛋白表达;E:hESCs上清中PRL含量检测:与诱导对照组比较,**P<0.01。图1 诱导hESCs蜕膜化
二、各组细胞质和细胞核中HIF1A蛋白表达水平比较
结果显示,PW-低氧+组细胞质中HIF1A表达水平显著低于PW-低氧-组(P<0.05),而细胞核中的HIF1A表达水平显著高于PW-低氧-组(P<0.05);PW+低氧+组细胞质中HIF1A表达水平与PW+低氧-组无显著性差异(P>0.05);PW+低氧+组细胞核中HIF1A表达水平显著高于其他3组(P<0.05)(图2)。结果提示孕酮撤退与低氧能促进HIF1A激活。
三、各组细胞中MMPs mRNA表达水平比较
结果显示,PW-低氧+组与PW-低氧-组MMPsmRNA表达水平无显著性差异(P>0.05);但与PW-低氧-组比较,PW+低氧-组MMP-1、MMP-3及MMP-7 mRNA表达水平显著增高(P<0.05);与PW-低氧+组比较,PW+低氧+组MMP-1、MMP-3 mRNA表达水平显著增高(P<0.01)(图3)。

A:Western blot检测细胞质中HIF1A表达;B:Western blot检测细胞核中HIF1A表达;C:细胞质中HIF1A相对表达水平;D:细胞核中HIF1A相对表达水平。与PW-低氧-组比较,*P<0.05;与其他3组比较,#P<0.05。图2 各组人蜕膜化基质细胞中HIF1A表达
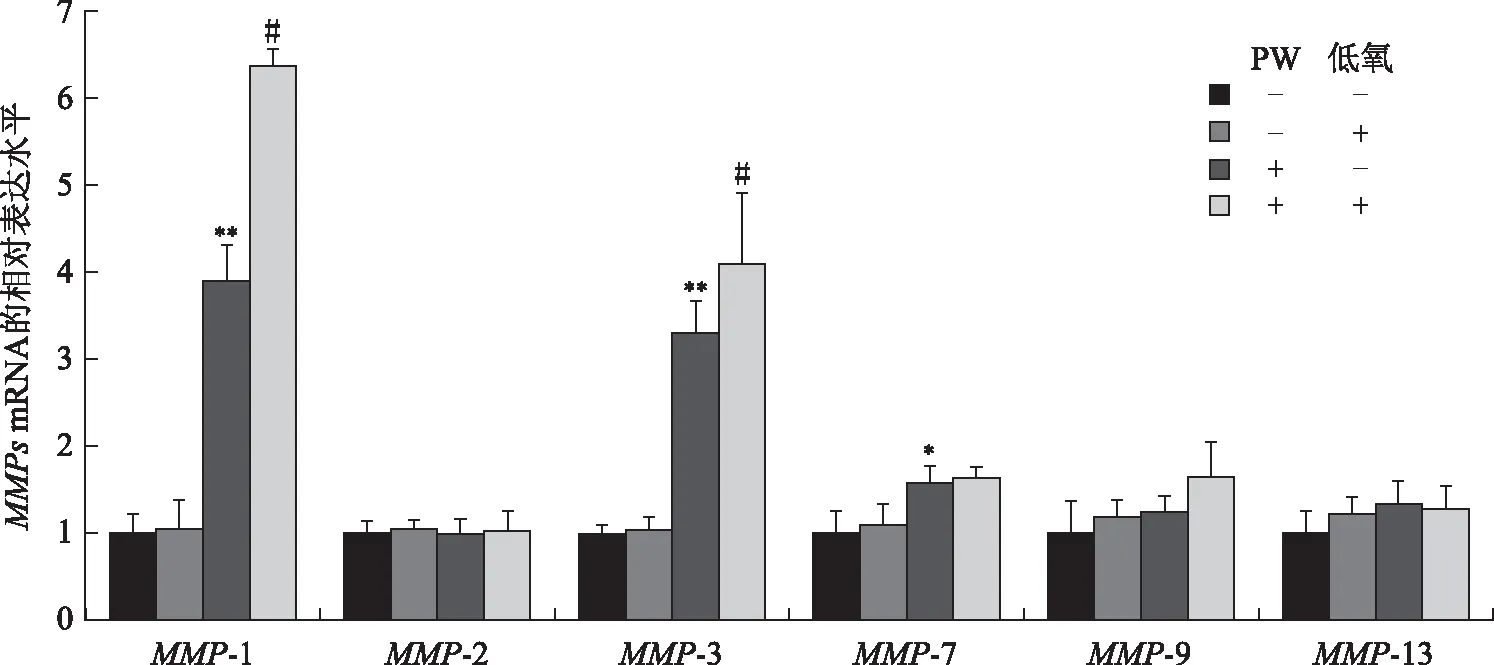
注:与PW-低氧-组比较,*P<0.05,**P<0.01;与PW-低氧+组比较,#P<0.01。图3 各组细胞中MMPs mRNA表达水平比较
讨 论
女性月经是重要的生理现象,其在雌、孕激素的严密调控下经历周期性变化。月经周期异常容易导致月经出血过多、月经不调、腹痛、闭经、绝经等,影响女性生殖健康和生活质量,甚至引发家庭经济问题[13]。月经发生相关的研究及其对女性生殖健康的影响仍然值得关注。
月经的发生需要必要的激素、hESCs蜕膜化和孕酮撤退这3个条件[14-15]。hESCs蜕膜化时基质细胞生化和形态学发生变化,这是发生在月经周期中后期的重要生理事件。在这一过程中蜕膜基质细胞变圆变大,这种形态学的改变导致PRL等标记基因的表达增加[16]。本研究通过观察hESCs的形态,检测细胞中PRL含量变化,验证hESCs体外诱导蜕膜化造模成功。
不同的研究组通过动物模型或人子宫内膜细胞对低氧与月经发生之间关系的研究结果各不相同。Reavey等[17]提出了一种非侵入性检测子宫内膜低氧的技术,并发现人月经周期子宫内膜中低氧标志物表达显著升高。同时本研究室前期研究中利用小鼠月经样模型发现在子宫内膜崩解期间HIF的表达增加[10]。本研究结果显示,PW-低氧+组与PW-低氧-组相比,细胞质的HIF1A表达明显降低,但胞核中的表达显著增高(P<0.05)。此外,PW+低氧+组和PW+低氧-组间,细胞质HIF1A表达水平无显著变化,但PW+低氧+组细胞核的HIF1A表达显著增高(P<0.05),提示孕酮撤退与低氧有利于细胞核中HIF1A的激活。有研究称,月经是孕酮撤退引发的生理事件[18],这也提示子宫内膜细胞崩解后低氧状态的存在。
hESCs发生蜕膜化时MMPs降解基质组织的行为增强[19]。MMPs是月经期间发挥重要作用的裂解酶,有文献报道MMPs在恒河猴子宫崩解期间发挥重要作用[20]。孕酮撤退使得MMP-1,-2,-3在月经周期表达下降,并抑制月经[21]。在Zhang等[4]的研究中,人子宫内膜细胞在低氧条件下通过激素撤退培养,这些低氧培养细胞之后进行正常氧恢复培养,结果显示低氧组MMP-2、pro MMP-1和pro MMP-3的产生被抑制。还有研究报道在低氧条件下培养24 h后,可以在整个子宫内膜外植体的培养物上清液中观察到MMPs的表达减少[22]。本研究检测崩解相关因子MMPs的表达,结果显示PW-低氧+和PW-低氧-组的MMPsmRNA表达无显著差异。但是,PW+低氧-组与PW-低氧-组相比,孕酮撤退使MMP-1、MMP-3及MMP-7 mRNA的表达显著增高(P<0.05);在PW+低氧+组,MMP-1表达水平比PW-低氧+组增高约5倍(P<0.01),MMP-3表达增高约3倍(P<0.01)。提示孕酮撤退显著提高了MMP-1、MMP-3和MMP-7的表达水平(P<0.01),这与先前在猕猴[21]、小鼠[23]和人类[24]研究子宫内膜崩解过程中关于MMP-1、MMP-3和MMP-7的研究结果一致。提示低氧参与了在子宫内膜崩解激活后MMPs的调节。孕酮撤退后低氧条件下显著增强了MMP-1和MMP-3的mRNA表达,表明MMP-1和MMP-3的表达是由孕酮撤退触发的,并且因低氧状态增强表达,低氧在子宫内膜崩解被激活后参与MMPs调节。这些体内和体外证据显示,低氧参与了子宫内膜崩解,但尚未确定孕酮撤退对低氧的功能调节。

