ω-3多不饱和脂肪酸应用于多囊卵巢综合征疗效的 Meta分析
田梦醒,胡仁崇,金鑫
(湖北省肿瘤医院营养科,武汉 430079)
多囊卵巢综合征(PCOS)是育龄妇女常见的内分泌疾病之一,患病率约为5%~10%,以高雄激素、排卵功能紊乱、卵巢多囊样改变为特征,临床症状有多毛、痤疮、月经紊乱、不孕等,常伴有胰岛素抵抗和肥胖[1-2]。目前PCOS暂无有效的治疗手段,以对症治疗为主,生活方式干预是PCOS治疗的一个重要部分,包括饮食、运动和行为干预等[3]。有研究提示,日常膳食中摄入适量的不饱和脂肪酸可以显著改善PCOS患者血脂异常、血管内皮功能受损和胰岛素抵抗[4],《多囊卵巢综合征中国诊疗指南》里将不饱和脂肪酸代替饱和脂肪酸作为饮食干预的方法之一[5]。ω-3多不饱和脂肪酸(ω-3 PUFAs)是人体正常生长发育必不可少不可或缺的重要免疫营养素,主要分为植物来源的α-亚麻酸(ALA)、动物来源的二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),具有抗炎、免疫调节和改善代谢异常的作用[6]。近几年,多个随机对照研究评估了口服补充ω-3 PUFAs对PCOS患者代谢及内分泌指标的影响,但结论不一。本研究旨在通过Meta分析评估ω-3 PUFAs应用于PCOS中的疗效。
资料与方法
一、文献检索
计算机检索PubMed、Medline、Web of Science、The Cochrane Library、Embase、中国知网、万方数据库与维普数据库,检索时限为建库时间至2020年1月31日,设定检索式检索文献。英文检索式为(Polycystic Ovary Syndrome OR PCOS OR Ovary Syndrome,Polycystic OR Stein Leventhal Syndrome OR Sclerocystic Ovaries) AND(fatty acids,omega-3 OR n-3 fatty acids OR n-3 polyunsaturated fatty acid OR pufa,n-3 OR fish oils),中文检索式为[(ω-3多不饱和脂肪酸)或(n-3多不饱和脂肪酸)或(鱼油)]和[(多囊卵巢综合征)或(ω-3多不饱和脂肪酸)]。为了避免文献检索不充分,追溯纳入文献的参考文献并补充相关文献。
二、纳入及排除标准
纳入标准:(1)研究类型是国内外期刊公开发表的临床随机对照试验(RCT),原始数据完整;(2)研究对象为经鹿特丹准则[7]或美国国立卫生研究院(NIH)标准[8]诊断为PCOS的患者;(3)研究内容包括比较PCOS患者使用ω-3 PUFAs与安慰剂的治疗前、后代谢或内分泌指标改善情况的相关研究;(4)干预措施:口服ω-3 PUFAs的作为干预组,口服安慰剂的作为对照组。
排除标准:(1)合并其他疾病且不能排除其影响的研究;(2)重复发表的文献;(3)无法获得全文、未提供原始数据、未提供充足数据的文献(研究结果无法提取或转化)。
三、文献资料提取
由2位评估员独立按照文献纳入、排除标准对文献进行筛选,提取相关的研究数据并交叉核对,如遇分歧,则共同讨论解决或由第三方评价后决定。资料提取的主要内容包括:(1)基本信息:作者、发表年份、国家、样本量;(2)干预措施:ω-3 PUFAs剂量、疗程;(3)观察指标:激素水平指标[性激素结合球蛋白(SHGB)、总睾酮(TT)、硫酸脱氢表雄酮(DHEAS)、黄体生成素(LH)、卵泡刺激素(FSH)]、代谢相关指标[体质量指数(BMI)、胰岛素抵抗指数(HOMA-IR)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、超敏C反应蛋白(hs-CRP)、高密度脂蛋白胆固醇(HDL-C)]及多毛症评分(mF-G)。
四、文献质量评价
由2位研究者独立按照Cochrane手册偏倚风险评估工具进行文献质量评价,包括文献随机序列的产生、随机化分配隐藏方法、盲法、结局指标数据的完整性、选择性报告数据、其他偏倚来源等。
五、GRADE分级
GRADE分级通过研究局限性、不一致性、间接性、不精确性及发表偏倚5个降级因素对结局指标进行证据质量评级,分为高级、中级、低级、极低级4个等级,其中RCT证据质量评级被预设为高级,降1级为中级,降2级为低级,降3级为极低级。GRADE分级均由2名研究员独立完成,完成后进行交叉核对,如遇分歧则由第 3 位研究员进行仲裁。
六、统计分析
采用RevMan 5.4和Stata 14.0软件进行Meta分析数据合并。计数资料采用比值比(OR),各效应量均给出其点估计值和95%可信区间(95%CI)。采用χ2对各研究结果间的异质性进行分析(α=0.01),结合I2判断异质性大小。若研究结果间无统计学异质性(I2<50%或P>0.01),则采用固定效应模型进行Meta分析;若存在统计学异质性(I2>50%或P<0.01),则进一步分析异质性来源,排除明显临床异质性影响后,采用随机效应模型进行Meta分析。若各研究结果间存在明显临床异质性,则进一步采用亚组分析或敏感性分析。对可能影响结果的异质性因素进行亚组分析:(1)根据世界卫生组织(WHO)肥胖分级标准[9](亚洲标准:BMI>25 kg/ m2,国际标准:BMI>30 kg/m2),对纳入研究中患者的基线BMI按照肥胖和非肥胖进行亚组分析;(2)将干预时间按照>12周或≤12周进行亚组分析。通过逐一剔除每一个纳入的研究后再进行效应量合并进行敏感性分析。采取漏斗图和Egger’s检验法分析潜在的发表偏倚。
结 果
一、文献检索及结果
共获得相关文献271篇,剔除重复文献后剩余155篇,阅读文献标题和摘要剔除非RCT及无关文献后剩下43篇,再仔细阅读全文剔除不符合纳入标准的文献25篇和低质量文献3篇,最后纳入文献15篇,全部为英文文献。所纳入的文献中研究对象共870例,干预组417例,对照组453例。文献检索流程见图1。
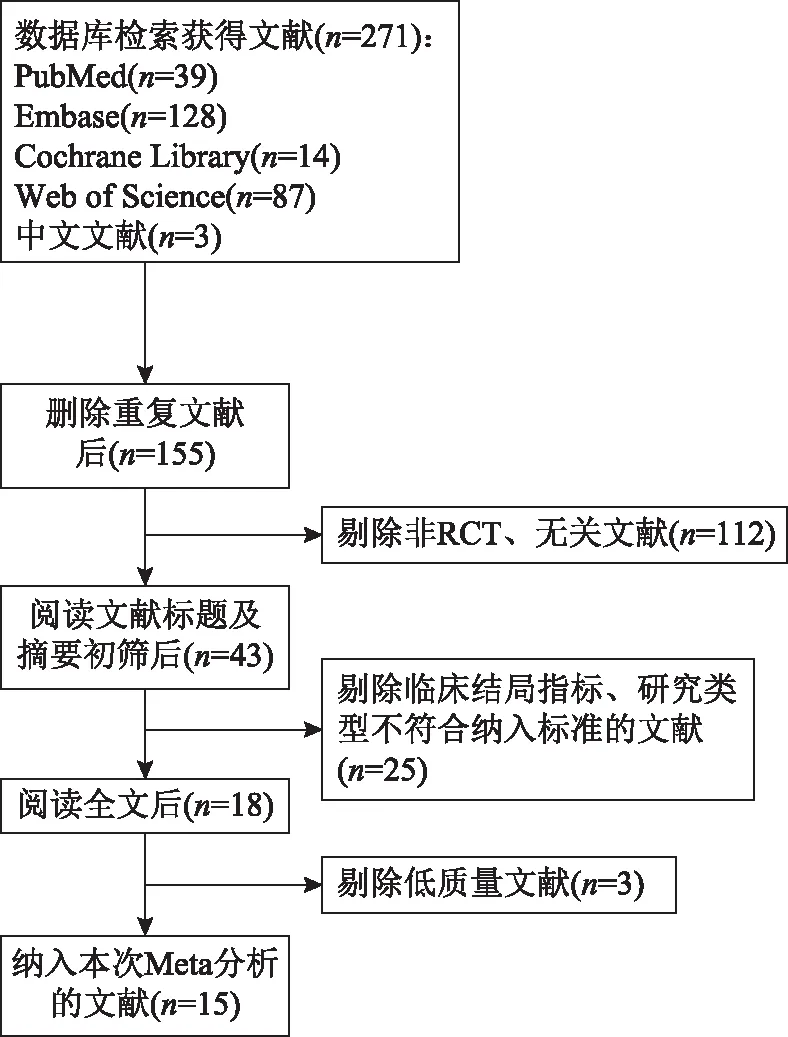
图1 文献检索流程图
二、纳入文献的基本特征及文献质量评价
最终纳入Meta分析的有15篇文献,其中3篇文献[10-12]的数据来源为同一研究,故只取其中1篇。另外Karakas等[13]的研究中设有2个ω-3 PUFAs干预组,根据Cochrane手册,分别将这2个干预组作为独立的2个两两对照研究分析(Karakas a和Karakas b)。最终纳入的研究为13个,基本信息详见表1,文献质量评价结果详见图2。
三、Meta分析结果
1.ω-3 PUFAs对PCOS患者代谢的影响:纳入研究的结果合并后,指标BMI、TG、TC、LDL-C、HDL-C、hs-CRP均存在显著异质性,故采用随机效应模型分析,HOMA-IR采用固定效应模型分析。结果显示,与对照组相比,补充ω-3 PUFAs可以显著降低PCOS患者TG、HOMA-IR水平(P<0.01),但对PCOS患者的BMI、TC、LDL-C、HDL-C、hs-CRP水平无显著影响(P>0.05)(表2、图3~4)。
2.ω-3 PUFAs对PCOS患者激素水平的影响:纳入研究结果合并后,DHEAS有显著的异质性,故采用随机效应模型分析,其他指标选择固定效应模型分析。结果显示,与对照组相比,补充ω-3 PUFAs可以显著降低PCOS患者DHEAS水平(P=0.03),但对SHGB、TT、LH、FSH水平无显著影响(P>0.05)(表3、图5)。
3.ω-3 PUFAs对PCOS患者多毛症的影响:纳入研究中有5篇文献报道了干预前后的mF-G评分,且mF-G评分之间无显著异质性,故采用固定效应模型分析。结果显示,与对照组相比,补充ω-3 PUFAs对mF-G评分无显著影响(P>0.05)(图6)。
4.亚组分析:由于纳入研究的文献统计学异质性较大,故分别对不同干预时间和不同BMI分级进行亚组分析。

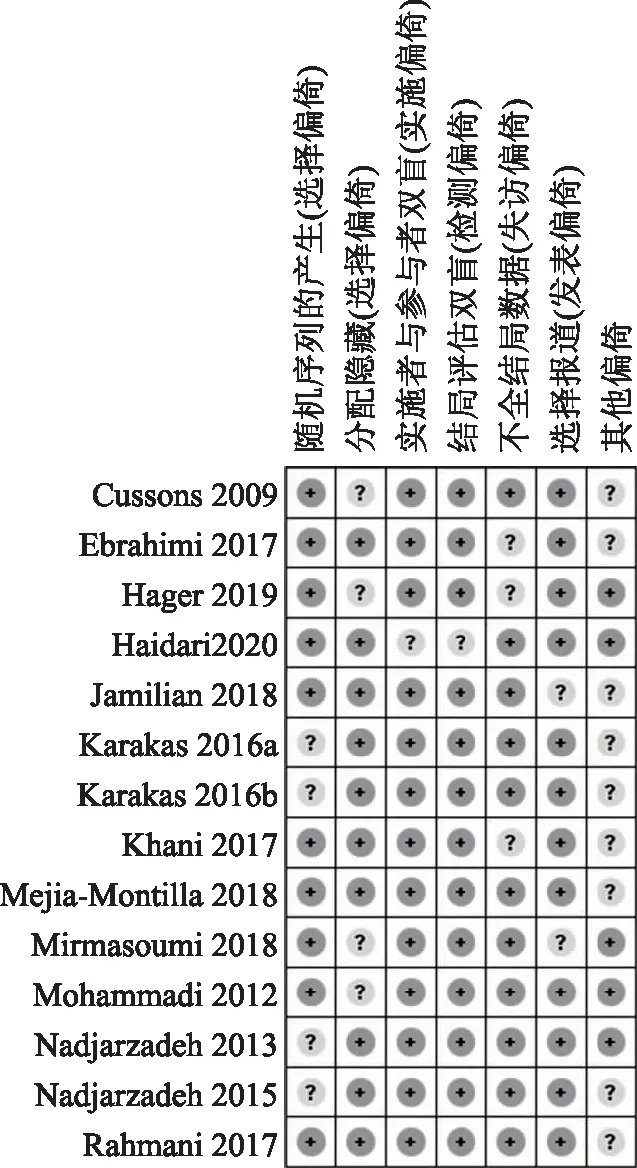
图中“+”“?”分别表示低风险偏倚、风险偏倚不确定。图2 纳入文献偏倚风险总结图
不同干预时间的亚组分析:干预时间按照≥或<12周进行亚组分析。分析结果显示,干预时间≥12周的研究中,干预组的BMI[MD=-0.06,95%CI(-1.27,0.04),P=0.04]、TG[MD=-14.86,95%CI(-21.92,-7.81),P<0.01]、LDL-C[MD=-10.23,95%CI(-19.81,0.65),P<0.01]、hs-CRP[MD=-1.04,95%CI(-1.55,-0.54),P<0.01]水平较对照组显著降低,HDL-C[MD=4.05,95%CI(2.02,6.07),P<0.01]显著升高;而TC的改变无统计学意义(P>0.05)。干预时间<12周的研究中,与对照组相比,干预组TG[MD=-12.04,95%CI(-24.06,0.02),P<0.01)显著下降,而DHEAS、BMI、TC、HDL-C、LDL-C、hs-CRP的差异均无统计学意义(P>0.05)。
不同BMI分级的亚组分析:对观察结果中异质性较大的指标BMI、TC、LDL-C、HDL-C、hs-CRP、DHEAS及HOMA-IR以不同BMI分级进行亚组分析。分析结果显示,肥胖型PCOS的研究中,干预组的DHEAS[MD=-0.07,95%CI(-0.63,-0.17),P=0.000 5]、HOMA-IR[MD=-0.40,95%CI(-0.63,-0.17),P<0.000 1]较对照组显著降低,其他指标无显著性改变(P>0.05)。非肥胖型PCOS的研究中,干预组的TC[MD=-21.50,95%CI(-26.91,-16.09),P<0.000 1]、LDL-C[MD=-25.70,95%CI(-29.48,-21.92),P<0.000 1]、HDL-C[MD=4.90,95%CI(3.17,6.63),P<0.000 1]、hs-CRP[MD=-1.00,95%CI(-1.81,-0.19),P<0.000 1]和HOMA-IR[MD=-0.40,95%CI(-0.63,-0.17),P<0.000 1]较对照组显著降低,而DHEAS无显著性差异(P>0.05)。
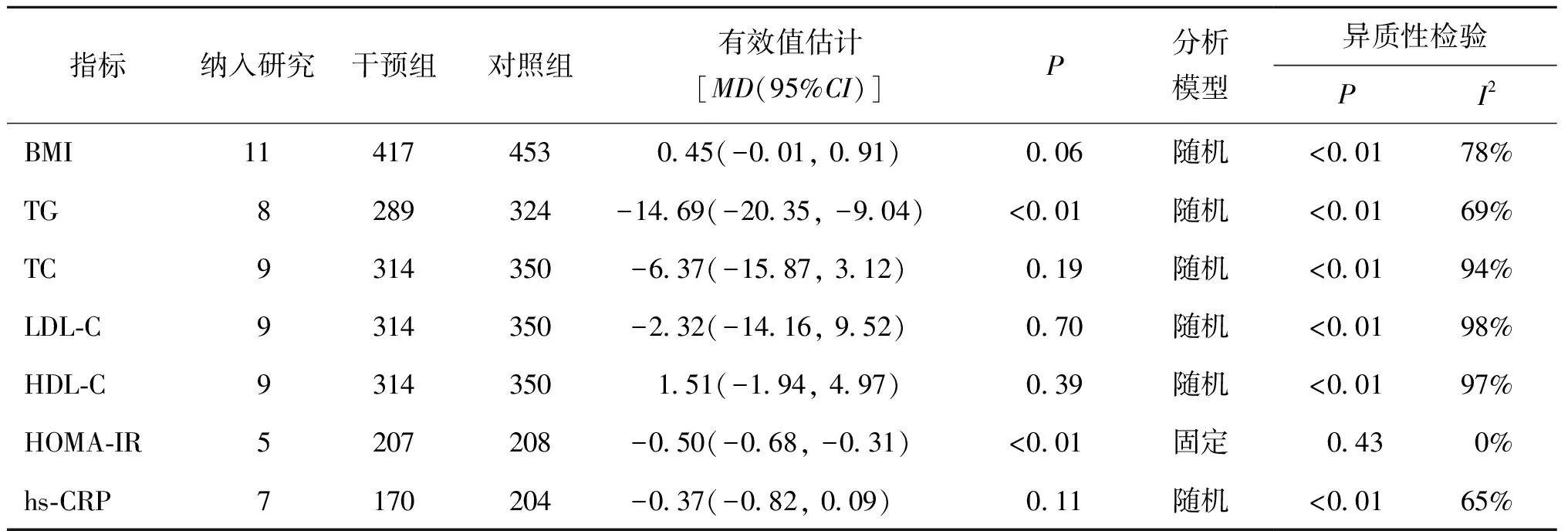
表2 纳入文献代谢相关指标的Meta分析结果
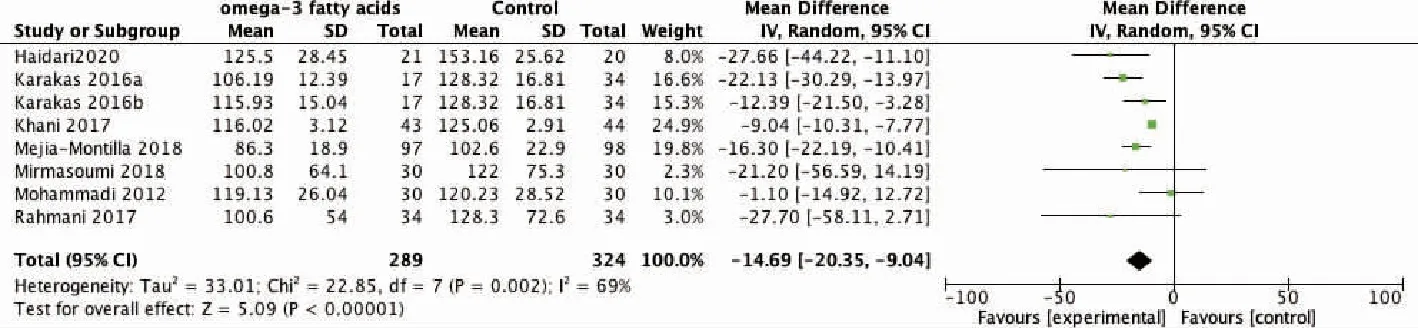
图3 代谢指标TG比较的森林图

图4 代谢指标HOMA-IR比较的森林图
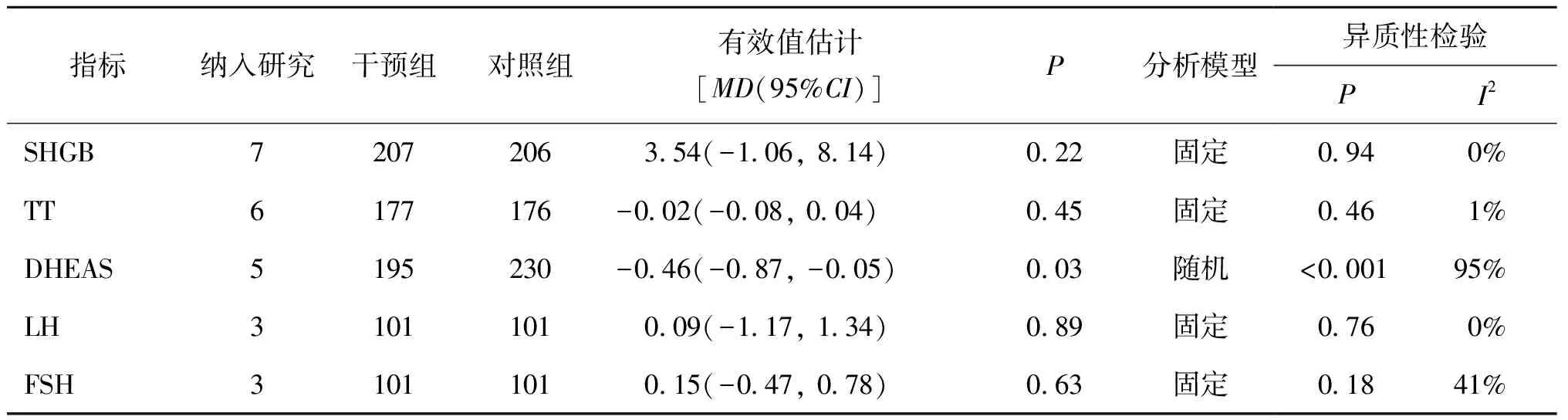
表3 纳入文献激素水平指标的Meta分析结果
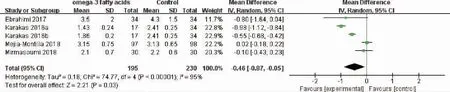
图5 激素水平指标DHEAS比较的森林图
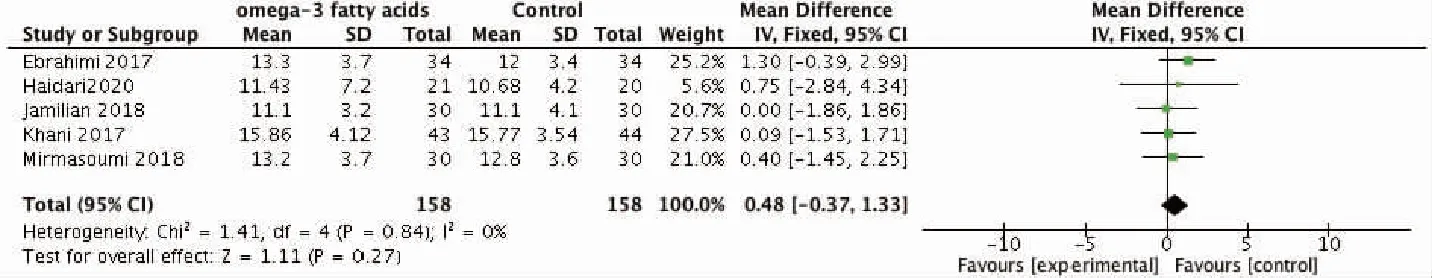
图6 mF-G评分比较的森林图
5.敏感性分析:对异质性大(I2≥50%)的指标BMI、TC、LDL-C、HDL-C、hs-CRP、TG、DHEAS进行敏感性分析,在逐项排除某一研究后,TG、hs-CRP、DHEAS的结果与排除前一致,提示系统评价结果稳定。BMI、TC、LDL-C、HDL-C的结果与排除前的结果不一致,排除Karakas等[13]的研究后,结果显示,补充ω-3 PUFAs可以降低PCOS患者的BMI、TC水平,差异有统计学意义(P<0.05);提示系统评价的结果不稳定。
6.发表偏倚分析:以效应指标SMD为横坐标、se(SMD)为纵坐标分别对各研究结果绘制漏斗图,结果提示指标TC、DHEAS的漏斗图左右不完全对称(图7~8),纳入文献可能存在发表偏倚。并采用Egger’s检验法对绘制的漏斗图进行检验,结果显示:TC(t=3.24,P=0.014)、DHEAS(t=-3.39,P=0.043)的漏斗图不对称,提示纳入的文献存在发表偏倚。
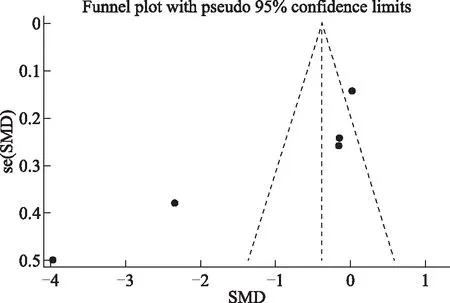
图7 TC发表偏倚分析漏斗图
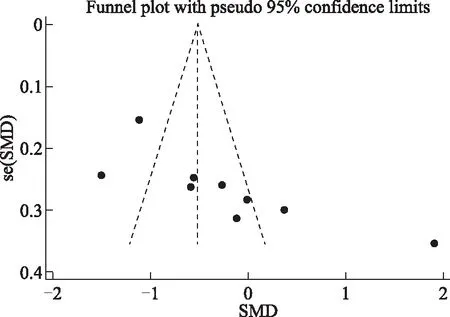
图8 DHEAS发表偏倚分析漏斗图
四、GRADE证据分级结果
13篇文献中应用到本Meta分析的结局指标共涉及13个,其中HOMA-IR的 GRADE分级为中级,LH、FSH、TT、mF-G评分的GRADE分级为低级,其余结局指标GRADE分级均为极低级(表4)。
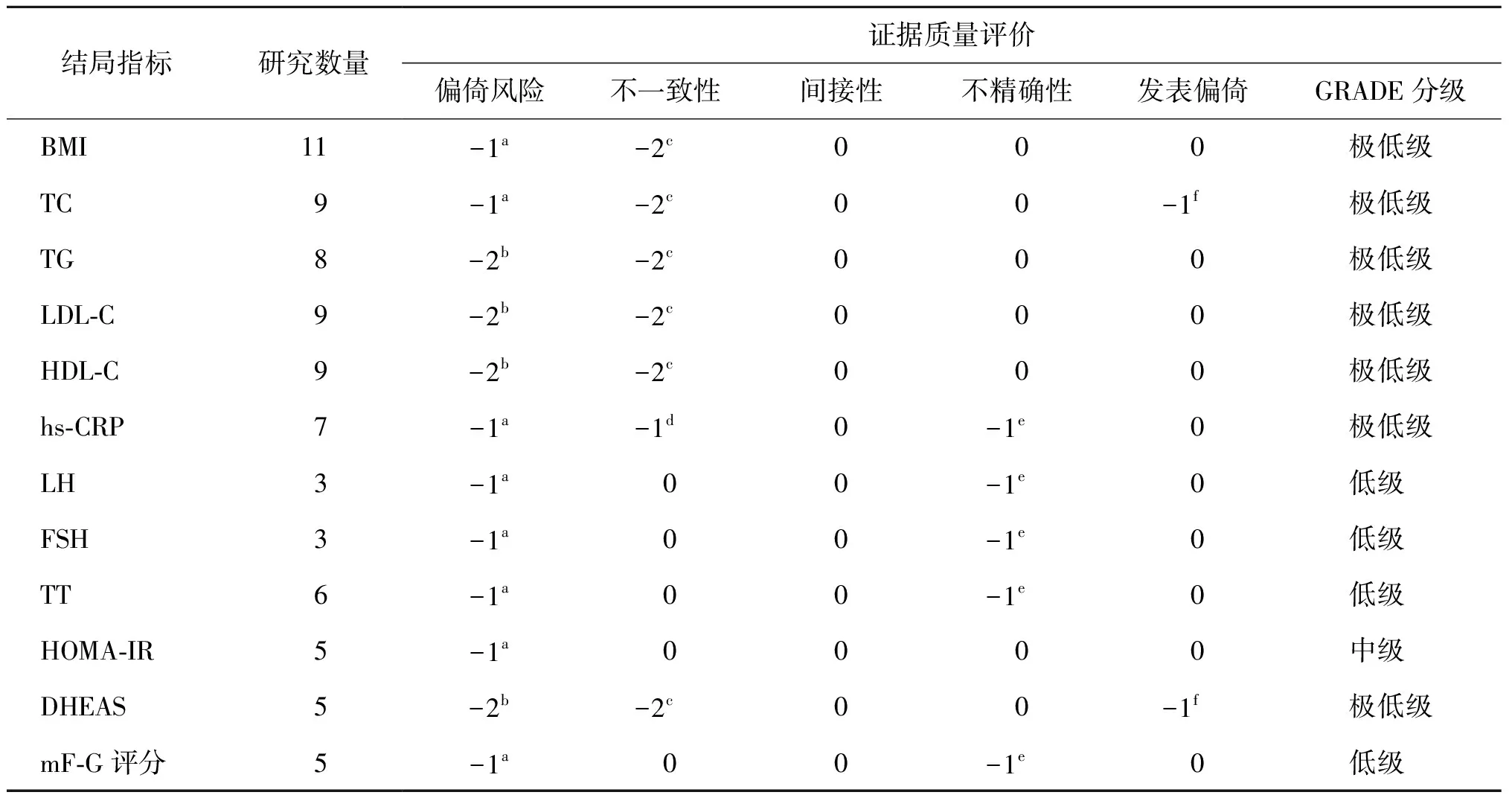
表4 GRADE证据分级结果
讨 论
本篇Meta分析结果提示ω-3 PUFAs能调节PCOS患者血脂代谢紊乱、胰岛素抵抗及激素水平,显著降低患者TG、HOMA-IR和DHEAS水平,然而对改善患者BMI、TC、HDL-C、LDL-C、hs-CRP、TT、SHBG、LH、FSH和mF-G评分无显著作用。
PCOS患者大多存在代谢功能异常,合并全身或腹部肥胖、脂代谢紊乱、胰岛素抵抗等[25]。有研究报道50%以上的PCOS患者存在超重/肥胖,肥胖与胰岛素抵抗交互作用,加重PCOS的病理生理改变,约70%的PCOS患者存在脂代谢紊乱,主要特点表现为TG、TC、LDL-C增高,HDL-C降低[26],其发生机制可能与PCOS患者脂代谢相关调控因子基因表达异常以及机体慢性低度炎症有关。慢性低度炎症在PCOS发病机制中起着重要的作用,对PCOS患者的胰岛素抵抗、高雄激素血症和远期心血管并发症产生影响[27]。大量临床研究证据表明,ω-3 PUFAs通过调控脂肪组织基因的表达[28]、改变脂肪细胞因子释放或影响其介导的相关信号通路[29]、调节肠道菌群[30]等降低TG、TC、LDL-C水平,增加HDL-C水平。另外,ω-3 PUFAs能够减少炎症因子分泌,起到抗炎作用[31]。Derosa等[32]对血脂异常患者给予ω-3 PUFAs(3 g/d)干预6个月时间,与对照组相比,补充ω-3 PUFAs可以显著降低血脂异常患者空腹血糖(FPG)、TG、炎症因子IL-6水平,故ω-3 PUFAs可能在改善PCOS患者脂肪代谢紊乱、预防远期心脑血管相关并发症中发挥积极作用。但是本Meta分析结果显示,补充ω-3 PUFAs仅能降低PCOS患者TG,对其他代谢指标如TC、LDL-C、HDL-C等无明显改变。亚组分析结果提示,干预时间≥12周时,补充ω-3 PUFAs可以降低患者BMI、LDL-C、hs-CRP,提高HDL-C水平(P<0.05),提示ω-3 PUFAs改善PCOS患者血脂、BMI和慢性低度炎症状态可能受干预时间影响。另外,非肥胖PCOS患者,给予ω-3 PUFAs干预后,除BMI没有显著改变外,TC、LDL-C、HDL-C、hs-CRP和HOMA-IR均有显著降低(P<0.05),但肥胖PCOS患者BMI、脂代谢指标及hs-CRP均都无显著改变。肥胖PCOS患者BMI更大,脂代谢异常更加严重,肥胖与高雄激素血症交互作用更加复杂[33],不同分型的PCOS患者的临床特征有较大差异,故ω-3 PUFAs应用于PCOS时应该根据患者情况制定个性化综合治疗方案。
胰岛素抵抗被证实是PCOS发生、发展的重要病理机制[34],胰岛素抵抗的存在不仅会影响患者糖代谢和血脂水平导致代谢紊乱,而且还会导致体内游离雄激素水平增加,是高雄激素血症的诱因。如果能改善PCOS患者胰岛素抵抗症状,对预防由于胰岛素敏感性异常所导致的代谢综合征和高胰岛素血症造成的并发症有积极作用[35]。ω-3 PUFAs可促进胰岛素样生长因子-1(IGF-1)的分泌,改善胰岛素抵抗症状,进而提高机体的胰岛素敏感性[36-37]。PCOS由于神经内分泌障碍的性质不同分为肥胖型和非肥胖型,肥胖型PCOS患者与非肥胖型PCOS患者相比,存在更加严重的高胰岛素血症、胰岛素抵抗、高雄激素血症[38]。本研究结果显示,无论是对肥胖还是非肥胖PCOS患者,补充ω-3 PUFAs均可以降低HOMA-IR水平,说明其对改善患者PCOS患者胰岛素抵抗有一定作用。
高雄激素血症是PCOS患者的特异性改变,其发病机制十分复杂,临床症状主要表现为多毛、痤疮和脱发,严重时会引起月经紊乱和排卵障碍,导致不孕。TT和DHEAS分别为卵巢源性及肾上源性雄激素的评估指标[38-39],SHBG在肝脏中的表达受到抑制时,可导致体内游离雄激素水平增加,这3个指标都在一定程度上反映PCOS患者的雄激素水平。此外,PCOS患者除体内雄激素水平高,同时还伴有LH/FSH比值增高及LH升高,LH和FSH是调节女性体内激素水平的关键指标,LH和FSH水平的降低在一定程度上可以改善高雄激素血症,进而改善PCOS患者激素水平紊乱。在一项随机双盲对照试验研究中,给PCOS患者连续服用ω-3 PUFAs胶囊8周后,患者TT、LH水平及LH/FSH比值明显降低[22]。多个研究研究提示通过摄入ω-3 PUFAs对PCOS患者由于高雄激素水平造成的并发症如多毛[20]、皮脂腺增生引起的脱发[16]等有一定的干预效果。其作用机制可能是:ω-3 PUFAs通过对花生四烯酸的抑制,阻碍其代谢产物对类固醇激素合成急性调节蛋白(StAR)基因的表达,进而调节体内激素水平[40]。但在Haidari等[24]的研究中,补充ω-3 PUFAs后与对照组相比,ω-3 PUFAs组PCOS患者虽然月经规律比例更高,但对患者血清TT、SHBG无明显改善。本研究结果显示,补充ω-3 PUFAs仅能有效降低患者的DHEAS水平(P<0.05),但对于改善患者血清总TT、SHBG、LH、FSH、mF-G评分却无明显作用。提示ω-3 PUFAs对调节PCOS患者激素水平的作用尚不明确,还需进一步大样本临床研究证实。
本研究纳入文献大多是RCT,各研究的基线资料具有一定的可比性。但是研究依然存在一些局限:(1)各项研究多个指标存在较大的统计学异质性(I2>50%),异质性与患者的病情、干预时间、干预剂量、地区、实验设计不一致有关;(2)本研究中的观察指标(TC、DHEAS)可能存在发表偏倚,进而导致Meta分析结果高于或低于真实结果;(3)不同临床研究中,测定指标的方法和参考标准的不同可能导致合并指标存在偏倚;(4)观察指标的GRADE证据质量评级,大部分为低级和极低级,因此,今后还需更多临床研究验证结果的准确性;(5)纳入文献中样本量均较少,可能导致合并后结果不精准;(6)纳入文献中,虽然干预方式都以给予ω-3 PUFAs为主,但有的研究同时指导改善生活方式、联合补充维生素E、维生素D及混合微量营养素等,也可能导致合并指标存在偏倚;(7)ω-3 PUFAs可以通过植物油、鱼油及深海鱼等日常饮食摄入,虽然摄入量无法精准评估,但是对患者体内ω-3 PUFAs水平有一定的影响,而此次纳入的很多研究中并未提及这一类影响。
综上所述,ω-3 PUFAs应用于PCOS患者有一定疗效,但因为本研究仍然存在各种局限性,对结论的外推有一定影响;后续仍需要设计更严谨的高质量随机临床研究加以探讨验证。

