激活的富血小板血浆对卵巢储备功能降低患者卵丘颗粒细胞凋亡和增殖的影响
朱文倩,张慧敏,李磊,赵明子,郝翠芳*
(1.滨州医学院,烟台 264003;2.青岛大学附属妇女儿童医院,青岛 266000;3.青岛大学医学部,青岛 266000)
卵巢储备功能与女性的生殖潜能密切相关,其主要受卵巢内存留的卵泡数量和质量影响。若卵巢内存留的可募集卵泡数目减少、卵母细胞质量下降,导致生育能力降低或出现过早绝经倾向,称为卵巢储备功能降低(Diminished Ovarian Reserve,DOR),临床表现为月经量少、月经稀发、闭经、不孕等。DOR在女性不孕因素中约占10%[1],通常受年龄、遗传、手术、免疫功能异常及环境等因素的影响。DOR女性不仅受孕率低,活产率也很低[2],常规治疗策略有应用促性腺激素释放激素激动剂、激素替代疗法和辅助生殖技术,但治疗效果常常不令人满意,因此改善DOR导致的不孕症成为生殖领域的一项难题。既往有关DOR的研究主要集中于寻找预测及评估卵巢功能的有效指标[3],对DOR干预策略研究较少。
富血小板血浆(Platelet-Rich Plasma,PRP)治疗对DOR或许是一个很好的选择。PRP是将动物或人的全血经过离心后得到的富含高浓度血小板的血浆,其血小板及生长因子浓度约为自体血浆的3~5倍,PRP在医学其他领域已有一些研究及应用[4]。由PRP产生的多种生长因子通过调控多种信号通路影响细胞的分化、增殖等生物学功能[5]。现有研究发现,卵巢内注射PRP可改善DOR患者的激素水平,增加其卵母细胞数量,改善卵巢功能并获得更好的生育结局[6-7]。
DOR与颗粒细胞凋亡密切相关。既往研究发现颗粒细胞凋亡是卵泡闭锁的主要原因[8];且凋亡率越高,出现空卵泡概率越高,卵母细胞和胚胎的质量也越差[9]。一项前瞻性临床试验显示,与卵巢储备正常的女性相比,DOR女性的颗粒细胞凋亡率显著增加,且与卵巢反应、卵母细胞产量、MⅡ获卵数、双原核(2PN)卵裂数、D3优胚数、囊胚形成率、冷冻胚胎数等参数呈负相关[10]。因此本研究通过体外培养DOR患者卵丘颗粒细胞,探究PRP对DOR患者卵丘颗粒细胞增殖和凋亡的影响,以期为DOR的临床治疗提供依据。
资料与方法
一、研究对象及样本收集
选取2020年8月至2021年9月在青岛妇女儿童医院生殖医学中心行常规IVF/ICSI-ET治疗的DOR不孕症患者82例,收集每一例患者的卵丘颗粒细胞,并将所获细胞平均分为PRP组(使用激活的PRP+培养液培养)和对照组(仅使用培养液培养),用于后续研究。
DOR目前尚无被临床广泛认可且统一的诊断标准,本研究将2011年欧洲人类胚胎与生殖学会发表的卵巢低反应(POR)共识(博洛尼亚共识)中对卵巢储备功能异常的描述作为本次研究对象的纳入标准:血清抗苗勒管激素(AMH)<1.1 ng/ml或基础窦卵泡计数(AFC)<5~7个[11];同时体质量指数(BMI)<25 kg/m2、基础体温呈双相型、血清泌乳素水平在正常范围、受试前6个月未服用过激素类药物、无卵巢手术史。排除标准:多囊卵巢综合征患者、子宫内膜异位症患者、内分泌疾病以及盆腔结核患者。
本研究经青岛妇女儿童医院医学伦理委员会审查通过,所涉及的患者均已充分告知并签署知情同意书,且本研究所收集的样本均为医疗遗弃物,对患者无影响。
二、材料
1.主要试剂和仪器:主要试剂:卵泡刺激素受体(FSHR)抗体(22665-1-AP,Proteintech,美国);细胞增殖及毒性检测试剂盒(CCK-8试剂盒)(CA1210,北京索莱宝);TUNEL细胞凋亡检测试剂盒(A111,南京诺唯赞);凝血酶(来源于牛血浆)(AS00254,Sigma,美国);血液保存液(威海洁瑞);DEME-F12培养基(山东思科捷);RNA快速提取试剂盒(AC0201,山东思科捷);逆转录试剂盒(AG0304,山东思科捷);SYBR Green qPCR试剂盒(AG11702,湖南艾科瑞);qRT-PCR引物由北京擎科生物科技有限公司合成,具体信息见表1;Bcl-2抗体(兔,A0208)、Ki-67抗体(兔,A2094)、Bax抗体(兔,A15646)均自武汉爱博泰克;鼠抗山羊IgG二抗(A23410)、兔抗山羊IgG二抗(A23230)购自武汉Abbkine;雌二醇检测试剂盒(电化学发光法)购自上海罗氏。
主要仪器:Quant StudioTM5实时荧光定量PCR仪(C480,Roche,美国);荧光显微镜(BX51,日本Olympus);酶联免疫检测仪(Bio Tek,美国);罗氏全自动发光仪(COBAS600,上海罗氏)。

表1 qRT-PCR引物序列
2.细胞株:人卵巢颗粒细胞(KGN细胞)购自中国科学院细胞库。
三、研究方法
1.人卵丘颗粒细胞的获取:DOR患者注射HCG扳机后36 h,在超声引导下经阴道穿刺抽吸直径≥14 mm的卵泡,对获取的卵母细胞-卵丘颗粒细胞复合物(COC)机械分割后获取卵丘颗粒细胞,PBS清洗3遍,使用0.1%的透明质酸酶消化并反复吹打,使细胞团分散为单个细胞。
2.细胞培养:将上述颗粒细胞均分为PRP组和对照组,置于96孔板中于37℃、5%CO2环境中培养。PRP组使用激活的PRP(1%)+含10%胎牛血清(FBS)的DMEM-F12培养基(共100 μl)培养;对照组仅使用含10%FBS的DMEM-F12培养基(共100 μl)培养。KGN细胞的培养液和培养环境与对照组相同。
3.PRP的制备与激活:征集5名健康成人志愿者,每人采集肘前静脉全血17.5 ml均分至2支15 ml的离心管(每管含1.25 ml枸橼酸钠抗凝剂),轻轻摇晃混匀。室温300g离心20 min,小心吸取上层淡黄色部分及上下层连接处部分至新管,300g离心20 min后留取最底层1 ml液体,即PRP。参照之前文献[12]方法使用PBS将血小板浓度调整为1×109/ml,与10%的CaCl2、凝血酶按9∶1的体积比混匀,于37℃培养箱孵育4 h激活,室温下2 000g离心10 min,使用0.22 μm过滤器过滤、分装,冻存于-80℃冰箱备用。
4.CCK-8法测定细胞增殖:使用含有10%FBS的培养基将KGN细胞浓度调整至1×104/ml后均匀接种到96孔板中;PRP浓度梯度设置为0、1%、2%、5%及10%,DMEM-F12培养基中FBS浓度梯度设置为0、2%、5%及10%,每个浓度设置3个复孔,每孔100 μl,于37℃、5%CO2的培养箱中培养,监测0 h、24 h、48 h、72 h、96 h及120 h时的细胞增殖情况。调整人卵丘颗粒细胞浓度至1×104/ml后均匀接种到96孔板中;将PRP浓度梯度设置为0、1%,FBS浓度梯度设置为0、10%,每个浓度设置3个复孔,每孔100 μl,于37℃、5%CO2的培养箱中培养,监测0 h、24 h、48 h、72 h细胞增殖情况。测定时,每孔均加入10 μl CCK-8溶液,在37℃避光孵育2 h,使用酶联免疫检测仪检测450 nm波长处吸光度(OD)值,将仅添加培养液孔的OD值作为对照调零,结果取3孔OD平均值,并以培养时间为横轴,OD值为纵轴,绘制细胞生长曲线。
5.TUNEL法检测细胞凋亡:将分组、处理后的人卵丘颗粒细胞分别均匀涂片、标记、固定,按照TUNEL细胞凋亡检测试剂盒说明书处理细胞后于荧光显微镜下观察、拍照。每样本随机选取3张图像,计算TUNEL阳性细胞率(TUNEL染色阳性细胞数/DAPI染色细胞数)并进行统计学分析。
6.qRT-PCR检测人卵丘颗粒细胞中相关基因表达:使用微量样品RNA快速提取试剂盒提取样本RNA,使用逆转录试剂盒进行反转录。按照SYBR Green qPCR试剂盒说明书完成上样,使用Quant StudioTM5实时荧光定量PCR仪进行扩增,以GAPDH基因为内参,使用相对定量法检测Bax和Bcl-2基因的相对表达。实验数据使用软件自带分析工具或按照2-△△CT式进行统计学分析。
7.细胞免疫荧光染色:用胰酶消化细胞5 min,加入完全培养基终止消化,300g离心5 min,吸弃上清后PBS清洗2遍,加入适量多聚甲醛固定,涂片,PBS漂洗后,使用0.5% Triton X-100室温通透 20 min,PBS漂洗后烘干,滴加山羊血清室温封闭1 h,后于4℃湿盒过夜孵育一抗(1∶100)。PBS漂洗后,常温、避光环境下孵育荧光二抗(1∶400)1 h。复染色时使用DAPI或Hoechst避光染色10 min。PBS漂洗后封片,于荧光显微镜下观察、拍照。测定Bax、Bcl-2和Ki-67时每样本随机选取3张图像,使用Image J软件(NIH,美国)处理,计算平均荧光强度(该区域荧光强度总和/该区域面积),并进行统计学分析。
FSHR作为特异性表达于颗粒细胞胞质的蛋白,常被用作分子标志物以鉴定颗粒细胞[13]。本研究中颗粒细胞的鉴定即通过细胞免疫荧光法观察FSHR的表达。
8.E2浓度检测:备存的PRP组和对照组卵丘颗粒细胞的培养基上清液以300g离心5 min后吸取上清,于青岛妇女儿童医院检验科通过罗氏全自动发光仪检测E2浓度。
四、统计学分析
结 果
一、颗粒细胞的观察和鉴定
为确定所使用的细胞为颗粒细胞,本研究使用倒置显微镜对细胞进行形态学观察,镜下可见细胞呈梭形、椭圆形等,表面可见黑色的颗粒状物质,认为符合颗粒细胞的形态学特征,如图1A、B所示。
使用细胞免疫荧光法检测颗粒细胞FSHR的表达,荧光显微镜下可见人卵丘颗粒细胞胞质和KGN细胞胞质中有较强荧光,如图1C示,符合人颗粒细胞的分子特征。

A:KGN细胞不同时间的生长状态;B:人卵丘颗粒细胞不同时间的生长状态;C:使用细胞免疫荧光法检测颗粒细胞中FSHR的表达,可见人卵丘颗粒细胞胞质和KGN细胞胞质中有较强的红色荧光。图1 人颗粒细胞的生长状态及鉴定(×10)
二、不同浓度PRP的颗粒细胞生长情况
为探究体外培养时颗粒细胞生长的最适PRP和FBS浓度,使用CCK-8法检测KGN细胞在不同PRP、FBS浓度下的生长曲线。结果显示,适当浓度的PRP可促进细胞增殖(图2A、B、C、D)。无FBS时,不同浓度的PRP均可促进细胞增殖,其中10%PRP下KGN生长较好(图2A);在FBS为2%、5%及10%时,均为加入1%PRP的KGN生长趋势较好(图2B、C、D)。不同浓度的FBS和PRP相比,10%FBS+1%PRP的KGN生长最好(图2D)。随后我们使用CCK-8法对人卵丘颗粒细胞在不同PRP、FBS浓度下的增殖情况进行检测,结果大致相同(图2E、F)。因此选择10%FBS+1%PRP(即PRP组所用浓度)用于后续实验。
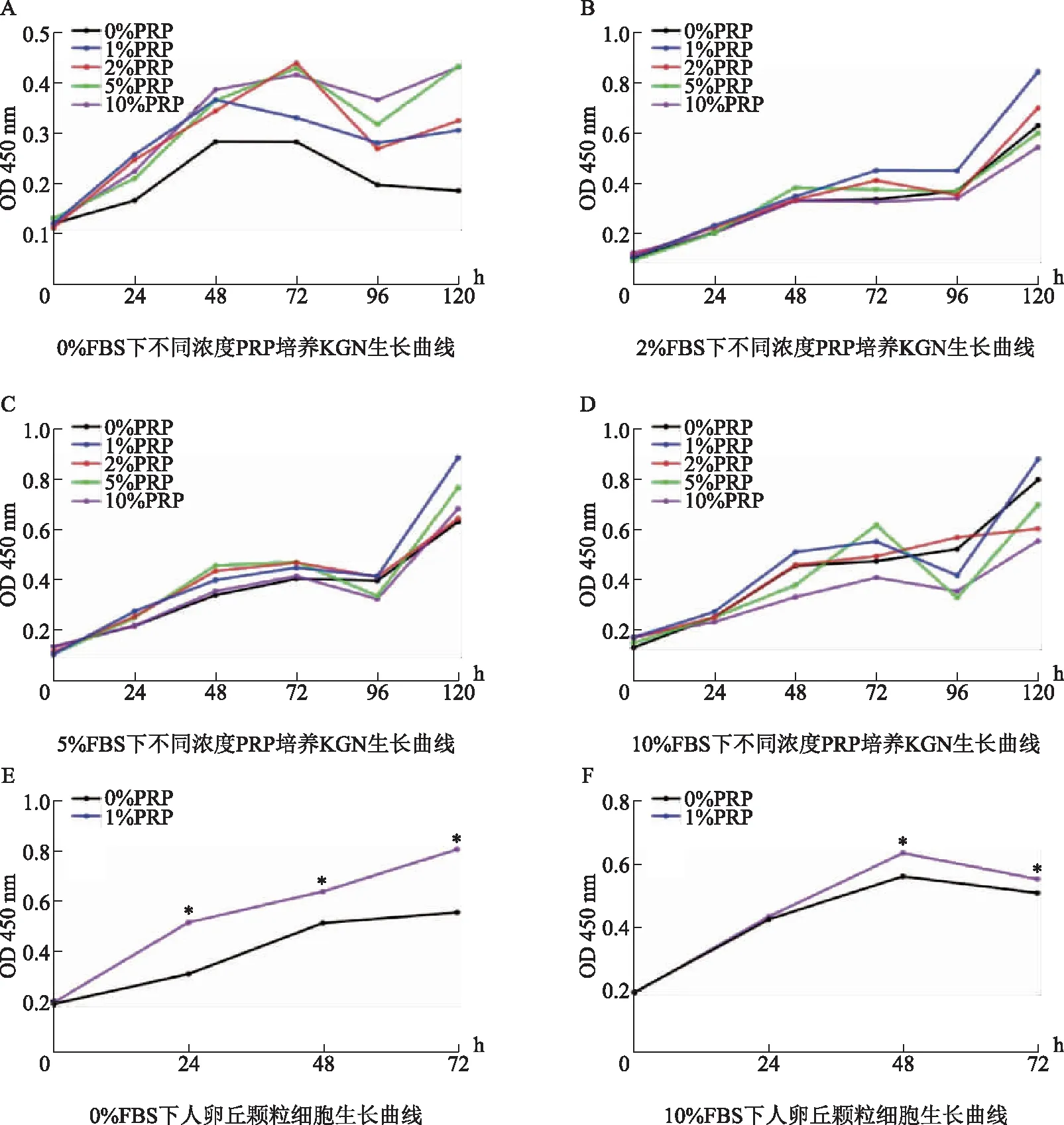
A:0%FBS时不同浓度的PRP培养KGN的生长曲线,加入PRP后均促进KGN增殖,10%PRP浓度时KGN生长趋势相对更好;B、C、D:2%、5%、10%FBS时不同浓度的PRP培养KGN的生长曲线,可见1%PRP浓度下KGN生长趋势较好;图E、F:0%和10%FBS时不同浓度PRP培养人卵丘颗粒细胞的生长曲线,加入1%PRP均促进人卵丘颗粒细胞增殖,48 h内10%FBS+1%PRP时细胞增殖趋势最好;与0%PRP比较,*P<0.05。图2 不同浓度的FBS和PRP下KGN细胞和人卵丘颗粒细胞的生长曲线图
三、PRP在体外培养中可抑制卵丘颗粒细胞凋亡、促进细胞增殖
为探究PRP对卵丘颗粒细胞凋亡的影响,使用TUNEL法检测30例DOR患者卵丘颗粒细胞24 h、48 h及72 h时的凋亡情况(每个时间段各10例)。结果显示,PRP组卵丘颗粒细胞凋亡率(TUNEL阳性细胞率)均显著低于对照组(P<0.001)(图3)。
使用qRT-PCR检测20例DOR患者卵丘颗粒细胞中凋亡相关基因的表达,结果显示,与对照组相比,PRP组的凋亡基因Bax表达显著降低,抗凋亡基因Bcl-2表达显著升高(P<0.01)(图4)。且30例DOR患者卵丘颗粒细胞的免疫荧光染色(用荧光强度表示蛋白相对表达量)也验证了这一结果,与对照组相比,PRP组中凋亡蛋白Bax表达量显著降低(P<0.001)(图5A),抗凋亡蛋白Bcl-2表达显著升高(P<0.001)(图5B)。PRP在体外培养中不仅抑制卵丘颗粒细胞的凋亡,还可以促进细胞增殖,除CCK-8法证实PRP可促进颗粒细胞增殖(图2)外,本研究还对32例DOR患者的卵丘颗粒细胞进行增殖因子Ki-67蛋白的免疫荧光染色,结果显示,PRP组Ki-67蛋白表达量显著高于对照组(P<0.001)(图5C),再次验证了PRP促进细胞增殖的作用。
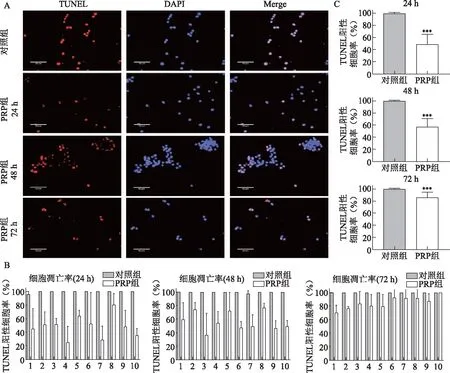
A:24 h、48 h、72 h细胞凋亡免疫荧光成像:TUNEL:TUNEL染色呈红色;DAPI:细胞核染色呈蓝色;Merge:合并图(凋亡细胞呈粉色);B:24 h、48 h、72 h对照组和PRP组的TUNEL阳性细胞率(每个时间段各10例);C:24 h、48 h、72 h对照组和PRP组细胞凋亡率比较(n=10):与对照组比较,***P<0.001。图3 TUNEL法检测DOR患者卵丘颗粒细胞凋亡

A:PRP组和对照组中凋亡基因Bax相对表达量(n=20),与对照组比较,***P<0.001;B:PRP组和对照组中抗凋亡基因Bcl-2相对表达量(n=20),与对照组比较,**P<0.01。图4 qRT-PCR检测DOR患者卵丘颗粒细胞凋亡相关基因
四、PRP在体外培养中可增强卵丘颗粒细胞的分泌功能
对30例DOR患者卵丘颗粒细胞培养基上清液中的E2浓度进行检测,结果显示:与对照组比较,PRP组E2浓度显著增高(P<0.001)(图6)。
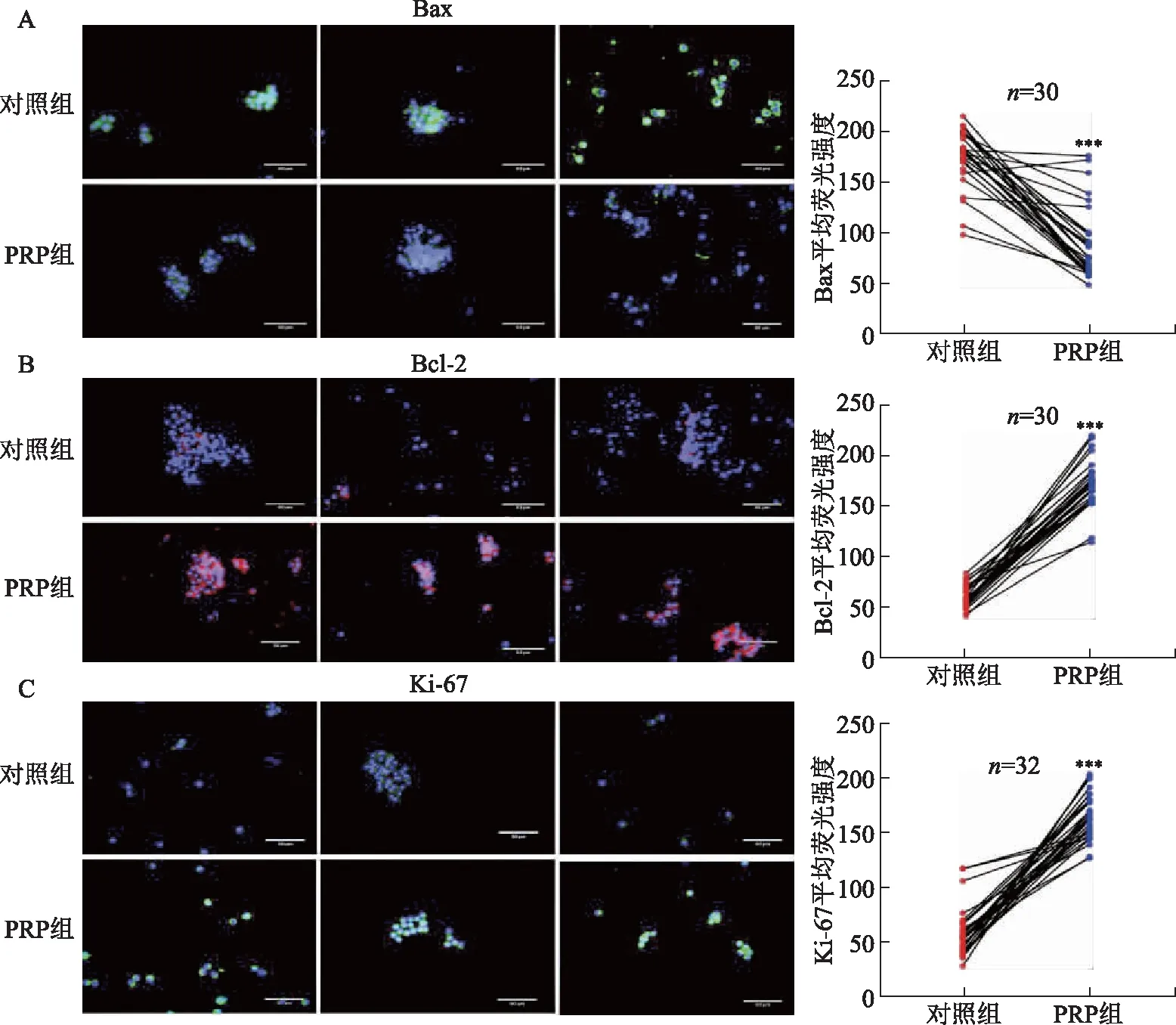
A:PRP组和对照组凋亡蛋白Bax的表达:左侧图中Bax免疫荧光染色为绿色,细胞核的DAPI染色为蓝色;与对照组比较,***P<0.001。B:PRP组和对照组抗凋亡蛋白Bcl-2的表达:左侧图中Bcl-2免疫荧光染色为粉色,细胞核的DAPI染色为蓝色;与对照组比较,***P<0.001。C:PRP组和对照组增殖因子Ki-67的表达:左侧图中Ki-67免疫荧光染色为绿色,细胞核的DAPI染色为蓝色;与对照组比较,***P<0.001。图5 免疫荧光染色法检测卵丘颗粒细胞中凋亡相关因子与增殖因子的表达

A:PRP组与对照组中E2浓度分布;B:PRP组与对照组中E2浓度比较:与对照组比较,***P<0.001。图6 罗氏全自动发光仪检测卵丘颗粒细胞培养基上清液中的E2浓度
讨 论
卵巢颗粒细胞包括壁层颗粒细胞和卵丘颗粒细胞,其中卵丘颗粒细胞与卵母细胞关系密切,紧紧围绕在卵母细胞周围[14],影响卵泡的增殖和凋亡[15]。卵丘颗粒细胞与卵母细胞共培养可促进卵母细胞成熟,提高体外受精治疗周期中的胚胎着床率和妊娠率[14,16-17]。因此卵丘颗粒细胞的功能与状态对卵母细胞的生长发育至关重要。
细胞凋亡是由基因控制的细胞自主的有序死亡,它涉及一系列基因的激活、表达以及调控等,参与卵泡发育的不同阶段[18]。DOR患者卵泡的质量和/或数量较正常人显著降低,既往研究发现DOR患者颗粒细胞的高凋亡是卵泡闭锁的主要原因[8],且对生育力有负面影响[9]。
PRP是外周血液离心后获得的含有高浓度血小板的血浆[5],激活血小板中的α颗粒会释放多种生物活性蛋白,包括血小板衍生生长因子(PDGF)、转化生长因子-β(TGF-β)、成纤维细胞生长因子(FGF)、表皮生长因子(EGF)、胰岛素样生长因子-1(IGF-1)和肝细胞生长因子(HGF)等[5,19],可刺激细胞的增殖、生长和分化[20]。近年来,PRP治疗作为一种新型的治疗方法,在其他临床领域已有较多应用。有研究证明存在于PRP中的骨形态发生蛋白(BMP)、血清生长分化因子(GDF)和激活素可调节多种卵巢功能[21]。例如,在卵泡发生的早期,激活素通过kit配体/c-Kit途径和smad2/smad3信号通路促进卵母细胞的存活和原始卵泡的形成[22];BMP7和BMP4可调节原始卵泡的募集,并促进原始卵泡向初级卵泡的转变[23];GDF-9对于初级阶段后的卵泡生长至关重要,可通过抑制颗粒细胞凋亡和卵泡闭锁来使卵泡存活[24]。已有一些动物实验证明,PRP激活后释放的生长因子在调节卵泡发育过程中起关键作用[25],将PRP直接注射到卵巢治疗后的小鼠在卵巢各个阶段的卵泡数量及质量都得到了提高[26],且小鼠卵巢皮质体积增加[27]。临床上一项前瞻性实验研究结果显示,在超声引导下经阴道在卵巢内注射PRP的DOR患者临床妊娠率和活产率更高[28],陈琪琦等[29]对卵巢早衰女性进行经阴道卵巢注射PRP后发现,患者血浆中E2水平较前增加,FSH水平较前降低。多个研究发现经阴道卵巢内注射PRP可以在一定程度上改善患者卵巢功能并成功获得生育[7,30-31]。因此,本研究通过体外培养DOR患者的卵丘颗粒细胞,给予不同浓度的PRP,探讨激活后的PRP对卵丘颗粒细胞凋亡和增殖的影响。因FBS广泛用于细胞培养,同时也可作为卵母细胞体外成熟卵泡液的替代品[32],因此本研究在颗粒细胞体外培养时常规给予了FBS。
本研究使用CCK-8法测定并验证了PRP可促进颗粒细胞增殖的功能,且最适浓度为1%,以该浓度用于后续实验。将DOR患者的卵丘颗粒细胞分为PRP组和对照组,使用Tunel染色后,发现PRP组患者卵丘颗粒细胞凋亡率显著低于对照组(P<0.001);qRT-PCR检测发现,PRP组中凋亡基因Bax表达显著低于对照组,抗凋亡基因Bcl-2的表达显著高于对照组(P<0.001);使用细胞免疫荧光染色检测两组中Bax和Bcl-2的蛋白表达得到了一致的结果,同时增殖因子Ki-67蛋白表达量较对照组显著升高(P<0.001);经罗氏全自动发光仪检测发现,PRP组卵丘颗粒细胞培养基上清液中的E2浓度显著高于对照组(P<0.001)。上述结果均提示体外细胞实验中,激活的PRP可抑制DOR患者卵丘颗粒细胞凋亡,促进其增殖,同时增强其分泌功能,使E2水平升高。但本研究尚存在一定的局限性和不足,本研究仅在细胞、RNA、蛋白质层面对PRP的有效性进行了探究,未行动物实验和机制的探索,后续需进一步的研究和探讨。
综上所述,体外培养人卵丘颗粒细胞时,给予激活的PRP能有效抑制细胞凋亡、促进其增殖,同时增强其分泌功能;这为PRP治疗DOR患者的临床应用提供了一定的理论依据。

