卵丘颗粒细胞mtDNA拷贝数及4977 bp缺失在卵巢储备功能减退中的研究
王雪莹,安卓,姚冠峰,郭晓丽,王树松,谢聪聪*
(1.河北省生殖健康科学技术研究院 河北省生殖医院 国家卫生健康委员会计划生育与优生重点实验室/河北省生殖医学重点实验室,石家庄 050071;2.河北医科大学研究生院,石家庄 050017)
卵巢储备功能减退(DOR)是指卵巢内可募集卵泡数量减少,常伴有卵母细胞质量下降,是女性生育能力下降的主要原因[1-2]。卵丘颗粒细胞是与卵母细胞直接接触的唯一体细胞,两者之间存在广泛细胞间的连接,在卵母细胞发育、成熟和代谢过程中发挥着至关重要的作用,是评估卵母细胞或胚胎质量的最佳非侵入性方法[3]。
线粒体是颗粒细胞中含量丰富的细胞器之一,为细胞的正常发育提供ATP,并且可以调节颗粒细胞的代谢、细胞周期和信号转导。线粒体DNA(mtDNA)的拷贝数及完整性会影响颗粒细胞的功能和卵母细胞的发育[4],如mtDNA 4977 bp缺失会通过干扰氧化磷酸化过程造成线粒体能量代谢障碍[5]。此外,孔令红等[6]研究发现自体颗粒细胞线粒体移植到发育潜能低下的卵母细胞中,可以改善卵母细胞质量和胚胎发育潜能。因此,检测卵丘颗粒细胞的mtDNA拷贝数及4977 bp片段缺失率不仅对评估DOR患者卵母细胞质量有参考意义,也可能对线粒体自体移植有更多的指导作用。
资料与方法
一、研究对象及分组
本研究经河北省生殖医院伦理委员会批准,患者知情同意并签署《河北省生殖医院生殖医学中心科研捐赠知情同意书》。选取2019年4月至2020年10月在河北省生殖医院行IVF/ICSI-ET治疗的不孕症患者33例,ICSI患者指征排除男方少弱畸精子症。根据卵巢储备功能情况分为DOR组和卵巢储备功能正常(NOR)组,其中DOR组17例,NOR组16例。
DOR患者的纳入标准[7]:抗苗勒管激素(AMH)<1.1 ng/ml;双侧基础窦卵泡计数(AFC)≤5~7枚;年龄30~45岁,体质量指数(BMI)19~30 kg/m2。排除标准:感染、免疫、手术等导致DOR者;染色体异常者;患性传播疾病者。
NOR患者的纳入标准:月经周期规律(25~35 d);基础激素水平正常:卵泡刺激素(FSH)<8 U/L,黄体生成素(LH)<6 U/L,73.4 pmol/L<雌二醇(E2)<183.5 pmol/L;3枚<每侧AFC<10枚;单纯输卵管因素、男方因素者,选择供精者;年龄25~40岁,BMI 19~30 kg/m2。排除标准:染色体异常者;排卵障碍(多囊卵巢综合征等)者;子宫内膜异位症者;卵巢囊肿、卵巢肿瘤者;患性传播疾病者。
二、主要仪器及试剂
实时定量PCR扩增仪(ABI 7500 Fast,Life,美国),线粒体分离试剂盒(北京Invent),2×SYBR qPCR Mix(北京庄盟生物),通用基因组DNA小量提取试剂盒(北京天漠生物)。
三、研究方法
1.促排卵方案:根据卵巢储备功能及血清激素水平选择采用高孕激素状态下促排卵(PPOS)方案或拮抗剂方案。结合B超监测卵泡发育情况,当1~2个卵泡直径≥18 mm或者3个及以上卵泡直径≥17 mm时,进行扳机,扳机后36 h行阴道超声引导下取卵术。拮抗剂方案自取卵日开始进行黄体支持。
2.胚胎发育:常规上游法或密度梯度离心法处理精液,根据精液情况选择受精方式;IVF受精5 h后拆除卵母细胞周围的颗粒细胞,置于G1TMPLUS培养液(Vitrolife,瑞典)中放入Timelapse延时摄像培养箱(Vitrolife,瑞典)中观察卵母细胞成熟度及第二极体的排出情况。若受精方式为 ICSI,取卵后2 h将卵丘复合物放入7%透明质酸酶(Vitrolife,瑞典)中吹打剥除颗粒细胞,对所有处于第二次减数分裂中期(MⅡ)的卵母细胞行ICSI。受精后18~20 h观察原核(PN),出现2PN且两个极体为正常受精。受精后第3天根据卵裂球均匀度、碎片比例、卵裂过程中异常发育现象和各个卵裂时期的分裂时间点等进行胚胎质量评估[8]。Ⅰ级和Ⅱ级为优质胚胎;Ⅰ~Ⅲ级为可利用胚胎。
3.观察指标:BMI,平均获卵数;胚胎质量指标:受精率(受精率=受精数/MⅡ数×100%)、卵裂率(卵裂率=卵裂数/受精数×100%)、优质胚胎率(优质胚胎率=优质胚胎数/受精数×100%)、可利用胚胎率(可利用胚胎率=可利用胚胎数/受精数×100%);临床妊娠指标:临床妊娠率(临床妊娠率=临床妊娠周期数/总移植周期数×100%)、种植率(种植率=种植胚胎数/移植胚胎数×100%)。
4.卵丘颗粒细胞收集:在阴道超声探头引导下,通过阴道穿刺抽吸卵泡,将卵泡液倒入组织培养皿中,在解剖显微镜下挑选卵丘复合物后,将颗粒细胞转移到G-MOPSTMPLUS培养液中。机械法小心剥离卵母细胞周围的卵丘颗粒细胞。
5.卵丘颗粒细胞计数:加入7%透明质酸酶消化卵丘颗粒细胞,用巴氏德吸管反复吹打卵丘颗粒细胞(时间≤1 min),置于显微镜下观察,如果卵丘颗粒细胞分散均匀,没有成团的细胞,加入G-MOPSTMPLUS培养液,终止消化,室温下400g离心5 min,弃上清,重复2次,加入1 ml G-MOPSTMPLUS培养液制成单细胞悬液。吸取上述单细胞悬液10 μl,采用细胞计数板于光学显微镜下计数,细胞密度(个/ml)=(细胞计数板四角4个大方格细胞总数/4)×104。
6.mtDNA的提取:根据MinuteTM线粒体分离试剂盒说明书提取线粒体;提取出来的线粒体根据通用基因组DNA小量提取试剂盒说明书提取mtDNA。
7.mtDNA拷贝数序列引物设计与合成:NADH脱氢酶亚基1(ND1)片段是mtDNA高度保守序列,可以反映DNA模板中mtDNA的总量,扩增片段长度为110 bp;β-微球蛋白引物扩增片段长度为88 bp。ND1上游引物序列为5′-GTCAACCTCGCTTCCCCACCCT-3′,结合位点为6527.4,Tm为66.48℃,下游引物序列为5′-TCCTGCGAATAGGCTTCCGGCT-3′,结合位点为6702.4,Tm为66.06℃;β-微球蛋白上游引物序列为5′-TGCTGTCTCCATGTTTGATGTATCT-3′,结合位点为7629,Tm为60.34℃,下游引物序列为5′-TCTCTGCTCCCCACCTCTAAGT-3′,结合位点为6557.4,Tm为61.98℃。
8.mtDNA 4977 bp缺失的检测引物设计与合成:mtDNA 4977 bp缺失位于基因组8 469~13 447 bp,上游引物1序列为5′-CCCTTCGCTGACGCCATA-3′,结合位点为5395.6,Tm为59.50℃,下游引物1序列为5′-AGTAGAAGAGCGATGGTGAGAGC-3′,结合位点为7226.6,Tm为61.80℃;上游引物2序列为5′-CACCATAATTACCCCCATACTCCTTA-3′,结合位点为7754.2,Tm为59.73℃,下游引物2序列为5′-CACCATAATTACCCCCATACTCCTTA-3′,结合位点为7416.8,Tm为59.73℃。
9. 实时定量PCR反应体系:模板2 μl,2×SYBR qPCR Mix 10 μl,50×Dye ROX 0.1 μl,上游引物和下游引物各0.2 μl,加ddH2O至20 μl。PCR反应条件:94℃预变性3 min,94℃变性15 s,60℃退火30 s,72℃延伸30 s,共40个循环周期,72℃孵育5~10 min。阴性对照以 ddH2O代替待测模板,每例样品及阴性对照均设3个平行复孔,取平均值。
10. 琼脂糖凝胶电泳:1×TAE溶液(Thermo,美国)配制0.75%的琼脂糖凝胶(Vivantis,美国);取4 μl的PCR扩增产物与1 μl的6×Loading buffer(北京普利莱)混匀,加入上样孔;电泳150 V恒压35 min;观察紫外分析仪(Acuronbio,美国)下的目的条带。
四、统计学分析
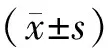
结 果
一、两组患者一般情况比较
两组患者的BMI、不孕年限、基础FSH(bFSH)、bE2和bLH无统计学差异(P>0.05);DOR组的女方年龄显著高于NOR组(P<0.05),DOR组AFC显著低于NOR组(P<0.05)(表1)。
二、两组患者实验室参数及妊娠结局比较
两组患者卵裂率、优质胚胎率、可利用胚胎率、临床妊娠率、种植率均无统计学差异(P>0.05);DOR组促性腺激素(Gn)天数、Gn用量、平均获卵数和受精率显著低于NOR组(P<0.05)(表2)。
表1 两组患者一般情况比较(-±s)
表2 两组患者实验室参数及妊娠结局比较[(-±s),%]
三、两组患者颗粒细胞mtDNA拷贝数PCR反应的熔解曲线
β-微球蛋白和ND1的熔解曲线见图1,熔解曲线显示,β-微球蛋白PCR扩增产物Tm为82.17℃,ND1 PCR扩增产物Tm为82.18℃,熔解温度均一,峰的形状锐利,无杂峰,提示PCR产物单一,无副产物。
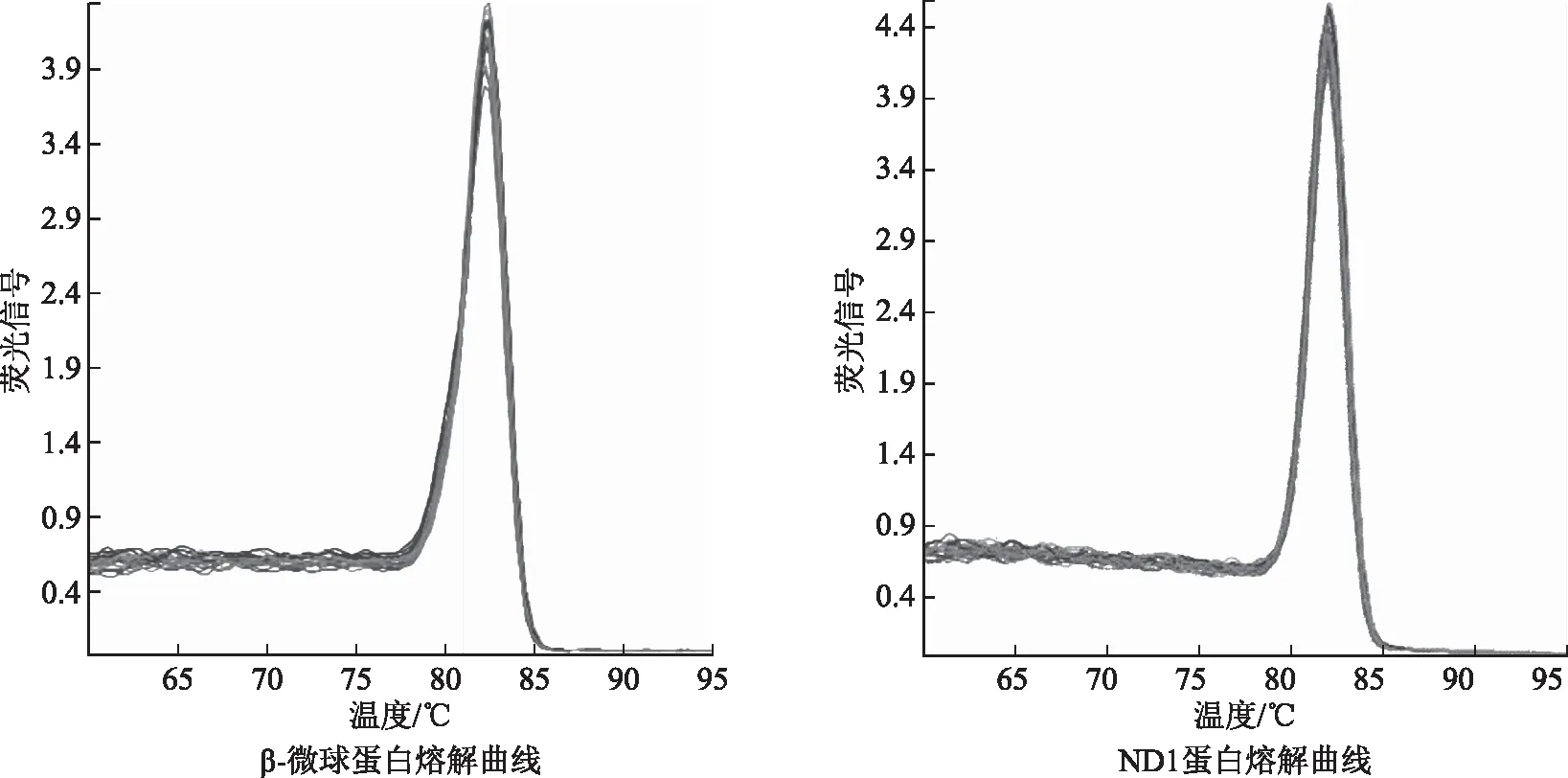
图1 β-微球蛋白和ND1蛋白的PCR熔解曲线
四、两组的mtDNA拷贝数比较
mtDNA拷贝数与细胞内线粒体的数量相关,mtDNA拷贝数已成为一种可靠的、无创的线粒体平均数目计算方法。ND1片段是mtDNA高度保守序列,可以反映DNA模板中mtDNA的总量。通过计数颗粒细胞的数量,对两组的颗粒细胞mtDNA拷贝数做了相对于1×104颗粒细胞的定量。
卵丘颗粒细胞采用MinuteTM线粒体分离试剂盒提取线粒体然后提取mtDNA。通过实时荧光定量PCR仪自带软件计算出CT值,采用2-△△CT的计算法,分别算出DOR组和NOR组颗粒细胞mtDNA拷贝数相对于1×104颗粒细胞的定量。β-微球蛋白和ND1蛋白的扩增曲线见图2。统计两组患者卵丘颗粒细胞mtDNA拷贝数后结果显示,DOR组mtDNA拷贝数(1.04±0.48)略低于NOR组的mtDNA拷贝数(1.13±0.52),但两者尚无显著性差异(P>0.05)(图3)。
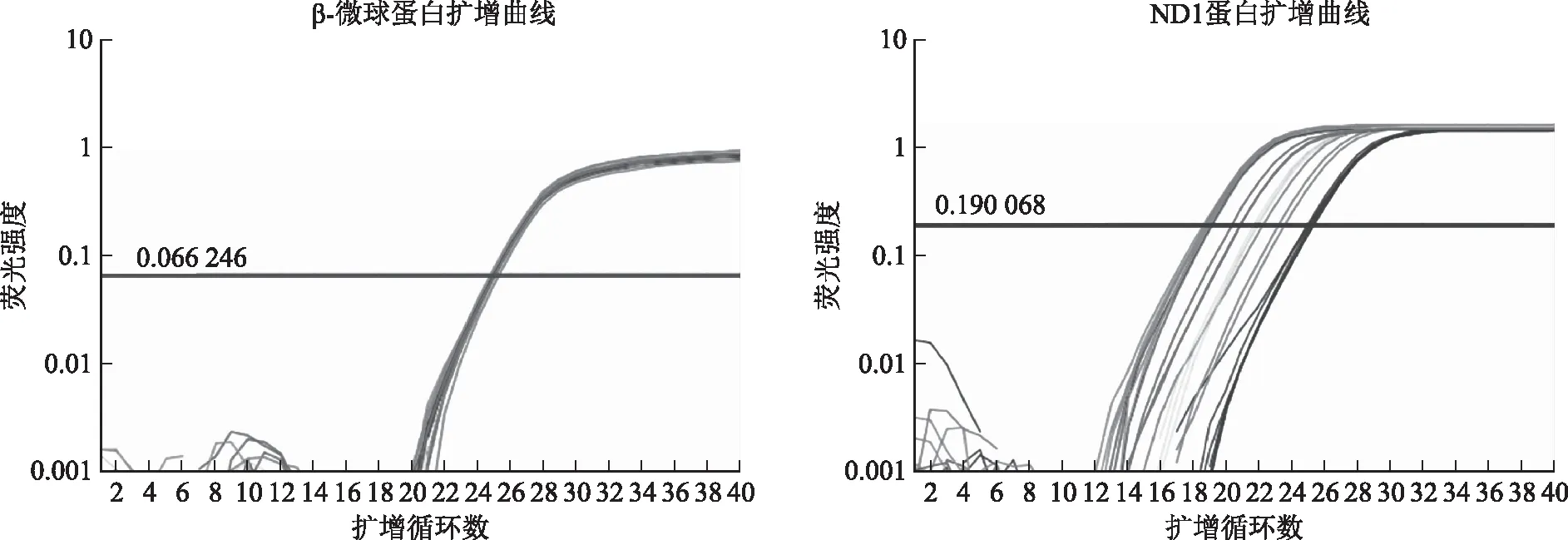
图2 β-微球蛋白和ND1蛋白的扩增曲线图
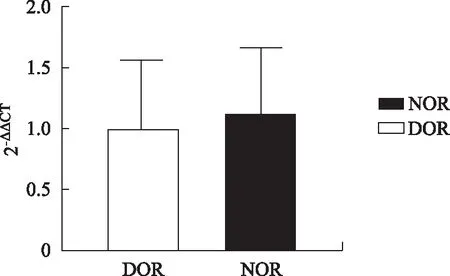
图3 两组mtDNA拷贝数相对定量比较
五、两组患者卵丘颗粒细胞mtDNA 4977 bp缺失情况比较
实时定量PCR检测颗粒细胞mtDNA 4977 bp缺失情况。mtDNA 4977 bp缺失引物1位于缺失片段内部,对于正常mtDNA,可扩增60 bp片段;而对于片段缺失的mtDNA,无法扩增。引物2位于缺失片段的外侧,对于发生4977 bp缺失的mtDNA,其可扩增出173 bp片段;而对于正常mtDNA而言,由于上游引物2和下游引物2间隔距离太远,在这个扩增条件下没有扩增产物,表现出阴性结果。PCR反应扩增产物行琼脂糖电泳检测,DOR组和NOR组的卵丘颗粒细胞mtDNA均未检测到4977 bp缺失(图4)。
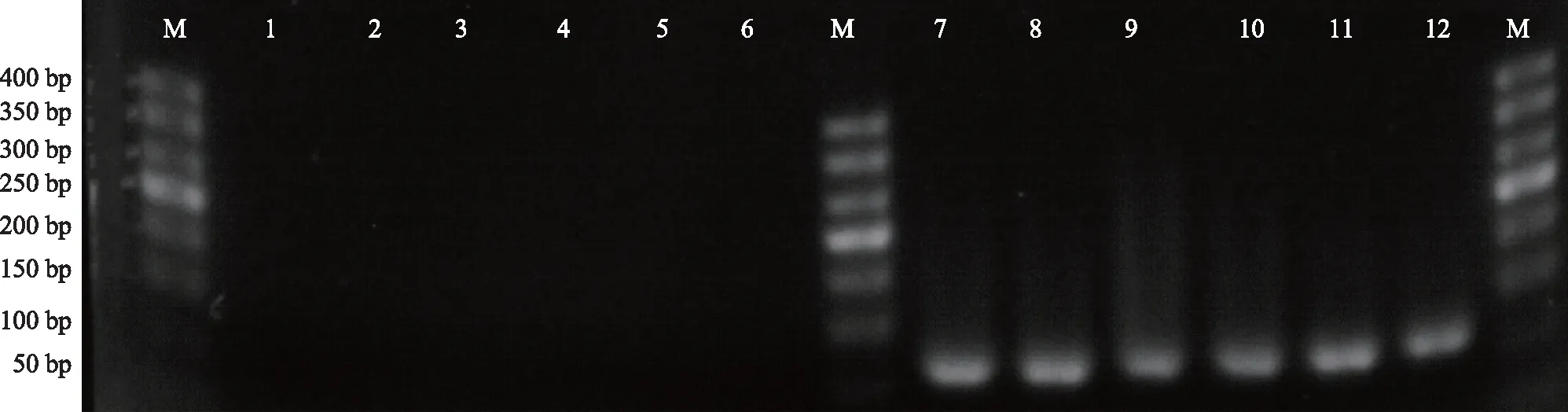
M:DNA marker;泳道1~3及7~9为DOR组,泳道4~6及10~12为NOR组;泳道1~6为mtDNA 4977 bp缺失引物2扩增情况,泳道7~12为引物1扩增情况。图4 实时定量PCR检测颗粒细胞mtDNA 4977 bp缺失电泳图
讨 论
在卵母细胞发育成熟的过程中,胞质内线粒体和mtDNA经历阶段性的空间再分布,调节ATP生成,从而迅速、有效地为细胞“定点”提供能量[9]。mtDNA拷贝数变化情况与卵母细胞成熟所需能量变化情况一致[10-11]。mtDNA拷贝数及完整性是决定卵母细胞形态和功能是否正常的关键因素,是卵母细胞质量的重要标志。其中4977 bp片段缺失是最常见的mtDNA突变类型,如果颗粒细胞内存在4977 bp缺失,则不能编码合成细胞色素氧化酶,导致ATP合成减少,膜电位丧失,从而产生大量的活性氧,活化凋亡信号,引起卵母细胞的凋亡[12-13]。
本研究数据表明DOR组Gn天数及用量显著低于NOR组,获卵数及受精率亦显著低于NOR组(P<0.05),妊娠率及种植率仅略低于NOR组,优质胚胎率及可利用胚胎率与NOR组无显著性差异(P>0.05)。出现这种情况的原因可能是虽然DOR患者卵母细胞对Gn反应下降,但此类患者AFC较少,所以Gn天数及用量均降低。由于卵母细胞对Gn反应下降导致成熟卵母细胞数量减少,从而获卵数较少。DOR患者卵母细胞质量下降,影响其受精及后期胚胎发育潜能。在本研究中,DOR组受精率下降,但优质胚胎率及可利用胚胎率与NOR组相比无显著差异,可能是因为优质胚胎率及可利用胚胎率的计算公式中分母为受精数,DOR组受精数少,所以相对胚胎质量无明显差异。临床妊娠率及种植率略低于NOR组,但尚无显著性差异,可能是因为DOR组移植的总周期数太少,存在偶然性因素。此结果与赵红翠等[14]的研究结论一致。
本研究还发现DOR组和NOR组的mtDNA拷贝数无显著性差异(P>0.05),且均不存在4977 bp片段缺失。出现这种情况的原因可能是:(1)颗粒细胞是不稳定细胞,不断分裂模式以取代功能受到破坏的细胞,从而维持mtDNA正常拷贝数。(2)排卵前颗粒细胞内线粒体急剧增加,如果某些mtDNA发生突变或缺失时,其它mtDNA分子可以弥补由此造成的功能异常。(3)本次实验样本量少,未能收集到更多样本,研究结论存在偶然性。本研究结果和之前文献[15-17]报道的结果一致。本研究中,DOR患者的颗粒细胞中均未检测到4977 bp片段缺失,说明本研究中DOR组的DNA结构是基本完整的,该类患者的临床结局可能与线粒体DNA结构无关。线粒体是半自主细胞器,受细胞核基因组与线粒体基因组的共同调控。由于mtDNA没有组蛋白和染色体结构的保护而极易损伤,mtDNA突变率远远高于核DNA突变率[16]。目前为止,线粒体DNA中有超过300个核基因的突变已经被证明是导致线粒体疾病的重要因素,其中许多在卵巢功能不全、卵巢早衰、DOR中起着重要作用[18-21]。
本研究也有自己的特色:第一,之前研究颗粒细胞mtDNA拷贝数和mtDNA 4977 bp缺失都是直接提取颗粒细胞的mtDNA,而本研究是先提取颗粒细胞有活性的线粒体,然后再提取mtDNA。这样操作后mtDNA没有掺杂颗粒细胞的基因组DNA,因此提取的mtDNA更纯。第二,本研究对颗粒细胞进行了计数,对两组的颗粒细胞mtDNA拷贝数做了相对于1×104颗粒细胞的定量。但样本量较小也是本研究的一个局限性,后续需要继续进行数据追踪加以深入探讨。
综上,本研究中DOR患者的线粒体4977 bp片段未发现缺失,mtDNA拷贝数也未见减少。本研究结果为DOR患者的自体颗粒细胞线粒体移植的实现提供了进一步的理论依据。

