环孢素注射液联合甲泼尼龙治疗特发性肺间质纤维化的倾向性评分匹配研究
申霖,焦鹏,胡密
(1.商丘市第一人民医院 急诊内科,河南 商丘 476000;2.商丘市第三人民医院 神经内科,河南 商丘 476000)
特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)为下呼吸道的弥漫性炎症性疾病,可侵犯肺泡壁及邻近的肺泡腔,引起肺纤维化,引发进行性呼吸困难、低热、关节疼痛等症状;当疾病进入急性加重期时,还可导致急性呼吸衰竭、静脉血栓栓塞症等严重并发症,威胁患者生命安全,需及时实施有效治疗措施[1-2]。但目前临床对于IPF致病原因尚不清楚,临床无针对IPF的特效治疗方法,常通过糖皮质激素冲击疗法治疗急性加重期患者。甲泼尼龙是临床常用的糖皮质激素,具有较强的抗炎作用,可延缓疾病恶化,改善患者临床症状[3]。但单纯长期使用甲泼尼龙治疗患者可能会出现全身性变态反应及消化性溃疡、痤疮、下肢肿胀等不良反应,不利于患者身体恢复。因此,临床需寻找其他药物联合治疗IPF,以便在最短时间内缓解患者病情,促进疾病转归。环孢素注射液作为一种免疫抑制剂,可调节机体T淋巴细胞功能,增强机体对炎症的抑制作用,缓解患者临床症状[4]。结合上述,考虑将环孢素注射液与甲泼尼龙联合应用于IPF治疗中,可提高治疗效果,促进疾病转归。基于此,本研究采用倾向性评分匹配(propensity score matching,PSM)方法研究分析环孢素注射液联合甲泼尼龙治疗IPF的效果,现报告如下。
1 资料与方法
1.1 一般资料回顾性分析,收集2017年1月至2021年9月于商丘市第一人民医院接受治疗的107例IPF患者临床资料,将单独接受甲泼尼龙治疗的58例患者的临床资料纳入对照组,将接受环孢素注射液联合甲泼尼龙治疗的49例患者的临床资料纳入观察组。病例资料按照以下标准筛选纳入。(1)纳入标准:①IPF符合《特发性肺纤维化诊断和治疗中国专家共识》[5]中相关规定,且经胸部高分辨率CT、外科肺组织活检等确诊;②急性加重期;③可耐受本研究治疗药物;④病历资料完整。(2)排除标准:①药物性肺损伤、石棉沉着病、慢性过敏性肺炎等其他间质性肺疾病;②合并全身真菌感染;③入院前1个月内接受过糖皮质激素或免疫抑制剂治疗;④依从性较差,无法严格遵照医嘱用药;⑤治疗中途转院;⑥治疗期间病死。采用PSM对两组患者按照最近邻匹配法进行1∶1匹配,匹配变量包括性别、年龄、吸烟史、病程。通过PSM,两组各43例患者纳入研究。
1.2 治疗方法
1.2.1常规治疗 两组患者入院后均接受常规治疗,经鼻导管高浓度吸氧,保持动脉血氧饱和度在90%以上,必要时选择面罩或无创呼吸机进行纯氧供给。对于合并呼吸衰竭者进行机械通气,对于合并感染者使用抗生素进行抗感染治疗。采用弹力袜、双下肢气压泵及低分子肝素等手段预防静脉血栓栓塞,并给予患者相应营养支持。
1.2.2对照组 在常规治疗基础上静脉滴注注射用甲泼尼龙琥珀酸钠(福安药业集团湖北人民制药有限公司,国药准字H20183041),1 000 mg·d-1,连用3 d后以500 mg·kg-1·d-1剂量维持,然后根据患者病情变化情况每2周减量5 mg·d-1,连续治疗3个月。
1.2.3观察组 在对照组基础上加用环孢素注射液(北京双鹭药业股份有限公司,国药准字H20054367)治疗,将3 mg·kg-1的环孢素注射液与生理盐水按1∶20比例稀释后静脉滴注,每日1次,持续2周。然后改为口服环孢素口服溶液(杭州中美华东制药有限公司,国药准字H10930130),初始剂量12 mg·kg-1,分2次口服,并根据患者病情变化情况每2周减量0.5 mg·kg-1·d-1,维持剂量5 mg·kg-1,分2次口服。连续治疗3个月。
1.3 评价指标(1)炎症指标。检测方法:患者治疗前、治疗3个月时,采集空腹外周肘静脉血3 mL,以3 000 r·min-1速率离心10 min,离心半径10 cm,取上清液,采用酶联免疫吸附试验测定白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-8(interleukin-8,IL-8)水平,试剂盒选自上海科顺生物科技有限公司。(2)免疫功能指标。检测方法:患者治疗前、治疗3个月时,采集空腹外周肘静脉血3 mL,采用流式细胞仪(上海厦泰生物科技有限公司,沪械注准20192220391,型号:NL-CLC B14 R8)测定T淋巴细胞中的CD3+、CD4+值。(3)肺功能指标。检测方法:患者治疗前、治疗3个月时,采用肺功能仪(广州畅呼医疗器械有限公司,粤械注准20212070018,型号:PUS201P)测定用力肺活量(forced vital capacity,FVC)、第1秒用力呼吸容积(forced expiratory volume in the first second,FEV1)、肺总量(total lung capacity,TLC),患者均处于安静状态下10 min后取坐位进行测定,每个指标测定3次后取最佳值作为最终结果。(4)不良反应,包括头痛、纳差、恶心及情绪不稳定。
1.4 统计学方法采用SPSS 25.0统计软件处理数据。对患者基线资料按照1∶1的比例进行PSM,卡钳值设置为0.01;全部计量资料均经Shapiro-Wilk正态性检验,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较用独立样本t检验,组内比较用配对样本t检验;计数资料用例数和百分数(%)表示,组间比较采用χ2检验或Fisher确切概率法。检验水准α=0.05。
2 结果
2.1 PSM 法配比结果PSM前,两组患者性别、年龄对比,差异有统计学意义(P<0.05);两组吸烟史、IPF病程、入院时白细胞计数、合并糖尿病对比,差异无统计学意义(P>0.05)。见表1。PSM后,两组各43例患者纳入研究,组间所有基线资料比较,差异无统计学意义(P>0.05)。见表2。

表1 PSM法配比前两组患者基线资料比较
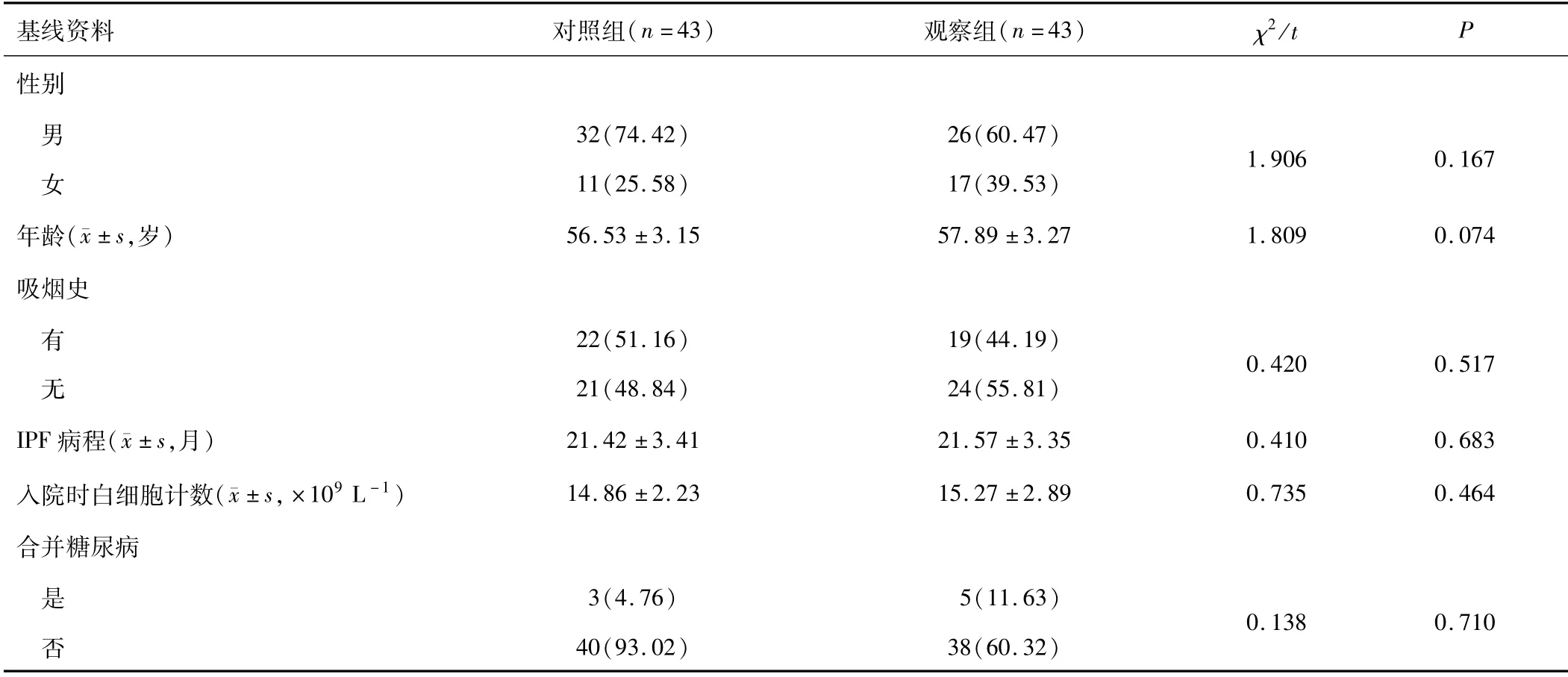
表2 PSM法配比后两组患者基线资料比较
2.2 炎症指标水平治疗前,两组血清IL-1β、TNF-α、IL-8水平对比,差异无统计学意义(P>0.05);治疗3个月时,两组血清IL-1β、TNF-α、IL-8水平均降低,且观察组较对照组低,差异有统计学意义(P<0.05)。见表3。
表3 两组炎症指标水平比较(±s)

表3 两组炎症指标水平比较(±s)
注:与同组治疗前比较,a P<0.05;IL-1β为白细胞介素-1β;TNF-α为肿瘤坏死因子-α;IL-8为白细胞介素-8。
组别 例数 IL-1β/(ng·L-1)TNF-α/(μg·L-1)IL-8/(μg·L-1)个月时对照组 43 54.78±3.41 47.36±3.02a 20.57±3.23 15.42±2.16a 33.56±3.24 24.41±2.23治疗前 治疗3个月时治疗前 治疗3个月时治疗前 治疗3 a观察组 43 55.62±3.36 43.23±3.15a 20.23±3.18 12.26±1.85a 33.29±3.58 21.28±2.16a t 1.136 8.076 0.478 7.288 0.273 6.279 P 0.259 <0.001 0.634 <0.001 0.785 <0.001
2.3 免疫功能治疗前,两组CD3+、CD4+水平对比,差异无统计学意义(P>0.05);治疗3个月,两组CD3+、CD4+水平均升高,且观察组较对照组高,差异有统计学意义(P<0.05)。见表4。
表4 两组免疫功能比较(±s,%)

表4 两组免疫功能比较(±s,%)
注:与同组治疗前比较,a P<0.05。
+组别 例数 CD3+CD4个月时对照组 43 53.98±3.25 60.85±3.66a 30.25±2.23 35.07±2.25治疗前 治疗3个月时治疗前 治疗3 a观察组 43 54.27±3.31 63.23±3.74a 30.32±2.18 37.49±2.30a t 0.423 2.986 0.127 4.952 P 0.673 0.004 0.900 <0.001
2.4 肺功能治疗前,两组FVC、FEV1、TLC水平对比,差异无统计学意义(P>0.05);治疗3个月时,两组FVC、FEV1、TLC水平均较治疗前升高,且观察组较对照组高,差异有统计学意义(P<0.05)。见表5。
表5 两组肺功能比较(±s,L)
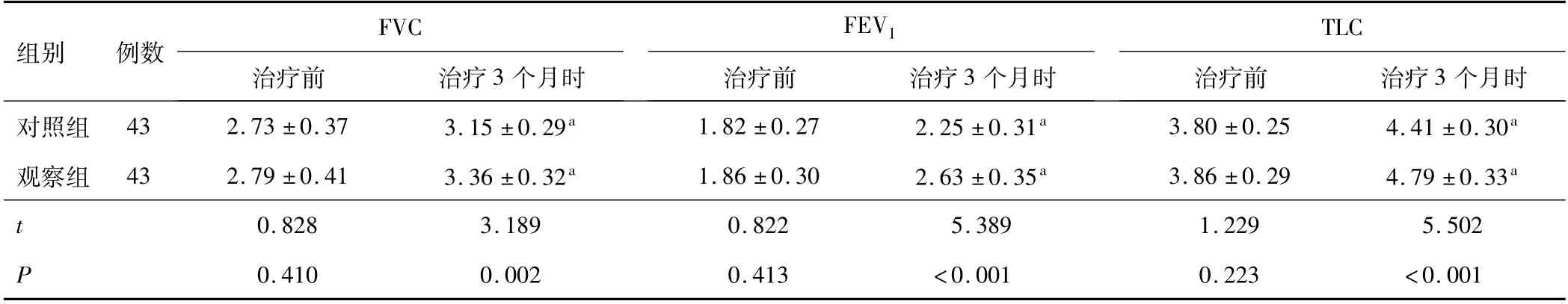
表5 两组肺功能比较(±s,L)
注:与同组治疗前比较,a P<0.05;FVC为用力肺活量;FEV1为第一秒用力呼吸容积;TLC为肺总量。
组别 例数FVC治疗前 治疗3个月时FEV 1个月时对照组 43 2.73±0.37 3.15±0.29a 1.82±0.27 2.25±0.31a 3.80±0.25 4.41±0.30治疗前 治疗3个月时TLC治疗前 治疗3 a观察组 43 2.79±0.41 3.36±0.32a 1.86±0.30 2.63±0.35a 3.86±0.29 4.79±0.33a t 0.828 3.189 0.822 5.389 1.229 5.502 P 0.410 0.002 0.413 <0.001 0.223 <0.001
2.5 不良反应治疗期间,两组不良反应发生率对比,差异无统计学意义(P>0.05)。见表6。

表6 两组不良反应对比[n(%)]
3 讨论
IPF急性加重期患者病情危重,病情进展迅速,若未得到及时、有效治疗,可增加患者病死风险[6]。目前,肺移植可能是唯一可以治愈IPF、延长患者生存期的有效方法,但IPF急性加重期患者病情变化较快,治疗时间有限,加上肺源限制及高昂的治疗费用,紧急肺移植往往不可行[7]。因此,临床多采用药物治疗、缓解患者病情,减轻其痛苦,延长自然病程。
国内与国外关于IPF相关治疗指南推荐可酌情使用糖皮质激素与免疫抑制剂治疗急性加重期患者[5,8]。甲泼尼龙为中效类激素,可结合细胞质中的热体克蛋白形成同源二聚体,共同进入细胞核后可特异性结合靶基因启动因子区域的糖皮质激素反应原件,促进靶基因转录,促进脂皮素的合成与分泌,从而降低磷脂酶A2活性,抑制白三烯、前列腺素等细胞因子的合成与分泌;且其还可通过抑制炎症蛋白转录与翻译的方式阻碍炎症蛋白质的产生,从而减轻机体炎症反应程度,缓解患者病情[8]。环孢素注射液是一种低毒高效的免疫抑制剂,能通过干扰T淋巴细胞识别抗原提呈细胞表面的膜分子人白细胞抗原DR受体的方式特异性抑制T淋巴细胞的活性,从而抑制炎症因子的合成与分泌,降低机体炎症反应程度[9]。本研究结果显示,环孢素注射液联合甲泼尼龙治疗可减轻IPF患者炎症反应。分析原因可能为,甲泼尼龙可与核转录因子κB的活性部位P65亚基相结合,阻断核转录因子κB与脱氧核糖核酸上靶位点的结合,并能上调核转录因子κB抑制蛋白的表达,使活化的核转录因子κB转变为非活性形式,从而抑制其介导的IL-8、TNF-α等炎症因子基因的转录,进而降低机体炎症指标水平,缓解炎症反应[10]。此外,甲泼尼龙还能阻碍单核细胞及炎症细胞等向炎症部位的聚集,并抑制单核细胞的吞噬功能,从而减轻肺组织炎症损伤程度[11]。环孢素注射液可通过抑制钙离子依赖的抗原抗体介导的信息传导的方式阻断T细胞的激活,抑制T淋巴细胞分泌干扰素,并能抑制单核巨噬细胞所分泌的IL-1β、TNF-α等炎症细胞因子,从而抑制机体炎症反应的发展,缓解患者临床症状[12]。因此,二者联合治疗IPF可发挥协同作用,相辅相成,有效减轻机体炎症反应程度。
CD3+、CD4+是重要的辅助性T细胞,其水平可反映机体细胞免疫功能[13]。研究表明,CD3+、CD4+等细胞因子失衡可能会激活成纤维细胞,促进胶原沉积,促进IPF患者肺纤维化进程,降低机体肺功能[14]。本研究结果显示,观察组患者免疫功能及肺功能改善情况优于对照组,表明环孢素注射液联合甲泼尼龙可有效改善IPF患者免疫功能及肺功能。分析原因可能为,甲泼尼龙可降低机体炎症反应,减轻肺部组织细胞炎症性损伤程度,并能保护溶酶体膜的稳定性,维持肺泡Ⅱ型细胞对表面活性物质的分泌能力,从而维持肺泡正常舒缩功能,改善患者通气状况[15]。甲泼尼龙还能通过控制机体炎症反应抑制辅助性T细胞的凋亡,提高CD3+、CD4+水平,从而改善机体免疫功能,进而抑制非纤维化进程,改善患者肺功能。但甲泼尼龙大量使用可能引起诸多激素副作用,影响患者耐受性及治疗效果,不利于疾病转归。环孢素注射液具有广泛的免疫调节作用,与环孢素结合蛋白相结合后可作用于钙调磷酸酶,抑制活化T细胞核因子的去磷酸化,阻碍白细胞介素-2的合成与分泌,从而影响T淋巴细胞的增殖与分化,增加辅助性T细胞的生成,阻碍抑制性T细胞的形成,改善机体免疫功能,并阻断机体免疫失衡造成的非纤维化进程,进而改善患者肺功能[16]。此外,环孢素注射液可抑制机体氧自由基的产生,减轻肺组织脂质过氧化性损伤程度,并能抑制肺组织中纤维连接蛋白及血小板衍化生长因子的表达,从而抑制肺纤维化进程,减轻患者病情,改善肺功能。因此,将环孢素注射液与甲泼尼龙联合用于IPF治疗中,可通过不同机制发挥抗炎、抑制过度免疫反应的作用,有利于稳定患者病情,缩短患者疗程,避免长期用药,降低患者耐受性,从而提高治疗效果,促进机体免疫功能及肺功能改善。这也与王阿红等[17]报道一致。
另外,本研究中两组不良反应发生率均较低,表明环孢素注射液联合甲泼尼龙治疗IPF具有较高安全性。分析原因可能为,临床在采用大剂量环孢素注射液联合甲泼尼龙治疗IPF一段时间后,会根据患者具体情况逐渐减少药物使用量,可在一定程度上降低药物蓄积对患者产生的刺激,从而减少不良反应的发生,提高用药安全性。
综上所述,环孢素注射液联合甲泼尼龙治疗IPF效果确切,可有效减轻机体炎症反应,改善患者免疫功能及肺功能,且不良反应较少。但本研究也存在一定局限性,如未分析不同药剂量甲泼尼龙联合环孢素注射液对IPF患者的治疗效果,且本研究未对患者长期生存情况进行观察,今后还需进一步研究分析。

