烷基化修复蛋白B同源物5调控果蝇Zeste基因增强子人类同源物2对K562/阿霉素细胞耐药的影响
陈 莉, 吉慧娟, 任利彬, 张洪峰, 索晓慧, 刘洪峰, 夏利敏
(河北省邯郸市中心医院, 1. 血液内一科, 2. 普外科, 3. 科研科, 4. 乳腺外科, 河北 邯郸, 056001)
白血病是一种侵袭性血液系统恶性肿瘤,其特征是细胞分化停滞和克隆性髓系前体的无限增殖[1]。目前,化疗仍是白血病的重要治疗方法。然而,伴随着化疗药物的使用,白血病细胞逐渐产生耐药性,导致化疗失败[2]。因此,了解白血病的发病机制对于确定新的有效治疗靶点至关重要。N6-甲基腺苷(m6A)是大多数真核生物信使RNA(mRNA)中最常见的表观修饰,越来越多的证据[3-4]证实m6A修饰可调节多种生物学功能,例如RNA加工、核输出、翻译、降解等,而异常的m6A修饰则引起胚胎发育障碍、肿瘤发生、稳态失衡等。烷基化修复蛋白B同源物5(ALKBH5)作为m6A修饰的关键去甲基化酶之一,研究[3]表明ALKBH5以m6A依赖性方式通过酪蛋白激酶2α介导的糖酵解途径抑制膀胱癌进展并使膀胱癌细胞对顺铂敏感。本研究探讨ALKBH5对K562/阿霉素(ADM)细胞耐药的影响以及其作用机制,现将结果报告如下。
1 材料与方法
1.1 细胞来源、主要试剂及仪器
人白血病细胞系K562和相应的ADM抗性细胞K562/ADM细胞均购自中国科学院上海细胞库。pcDNA3.1载体购自武汉淼灵生物科技有限公司; ALKBH5-1干扰序列1(si-ALKBH5-1)、ALKBH5-1干扰序列2(si-ALKBH5-2)及其阴性对照si-NC, pcDNA3.1-ALKBH5-WT、pcDNA3.1-ALKBH5-MUT[5](ALKBH5突变位点为H204A)、pcDNA3.1-EZH2均由华大基因合成; 胎牛血清(FBS)、RPMI-1640培养基、LipofectamineTM2000转染试剂盒均购自美国Bio-Rad公司; CCK-8试剂盒购自武汉默沙克生物科技有限公司; EpiQuik M6A RNA甲基化定量检测试剂盒(比色法)购自长沙鼎国生物技术有限公司; RNA免疫共沉淀(RIP)试剂盒、甲基化RNA免疫共沉淀(MeRIP)试剂盒购自广州伯信生物科技有限公司; BCA试剂盒购自河南天驰生物技术有限公司; ALKBH5、果蝇Zeste基因增强子人类同源物2(EZH2)、P糖蛋白(P-gp)、多药耐药基因1(MDR1)、GAPDH兔多克隆抗体及辣根过氧化物酶(HRP)标记的羊抗兔二抗均购自美国Abcam公司; CO2培养箱购自上海知楚仪器有限公司。
1.2 细胞培养与转染
将K562、K562/ADM细胞在含有10% FBS的RPMI-1640 培养基中培养,在培养K562/ADM细胞时还需向培养基中加入1 mg/L ADM以维持细胞的耐药性,所有细胞均在37 ℃、5%CO2培养箱中培养,在实验前2周采用不含药物的正常培养基培养。利用LipofectamineTM2000转染试剂盒对K562/ADM细胞进行转染,并分为对照组(未转染的K562/ADM细胞)、si-NC组(转染si-NC)、si-ALKBH5-1组(转染si-ALKBH5-1)、si-ALKBH5-2组(转染si-ALKBH5-2)、空载体组(转染pcDNA3.1)、ALKBH5-WT组(转染pcDNA3.1-ALKBH5-WT, 过表达ALKBH5质粒)、ALKBH5-MUT组(转染pcDNA3.1-ALKBH5-MUT, 过表达ALKBH5突变型质粒,该突变使其无法发挥去甲基化酶活性)、si-ALKBH5-2+空载体组(si-ALKBH5-2与pcDNA3.1共转染)、si-ALKBH5-2+pcDNA3.1-EZH2组(si-ALKBH5-2与pcDNA3.1-EZH2共转染)。
1.3 CCK-8法检测ADM对K562、K562/ADM细胞的半数抑制浓度(IC50)
取对数生长期的K562、K562/ADM细胞,调整细胞浓度为5×103个/孔后接种于96孔板中,置于培养箱中孵育过夜,加入不同浓度的ADM (0~1 000 μmol/L),每个浓度设置6个复孔,在培养箱中继续孵育24 h后,向每孔中加入10 μL CCK-8溶液,培养2 h后利用酶标仪检测450 nm处的光密度(OD450 nm), 并计算K562、K562/ADM细胞的IC50。
1.4 m6A含量检测及CCK-8法检测细胞活力
严格按照EpiQuik M6A RNA甲基化定量检测试剂盒(比色法)说明书操作步骤检测m6A含量。收集各组细胞,调整细胞浓度为2×105个/孔后接种于96孔板中,每组细胞设置6个复孔,在培养箱中孵育24 h后向每孔中加入10 μL CCK-8溶液,孵育2 h后使用酶标仪检测OD450 nm。
1.5 ADM外排测定
根据ADM自发荧光强度反映ADM外排程度。调整各组K562/ADM细胞浓度为1×106个/mL, 加入含有1 mg/L ADM的RPMI-1640培养基在培养箱中培养3 h后,采用PBS洗涤2次,将细胞在37 ℃下培养1 h, 荧光光度计检测激发波长为480 nm、发射波长为570 nm处的荧光强度,并计算相对荧光强度值。
1.6 Western blot检测蛋白表达
采用RIPA裂解缓冲液提取细胞中的总蛋白质,通过BCA试剂盒测定蛋白质浓度。将提取的蛋白质置于上样缓冲液中, 95 ℃煮沸10 min, 上样至每孔(每孔30 μg); 采用10%十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶电泳(PAGE)分离蛋白质,将分离的蛋白质转移至聚偏二氟乙烯(PVDF)膜上,将膜在5%脱脂牛奶中封闭1 h, 然后与一抗ALKBH5(1∶2 000)、EZH2(1∶1 000)、P-gp(1∶1 000)、MDR1(1∶2 000)、GAPDH(1∶1 000)在4 ℃下孵育过夜; 采用TBST冲洗3次,再加入HRP标记的山羊抗兔IgG二抗(1∶1 000)在室温下孵育2 h, 通过化学发光试剂显色,以GAPDH为内参,使用Image J软件对目的蛋白条带进行灰度值分析。
1.7 RIP实验验证ALKBH5与EZH2 mRNA的相互作用
使用RIP试剂盒进行RIP分析,将细胞用RIPA裂解缓冲液裂解,细胞裂解物在4 ℃下用抗ALKBH5抗体或IgG抗体(对照)免疫沉淀过夜。纯化RNA后,进行RT-PCR和qRT-PCR 以测量ALKBH5或IgG免疫复合物中EZH2mRNA的水平。
1.8 MeRIP检测
对于m6A RNA结合实验,分离各组细胞的RNA, 并用RNase I处理。通过在冰水混合物上超声处理10 s使RNA片段化。使用预先在RIPA缓冲液中与磁性Life Technologies Dynabeads结合的抗m6A抗体进行免疫沉淀,并与片段化的RNA一起孵育,然后在42 ℃下用20 mg/mL蛋白酶K处理beads 2 h。随后使用苯酚/氯仿/异戊醇提取RNA, 并使用EZH2的引物,以β-actin为内参,对EZH2m6A水平进行qRT-PCR。引物:EZH2正向引物为5′-AAGAAGAAGAAGAGAAGAA-3′, 反向引物为5′-ATAGTAAGTGCCAATGAG-3′;β-actin正向引物为5′-CTCCATCCTGGCCTCGCTGT-3′, 反向引物为5′-GCTGTCACCTTCACCGTTCC-3′。
1.9 统计学分析
采用SPSS 17.0统计软件进行数据处理,符合正态分布的计量资料采用均值±标准差表示,多组间的比较使用单向方差分析,进一步的2组间比较行SNK-q检验; 2组间比较采用独立样本t检验; 不符合正态分布的计量资料采用中位数(四分位数)[M(P25,P75)]表示,采用非参数检验,P<0.05为差异有统计学意义。
2 结 果
2.1 K562和K562/ADM细胞的ADM耐药性
K562细胞的IC50为(18.35±1.69) μmol/L, K562/ADM细胞的IC50为(296.67±4.68) μmol/L, 差异有统计学意义(P<0.05), K562/ADM细胞对ADM的耐药性是K562细胞的16.17倍。
2.2 K562、K562/ADM细胞中ALKBH5蛋白及m6A含量比较
与K562细胞比较, K562/ADM细胞中ALKBH5蛋白表达水平升高, m6A含量降低,差异均有统计学意义(P<0.01), 见图1、表1。
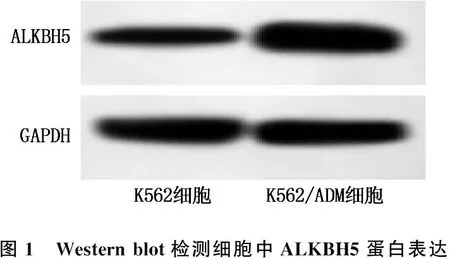
图1 Western blot检测细胞中ALKBH5蛋白表达
表1 K562、K562/ADM细胞中ALKBH5蛋白及m6A含量比较
2.3 ALKBH5在K562/ADM细胞中发挥去甲基化酶功能
与对照组、si-NC组比较, si-ALKBH5-1组、si-ALKBH5-2组细胞中ALKBH5蛋白表达水平降低, m6A含量升高,差异有统计学意义(P<0.05); 与对照组、空载体组比较, ALKBH5-WT组细胞中ALKBH5蛋白表达水平升高, m6A含量降低,差异有统计学意义(P<0.05); 与对照组、空载体组比较, ALKBH5-MUT组细胞中ALKBH5蛋白表达水平升高,差异有统计学意义(P<0.05), 而m6A含量无显著变化。见图2、表2。

图2 Western blot检测各组细胞中ALKBH5蛋白表达
表2 各组细胞中ALKBH5蛋白及m6A含量比较
2.4 沉默ALKBH5对K562/ADM细胞活力及耐药性的影响
与对照组、si-NC组比较, si-ALKBH5-1组、si-ALKBH5-2组细胞OD450 nm值、P-gp、MDR1蛋白表达水平降低,细胞内荧光强度升高,差异有统计学意义(P<0.05), 见图3、表3。
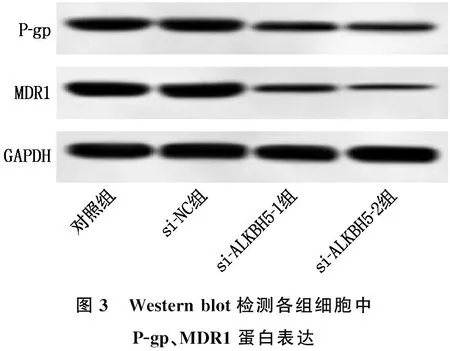
图3 Western blot检测各组细胞中P-gp、MDR1蛋白表达
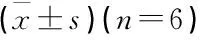
表3 沉默ALKBH5对K562/ADM细胞活力及耐药性的影响
2.5 ALKBH5与EZH2的相互作用
m6A2Target网站(http://m6a2target.canceromics.org/#/perturbation)预测发现ALKBH5可调控EZH2。RIP结果表明,在K562/ADM细胞中, ALKBH5蛋白能与EZH2mRNA相互作用,见图4。与对照组、si-NC组比较, si-ALKBH5-1组、si-ALKBH5-2组细胞中EZH2 m6A水平升高, EZH2蛋白表达水平降低,差异有统计学意义(P<0.05); 与对照组、空载体组比较, ALKBH-WT组细胞中EZH2m6A水平降低, EZH2蛋白表达水平升高,差异有统计学意义(P<0.05), 见图5、表4。

图5 Western blot检测各组细胞中EZH2蛋白表达
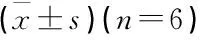
表4 各组细胞中EZH2蛋白、EZH2 m6A表达
2.6 EZH2过表达逆转了沉默ALKBH5对K562/ADM细胞活力及耐药性的影响
与对照组、si-NC组比较, si-ALKBH5-2组细胞OD450 nm值、EZH2、P-gp、MDR1蛋白表达水平降低,细胞内荧光强度升高,差异有统计学意义(P<0.05); 与si-ALKBH5-2组、si-ALKBH5-2+空载体组比较, si-ALKBH5-2+pcDNA3.1-EZH2组细胞OD450 nm值、EZH2、P-gp、MDR1蛋白表达水平升高,细胞内荧光强度降低,差异有统计学意义(P<0.05)。见图6、表5。
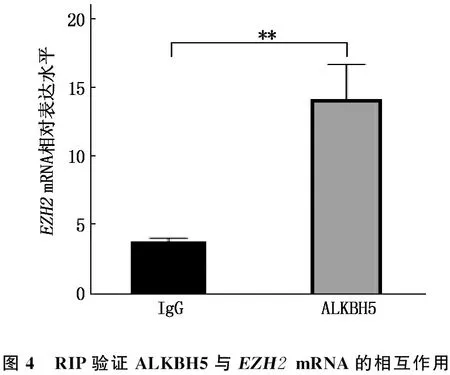
图4 RIP验证ALKBH5与EZH2 mRNA的相互作用
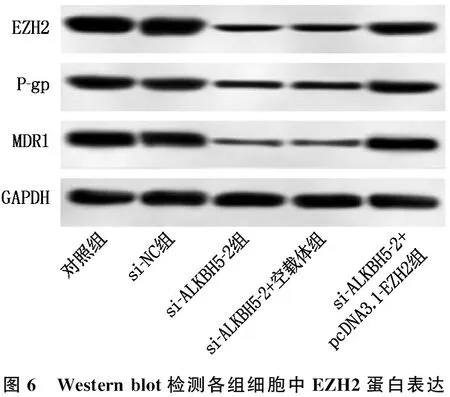
图6 Western blot检测各组细胞中EZH2蛋白表达
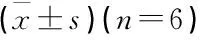
表5 EZH2过表达逆转了沉默ALKBH5对K562/ADM细胞活力及耐药性的影响
3 讨 论
表观遗传调控的异常(如DNA甲基化、组蛋白乙酰化和RNA甲基化)在白血病的发生与发展中发挥着重要的作用[6]。作为真核生物中最常见的mRNA甲基化类型, m6A修饰受到越来越多的关注[7]。m6A甲基化的过程是可逆的,并且受甲基转移酶、去甲基化酶和效应蛋白的动态调控[8]。ALKBH5是一种核酸加氧酶,是第2种被发现的m6A去甲基化酶,参与mRNA的加工及降解,在多种生命活动中具有重要的调控作用[9]。ALKBH5的异常表达与肿瘤的发生发展密切相关,例如ALKBH5通过增强乳腺导管癌细胞的上皮间质转化和血管生成促进乳腺浸润性导管癌的侵袭和转移[10]; ALKBH5的高表达与肺腺癌的恶性进展密切相关,沉默ALKBH5的表达具有抑制肺腺癌细胞克隆形成的作用[11]; ALKBH5 通过转录后调节其关键靶标转录相关酸性卷曲蛋白3(TACC3)在白血病中发挥肿瘤促进作用[12]; ALKBH5通过降低长链非编码RNA(LncRNA)核富集转录体1(NEAT1)的甲基化促进胃癌的侵袭和转移[13]。本研究结果显示,K562/ADM细胞对ADM的耐药性显著高于K562细胞; 与K562细胞比较,K562/ADM细胞中ALKBH5蛋白表达水平显著升高, m6A含量显著降低; 沉默ALKBH5可增加K562/ADM细胞中m6A含量,过表达野生型ALKBH5可降低m6A含量,而过表达突变型ALKBH5(H204A)对m6A含量无显著影响,说明ALKBH5在K562/ADM细胞中发挥去甲基化酶功能。
白血病细胞对化疗药物产生耐药性的最经典机制就是MDR1基因的激活,MDR1mRNA编码的P-gp能够利用水解三磷酸腺苷(ATP)的能量将化疗药物从细胞内转运到细胞外,进而降低细胞内药物的浓度而产生耐药[14]。研究[15]报道,绿原酸在体外可有效逆转K562/ADM细胞多药耐药,其分子机制与抑制P-gp表达有关; 稳定干扰ENO1表达能有效逆转K562/A02细胞耐药性,提高其对药物的敏感性,其机制与MDR1基因表达相关[16]。本研究结果显示,沉默ALKBH5可抑制K562/ADM细胞活力、ADM外排及MDR1、P-gp蛋白表达,提示沉默ALKBH5可增强K562/ADM细胞对药物的敏感性。
EZH2是多梳抑制复合物 2 的催化亚基之一[17]。相关文献[18]报道,EZH2的高表达与子宫内膜癌的不良预后显著相关,沉默EZH2可增强癌细胞对常用化疗药物的敏感性; EZH2蛋白通过促进细胞周期进展及肿瘤增殖能力来诱导非小细胞肺癌对顺铂产生耐药[19]; 过表达miR-101-3p可通过靶向抑制EZH2表达来降低子宫内膜癌细胞株Ishikawa对顺铂的耐药性[20]。本研究通过m6A2Target网站预测发现ALKBH5可调控EZH2, RIP分析发现ALKBH5蛋白能与EZH2mRNA相互作用,推测ALKBH5可能以m6A依赖的方式调控EZH2的表达。为了验证该假设,采用MeRIP 及Western blot实验分析发现,沉默ALKBH5可上调K562/ADM细胞中EZH2m6A水平,下调EZH2蛋白表达水平,过表达野生型ALKBH5可下调K562/ADM细胞中EZH2m6A水平,上调EZH2蛋白表达水平,表明沉默ALKBH5通过促进EZH2的甲基化来下调EZH2的表达。最后,本研究通过EZH2回复实验证明了EZH2过表达逆转了沉默ALKBH5对K562/ADM细胞活力及耐药性的影响。
综上所述,沉默ALKBH5通过促进EZH2的甲基化来下调EZH2的表达,进而降低K562/ADM的耐药性。由于本研究仅简单分析了ALKBH5调控EZH2对K562/ADM细胞活力及耐药性的影响,关于其具体作用机制及逆转耐药的机制仍需要从多种受试细胞株、动物实验以及逆转耐药评价指标等多角度、多方面开展研究。

