非甾体类抗炎药相关性上消化道出血的危险因素及凝血相关指标分析
邓园园, 黄应文, 熊 红, 卢水焕, 周先宝, 贺学强
(中国人民解放军联勤保障部队第九二四医院 消化科, 广西 桂林, 541000)
非甾体类抗炎药(NSAIDs)是指无甾体结构的抗炎药物,包括阿司匹林、双氯芬酸、塞来昔布等,已被广泛应用于抗凝血、抗炎、止痛、抗风湿、抗癌等方面[1]。然而,长期服用NSAIDs的患者具有较高的胃肠道反应发生风险,其中10%~25%患者可出现消化性溃疡,约1%患者可出现消化道出血甚至穿孔等严重并发症,严重时将危及生命[2]。研究[3]表明,消化道出血患者常见凝血功能异常,且常伴有胃黏膜糜烂或消化性溃疡等表现,故推测NSAIDs相关性上消化道出血可能与NSAIDs致胃肠道黏膜损伤和抗血小板聚集与黏附等作用有关。本研究观察NSAIDs相关性上消化道出血患者的凝血相关指标变化,并分析可能的危险因素,以期为NSAIDs的科学用药和消化道出血的防治提供参考依据。
1 资料与方法
1.1 一般资料
选取2019年10月—2021年5月中国人民解放军联勤保障部队第九二四医院收治的108例NSAIDs相关性上消化道出血患者设为出血组,另选取同期服用NSAIDs但未发生上消化道出血的108例门诊复查患者设为非出血组。本研究经医院伦理委员会审核批准,且患者和(或)家属均签署知情同意书。
纳入标准: ① 入院前有长期服用NSAIDs史或短期维持NSAIDs治疗史者,且出血组患者用药期间或用药后出现出血症状; ② 出血组患者均因腹痛、黑便或呕血等症状就诊,粪便隐血检查呈阳性,内镜检查可见胃肠黏膜出血斑点或糜烂等,符合《内科学》[4]中关于消化道出血的诊断标准; ③自愿参与本研究并能配合临床检查及评估者。排除标准: ① 呼吸系统疾病所致出血者; ② 合并血管畸形、消化系统肿瘤、肝硬化及食管胃底静脉曲张破裂等因素所致出血者; ③ 饮食因素所致黑便者; ④ 合并肛裂、痔疮、炎性肠病者; ⑤ 消化道相关手术所致出血者; ⑥ 未接受内镜检查者; ⑦ 先天性凝血功能缺陷患者,既往有血液系统疾病或其他可能影响凝血功能疾病的患者。
1.2 方法
1.2.1 资料收集: 统计2组患者的年龄、性别、吸烟史、饮酒史、幽门螺杆菌(Hp)感染情况、基础疾病(高血压、高脂血症、糖尿病、冠心病、脑血管疾病、慢性胃炎、贫血)、服用NSAIDs种类、NSAIDs用药时间、联合用药[质子泵抑制剂(PPI)、胃黏膜保护剂、氯吡格雷、利尿剂、钙通道拮抗剂(CCB)、β肾上腺素受体阻断剂、血管紧张素转换酶抑制剂(ACEI)、血管紧张素Ⅱ受体阻断剂(ARB)、口服降糖药物二甲双胍]情况等。有吸烟史指吸烟频率≥10支/d, 吸烟时间>1年; 有饮酒史指饮酒量≥100 mL/d, 饮酒时间≥1年; Hp感染情况根据14C呼气试验结果诊断。
1.2.2 实验室指标检测: 所有受试者入院后均急查实验室指标,或空腹8 h以上于次日清晨8: 30—9: 30采集空腹静脉血4.0 mL, 采用全自动凝血仪检测凝血功能指标[活化部分凝血活酶时间(APTT)、凝血酶时间(TT)、凝血酶原时间(PT)、纤维蛋白原(Fib)、D-二聚体(D-D)和血小板(PLT)]水平,常规检测操作均由固定检验人员严格按照试剂说明书执行。
1.3 统计学分析
2 结 果
2.1 上消化道出血患者的临床症状与体征
出血组108例上消化道出血者中, 71例出现黑便、47例出现呕血(有10例患者兼有黑便、呕血), 49例伴有腹胀、腹痛等腹部症状。本组患者的NSAIDs服用量均在说明书推荐的安全剂量范围内。
2.2 一般资料比较
2组性别分布情况比较,差异无统计学意义(P>0.05); 出血组年龄≥60岁者、有吸烟史者、有饮酒史者占比均高于非出血组,差异有统计学意义(P<0.05)。见表1。

表1 2组患者一般资料比较
2.3 Hp感染及基础疾病情况比较
出血组合并Hp感染、冠心病、脑血管病及慢性胃炎者占比高于非出血组,差异有统计学意义(P<0.05或P<0.01); 出血组合并高血压、糖尿病、高脂血症、贫血者占比与非出血组比较,差异无统计学意义(P>0.05)。见表2。
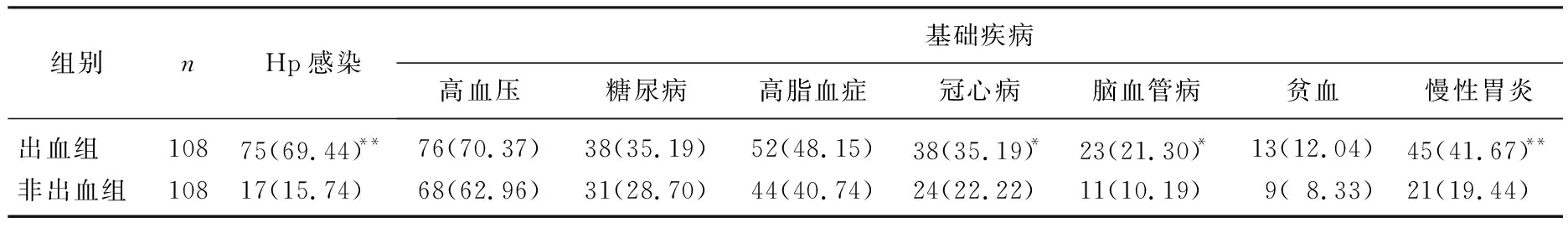
表2 2组患者Hp感染及基础疾病情况比较[n(%)]
2.4 用药情况比较
出血组NSAIDs用药时间>12个月者占比、阿司匹林用药率、≥2种NSAIDs联用率以及氯吡格雷、螺内酯用药率均高于非出血组, NSAIDs用药时间<1个月者占比、布洛芬用药率、双氯芬酸钠用药率、PPI用药率、胃黏膜保护剂用药率均低于非出血组,差异有统计学意义(P<0.05或P<0.01); 2组其余用药情况比较,差异无统计学意义(P>0.05)。见表3。
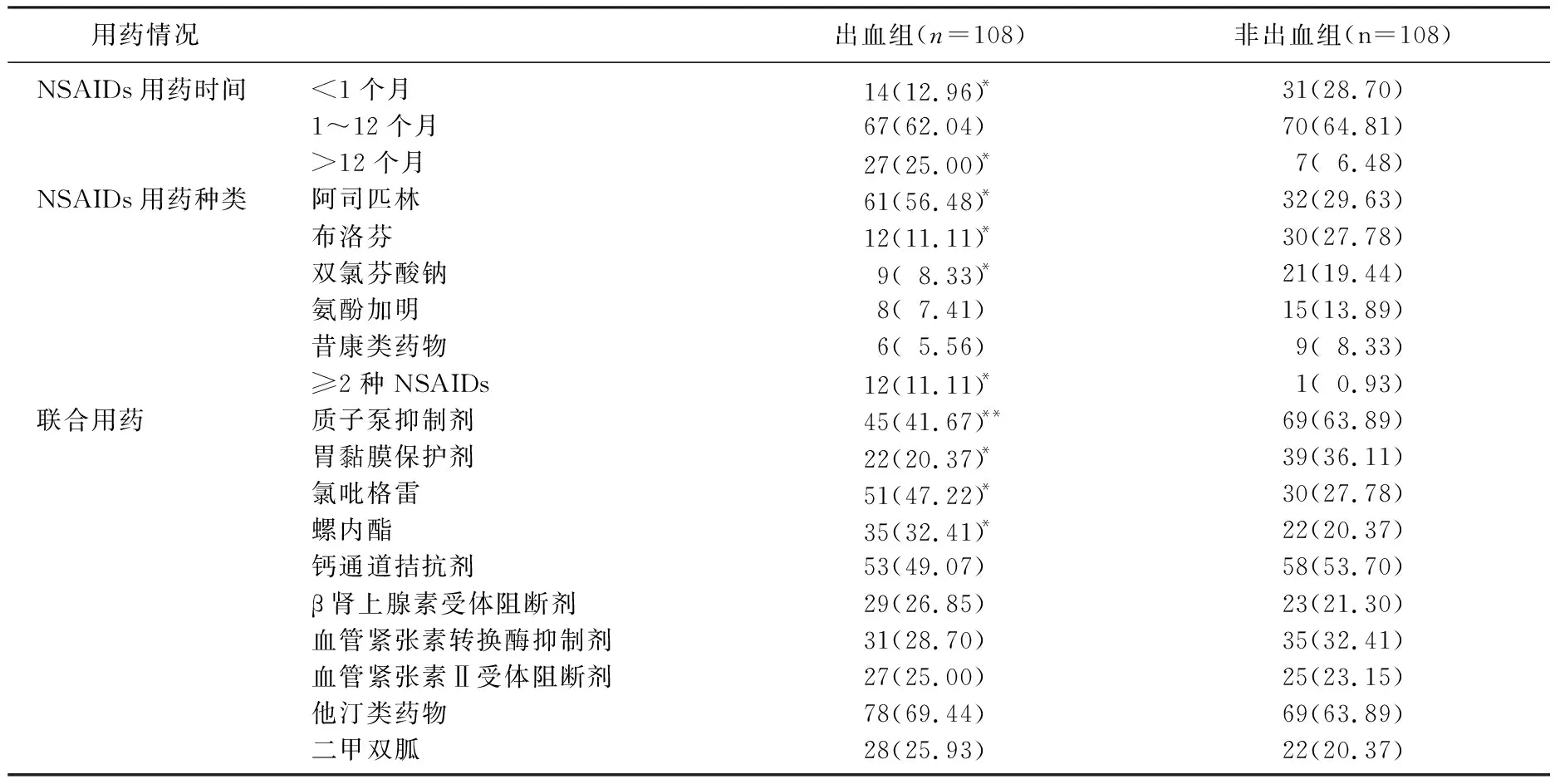
表3 2组患者用药情况比较[n(%)]
2.5 凝血指标比较
2组PT、TT、APTT、Fib、D-D、PLT比较,差异均无统计学意义(P>0.05), 见表4。

表4 2组凝血指标比较
2.6 非条件多因素Logistic回归分析
以单因素分析中差异具有统计学意义(P<0.05)的指标为自变量,以消化道出血为因变量,进行非条件多因素Logistic回归分析。自变量赋值情况: 年龄, <60岁=1, ≥60岁=2; 吸烟,否=0, 是=1; 饮酒,否=0, 是=1; Hp感染,否=0, 是=1; 冠心病,否=0, 是=1; 脑血管病,否=0, 是=1; 慢性胃炎,否=0, 是=1; 用药时间, <1个月=1, 1~12个月=2, >12个月=3; 用药种类,联合用药=3, 阿司匹林=2, 其他=1; 螺内酯,否=0, 是=1; 氯吡格雷,否=0, 是=1; PPI, 否=0, 是=1。
非条件多因素Logistic回归分析结果显示,使用PPI和使用胃黏膜保护剂是NSAIDs相关性上消化道出血的独立保护因素(P<0.05或P<0.01), 高龄、吸烟、饮酒、合并Hp感染、冠心病、脑血管病、慢性胃炎和服用阿司匹林、服用≥2种NSAIDs、NSAIDs用药时间长、联用螺内酯、联用氯吡格雷是NSAIDs相关性上消化道出血的独立危险因素(P<0.05或P<0.01)。见表5。
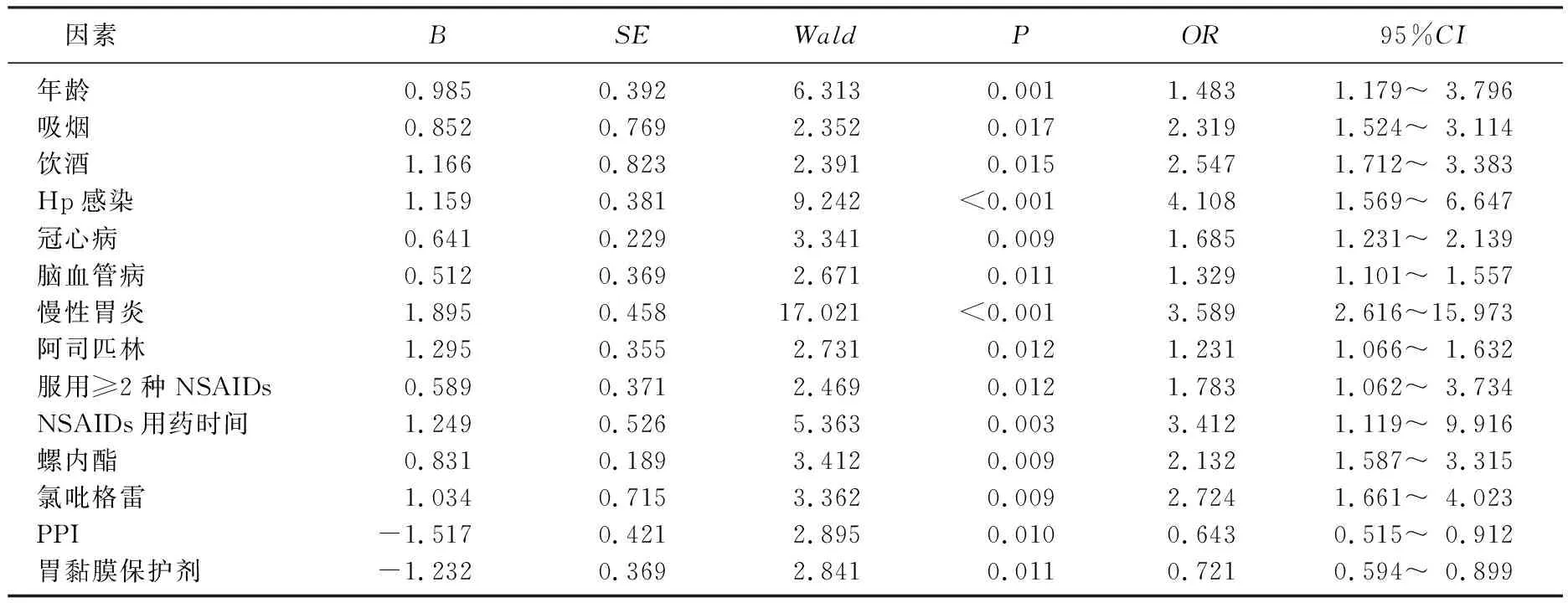
表5 NSAIDs相关性上消化道出血的非条件多因素Logistic回归分析
3 讨 论
上消化道出血是NSAIDs的严重不良反应之一,不仅会增大临床治疗难度,而且具有较高的致死风险[5]。NSAIDs相关性消化道出血的发生机制较为复杂,主要与NSAIDs弱酸性作用、抑制环氧合酶活性、诱导白三烯释放等有关[6-7]。NSAIDs种类较多,且用药患者的年龄、基础疾病等情况差异较大,导致临床用药决策的选择和消化道出血的防治较为困难,故分析NSAIDs相关性上消化道出血的影响因素非常必要。
本研究中,出血组年龄≥60岁者占比(55.56%)显著高于非出血组,且多因素Logistic回归分析显示高龄是NSAIDs相关性上消化道出血的独立危险因素(P<0.05), 表明年龄较大者服用NSAIDs可能更容易发生消化道出血。分析原因,老年人往往存在生理性胃黏膜屏障功能减弱、伴发基础疾病较多等情况,常需长期用药或用药种类繁多,增加了消化道出血风险[8]。本研究还发现,出血组中有吸烟史及饮酒史者占比显著高于非出血组,且多因素Logistic回归分析证实吸烟、饮酒为上消化道出血的独立危险因素。分析原因,香烟中的尼古丁会影响受损胃肠黏膜的修复,而酒精对胃肠黏膜具有刺激和损伤作用,可增加炎症反应、凝血功能障碍等的发生,进而增加黏膜损伤、出血的发生风险[9-10]。
本研究发现,相较于非出血组,出血组合并Hp感染、冠心病、脑血管病及慢性胃炎者占比显著更高,且以上因素均为NSAIDs相关性上消化道出血的独立危险因素(P<0.05)。分析原因,合并心脑血管疾病、Hp感染或慢性胃炎时,患者胃黏膜已存在不同程度损伤或缺血缺氧情况,在NSAIDs刺激下更易发生上消化道出血[11-13]。多因素Logistic回归分析结果显示,使用PPI和胃黏膜保护剂均为NSAIDs相关性上消化道出血的保护性因素,故建议服用NSAIDs时可联合应用恰当的PPI及胃黏膜保护剂,以降低出血风险,而合并Hp感染或有慢性胃炎病史者应慎用NSAIDs。
NSAIDs种类较多,本研究出血组中,阿司匹林的用药率(56.48%)最高。同时,出血组NSAIDs使用时间>12个月者占比(25.00%)和≥2种NSAIDs联用率显著高于非出血组,且多因素Logistic回归分析证实NSAIDs用药时间长、联用≥2种NSAIDs均为上消化道出血的独立危险因素,提示临床用药时应尽量避免长时间用药和多种NSAIDs联用。本研究还发现,联用螺内酯、氯吡格雷也是NSAIDs相关性上消化道出血的独立危险因素(P<0.05), 与相关研究[14-15]结论相符。相关专家共识[16]也指出,除高龄、合并Hp感染、既往消化道溃疡或出血史外,联合抗凝或抗血小板治疗等是消化道出血的高危因素。伍双蝶等[17]报道,阿司匹林可导致大鼠小肠黏膜损伤,且与氯吡格雷联用时损伤加重。因此,长期服用NSAIDs者应酌情调整螺内酯、氯吡格雷用量,以降低消化道出血的发生风险。
相关研究[18-19]指出,凝血功能指标异常与消化道出血具有一定相关性,而NSAIDs可能引起血小板聚集减少、局部血流量减少等,进而增大消化道出血风险。本研究中, 2组患者PT、TT、APTT、Fib、D-D及PLT比较,差异均无统计学意义(P>0.05), 与李璧倩等[20]研究结论基本一致,提示NSAIDs相关性上消化道出血可能与凝血机制的关系并不明显。分析原因,可能是NSAIDs使用剂量处于安全范围内,并不足以明显干扰凝血功能。
综上所述, NSAIDs相关性上消化道出血的危险因素较多,高龄、吸烟、饮酒、有心脑血管病史、合并Hp感染、有慢性胃炎病史、长期使用NSAIDs或多药联用的患者更易发生NSAIDs相关性上消化道出血。临床治疗时,针对高危因素制订个性化治疗方案并联用PPI、胃黏膜保护剂,可预防或减少NSAIDs相关性上消化道出血的发生。

