原发性肝细胞癌患者血清血管内皮细胞生长因子、可溶性胸苷激酶-1和T淋巴细胞亚群的临床意义
侯宝洲, 李慧平, 魏思忱, 穆宗玮, 李丽娟, 田树英
(河北省沧州市中心医院, 1. 消化内二科, 2. 医务部, 河北 沧州, 061000)
肝癌是中国主要的消化道恶性肿瘤之一,发病率居所有恶性肿瘤的第5位,病死率居第7位[1]。肝癌的具体发病机制仍不清楚,考虑与肝脏局部微环境中炎症反应、病毒感染、氧化应激、损伤修复以及遗传基因功能改变等有关[2]。血管新生是所有恶性肿瘤发生和发展的重要机制[3]。血管内皮细胞生长因子(VEGF)是目前最强效的促血管新生的细胞因子,与多种恶性肿瘤的发生及患者生存预后密切相关[4]。可溶性胸苷激酶-1(TK-1)是调控DNA结构和功能表达的重要活性酶,与DNA能量代谢和损伤修复有关[5]。TK-1被证实与多种恶性肿瘤如上皮性卵巢癌、结直肠癌的发生和临床预后密切相关[6]。肝癌的发生与细胞免疫逃逸机制有关[7], T淋巴细胞亚群是机体细胞免疫的主要成分,在诱导杀伤癌细胞、促进癌细胞凋亡方面发挥重要作用[8]。本研究分析肝癌患者血清中VEGF、TK-1、T淋巴细胞亚群与肿瘤临床病理特征及患者生存预后的相关性,现将结果报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年9月—2020年9月105例在本院确诊肝细胞癌患者的临床资料,男60例,女45例,平均年龄(63.2±8.4)岁。纳入标准: ① 年龄>18岁者; ② 符合原发性肝癌诊断标准者[9]; ③ 临床资料完整者。排除标准: ① 入院前已经接受肝癌手术、放化疗者; ② 合并肝转移瘤、肝功能衰竭者; ③ 合并严重心、肺、肾功能障碍,自身免疫性疾病以及营养代谢性疾病者; ④ 妊娠、哺乳期女性。
1.2 研究方法
患者入院24 h内采集空腹外周静脉血10 mL, 采用ELISA法检测VEGF、TK-1水平,试剂购自美国Sigma公司; 流式细胞术检测T淋巴细胞亚群(CD3+、CD4+、CD8+百分比和CD4+/CD8+), 淋巴细胞亚群分析试剂和单克隆酶联免疫试剂盒购自美国BD公司,按试剂说明书的要求操作。
统计肿瘤临床病理特征,主要包括性别、年龄、TNM分期、乙型肝炎病毒(HBV)感染、分化级别、肿瘤直径、淋巴结转移和血管浸润。出院后随访时间5~30个月,中位时间20.5个月,存活73例,死亡32例。分析血清VEGF、TK-1、T淋巴细胞亚群与肿瘤临床病理特征及患者生存预后的关系。HBV感染采用血清病原学和HBV DNA定量检测进行确诊。出院后1、3、6、12个月以及此后每隔6个月门诊随访,复查肝功能和肝脏超声,记录肿瘤复发情况和患者生存状况。
1.3 统计学处理
采用SPSS 20.0统计软件进行数据处理,符合正态分布的计量资料采用均数±标准差表示,组间比较采用独立样本t检验,组内比较采用配对样本t检验; 计数资料以[n(%)]表示,组间比较采用χ2检验; 生存预后的危险因素分析采用多因素Cox回归模型,采用逐步后退法计算受试者工作特征(ROC)曲线的曲线下面积(AUC)。P<0.05为差异有统计学意义。
2 结 果
2.1 VEGF、TK-1与肿瘤临床病理特征及生存预后的关系
入院VEGF、TK-1与HBV感染、TNM分期、分化级别、淋巴结转移、血管浸润和生存预后相关,表现为HBV感染阳性、TNM分期Ⅲ~Ⅳ期、低分化、淋巴结转移阳性、血管浸润阳性以及死亡患者的入院血清VEGF、TK-1水平升高,差异有统计学意义(P<0.05)。见表1。
mg/L
2.2 T淋巴细胞亚群与肿瘤临床病理特征、生存预后的关系
入院CD4+/CD8+与HBV感染、TNM分期、分化级别、淋巴结转移、血管浸润和生存预后相关,表现为HBV感染阳性、TNM分期Ⅲ~Ⅳ期、低分化、淋巴结转移阳性、血管浸润阳性以及死亡患者的入院血清CD4+/CD8+降低,差异有统计学意义(P<0.05); CD3+、CD4+、CD8+百分比与肿瘤临床病理特征、生存预后无相关性(P>0.05)。见表2。

表2 T淋巴细胞亚群与肿瘤临床病理特征、生存预后的关系
2.3 治疗前后VEGF、TK-1和T淋巴细胞亚群
的比较
与治疗前比较, 105例肝癌患者治疗后VEGF、TK-1水平下降, CD4+百分比、CD4+/CD8+升高,CD8+百分比下降,差异均有统计学意义(P<0.05)。见表3。

表3 105例肝癌患者治疗前后VEGF、TK-1及T淋巴细胞亚群比较
2.4 生存预后危险因素的Cox回归分析
多因素Cox回归分析显示, TNM分期(Ⅲ~Ⅳ期)、淋巴结转移、血管浸润、VEGF、TK-1以及CD4+/CD8+是生存预后的影响因素(P<0.05)。见表4。

表4 生存预后危险因素的Cox回归分析
2.5 生存预后的ROC曲线分析
ROC曲线分析显示,入院VEGF、TK-1、CD4+/CD8+预测生存预后的AUC分别为0.824、0.869、0.756,联合预测的AUC为0.912,差异均有统计学意义(P<0.05)。见表5。
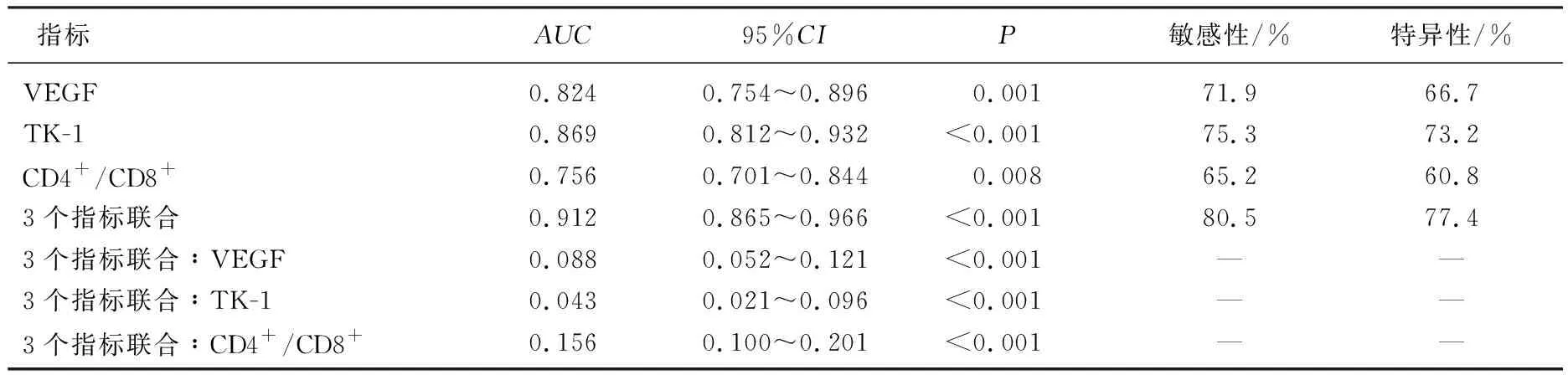
表5 生存预后的ROC曲线分析
3 讨 论
本研究结果显示,入院血清VEGF、TK-1、CD4+/CD8+与HBV感染、TNM分期、分化级别、淋巴结转移、血管浸润、生存预后显著相关(P<0.05); HBV感染阳性、TNM分期Ⅲ~Ⅳ期、低分化、淋巴结转移阳性、血管浸润阳性以及死亡患者的入院血清VEGF、TK-1水平显著升高, CD4+/CD8+显著降低,提示VEGF、TK-1、CD4+/CD8+参与了肝癌的发生、发展以及临床预后[9], 与既往研究[10-13]结论相似,但VEGF信号通路与肿瘤免疫微环境的复杂关系仍不清楚。研究[14-15]表明, VEGF信号通路与免疫细胞浸润和66种免疫标记物的表达呈正相关,与活化的CD8+T细胞以及临床预后呈正相关。在肝癌患者中, VEGF信号通路和肿瘤免疫微环境共同激活是抗VEGF药物以及联合免疫检查点抑制剂(ICB)治疗的重要机制[16]。
谢荣章等[17]研究指出,联合血清甲胎蛋白(AFP)、TK-1和Dickkopf-1(DKK-1)蛋白检测可提高原发性肝癌的早期诊断准确率。TK-1活性与DNA合成过程有关,是肿瘤增殖和细胞周期调控的重要功能酶, TK-1上调往往与细胞核增殖指数呈正相关,是多种恶性肿瘤的重要诊断标志物[18]。目前, ICB和嵌合抗原受体T细胞在肿瘤临床治疗中得到越来越多的应用,宿主免疫系统在肿瘤免疫治疗中对肿瘤细胞的识别和靶向起着重要的作用[19-20]。利用人类免疫细胞进行免疫治疗取得了许多进展,但是一种单独的免疫疗法对癌症的治疗效果不理想,有效的免疫治疗组合如ICB联合免疫细胞治疗有重要的应用前景[21]。HUANG C Y等[22]指出, PD-1/PD-L1免疫检查点抑制剂在各种类型的实体瘤中显示出良好的临床效果,其进行的生存分析表明肿瘤和间质PD-L1状态对患者的总生存率或无复发生存率无显著影响,而高CD8+T细胞密度的患者有较好的总体生存率和无复发生存率,但其良好的预后价值因PD-L1高表达而被消除。特异性CD8+细胞毒性T细胞(CTL)通过人类白细胞抗原(HLA)的I类分子表达显著上调肿瘤细胞系PD-L1的表达,肿瘤PD-L1过度表达以负反馈调节机制降低了CD8+CTL干扰素-γ的分泌。由此推测, PD-L1表达与肝癌CD8+T细胞免疫存在紧密相互作用[23-24]。
本研究还发现,肝癌患者治疗后VEGF、TK-1水平下降, CD4+百分比和CD4+/CD8+升高, CD8+百分比下降,差异均有统计学意义(P<0.05)。多因素Cox回归分析显示, TNM分期、淋巴结转移、血管浸润、VEGF、TK-1、CD4+/CD8+是生存预后的影响因素(P<0.05); 血清VEGF每升高1个标准差,患者死亡风险增加0.865倍(HR=1.865); TK-1每升高1个标准差,患者死亡风险增加0.624倍(HR=1.624); CD4+/CD8+降低1个标准差,患者死亡风险增加0.329倍(HR=1.329)。ROC曲线分析显示,入院VEGF、TK-1、CD4+/CD8+联合检测预测肝癌患者死亡的AUC为0.912,高于任意单一指标,差异有统计学意义(P<0.05)。本研究仍存在样本量不足、随访时间过短等局限性,而回顾性研究可能对实验结果造成偏倚,未来将扩大样本量,延长随访时间,采取多中心、前瞻性随机对照研究予以证实。
综上所述,肝癌患者血清VEGF和TK-1表达升高, CD4+/CD8+下降,与多个肿瘤临床病理特征和患者生存预后密切相关,联合VEGF、TK-1和CD4+/CD8+预测生存预后有较高的价值。

