“海水资源的利用”工艺设计
■赵玉双(博士)
浩瀚的海洋是一个巨大的宝库,海水就是一项取用不尽的资源,它不仅有航运交通之利,而且经过淡化就能大量供给工业和生活用水。海水中含有多种元素,可供提取利用的有50多种。限于经济技术条件,从海水中主要提取食盐、钾盐、溴、碘、镁等物质。目前从海水中制得的氯化钠除了供食用,还作为化工原料用于生产烧碱、纯碱、钠、氯气、盐酸等。从海水中制取镁、钾、溴及其他化工产品,就是在传统海水制盐工业的基础上发展起来的。
一、食盐的提取
食盐提取的方法是将海水引入海滩上的盐田里,利用日光和风力逐渐使水蒸发,慢慢浓缩,使食盐呈结晶析出,这样得到的是粗盐,还含有一定量的Ca2+、Mg2+、Fe3+、SO2-4等可溶性杂质,我们可以利用化学沉淀法进行提纯。
例1 为了除去粗盐中的Ca2+、Mg2+、SO2-4及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后进行下列操作。正确的操作顺序是( )。
①过滤 ②加过量NaOH 溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.④②⑤①③ B.④①②⑤③
C.②⑤④①③ D.①④②⑤③
粗盐经溶解、过滤除去难溶性的杂质泥沙,也可加入沉淀剂后将沉淀与难溶性杂质一并除去。根据除杂时不能引入新的杂质的原则,除杂尽可能选择含钠离子或氯离子的试剂,但每一步所加过量试剂必须通过后续所加试剂除去。
本题目中可能的除杂顺序有:BaCl2→NaOH→Na2CO3→HCl;BaCl2→Na2CO3→NaOH→HCl;NaOH →BaCl2→Na2CO3→HCl。其中过量的NaOH 溶液和Na2CO3溶液都可以通过加入适量盐酸除去,而过量的氯化钡溶液只能靠Na2CO3溶液除去,所以只要Na2CO3加在BaCl2之后保证过量的BaCl2溶液被Na2CO3溶液除去便合理。最后加入的盐酸只能适量。此题的主要目的:既要除去原混合溶液中的杂质,又不能引入新的杂质。解题思路如下:
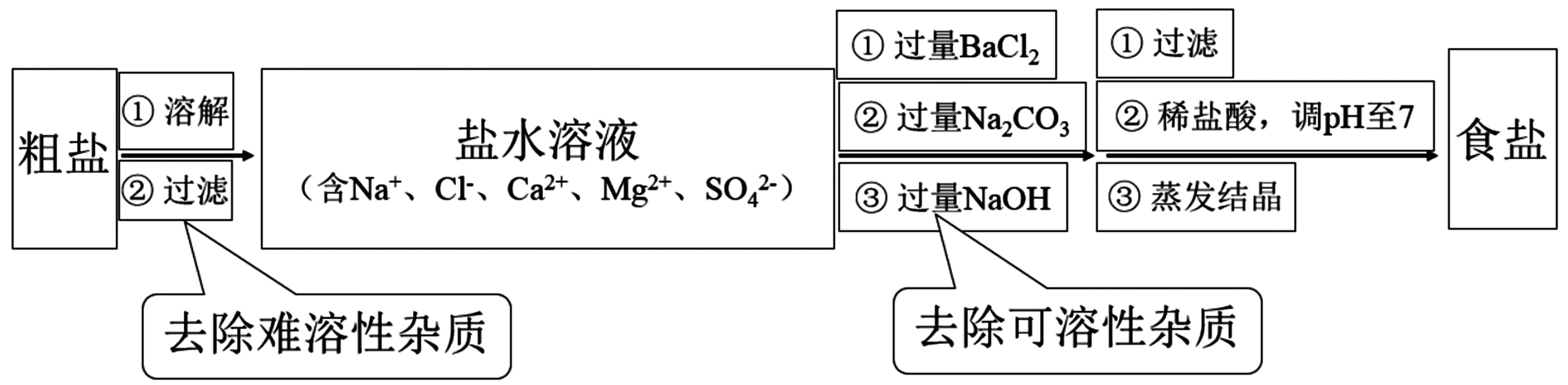
答案:C
二、溴的提取
工业上常常采用空气吹出法提取溴,其基本流程为:酸化→氧化→空气吹出→吸收→氧化→蒸馏。具体空气吹出法的工艺流程如下。
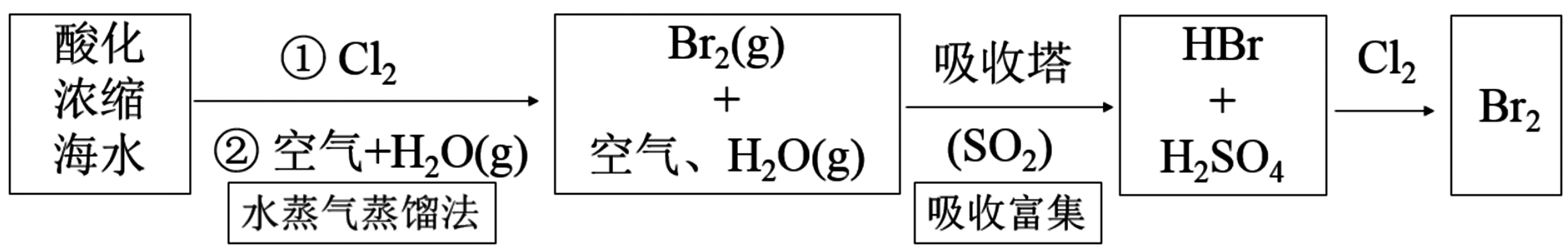
空气吹出法的第一步是在预先经过酸化的浓缩海水中,用氯气氧化溴离子使之成为单质溴,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸气和吸收剂二氧化硫发生反应生成氢溴酸,达到富集溴的目的,也就是得到高浓度的溴离子溶液。然后,再用氯气将其氧化得到产品溴。主要涉及反应的离子方程式为2Br-+Cl2══2Cl-+Br2,SO2+Br2+2H2O ══4H++2Br-+SO2-4。
例2 已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下:
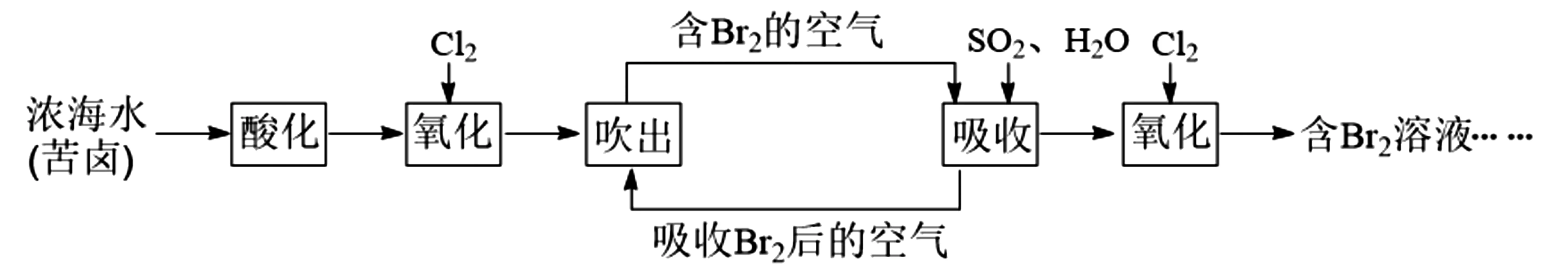


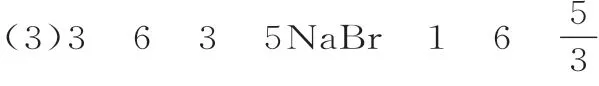
(4)四氯化碳与水互不相溶,且溴在四氯化碳中的溶解度远大于在水中的溶解度
三、碘的提取
碘是国防、工业、农业、医药等部门和行业所依赖的重要原料,海洋水体蕴藏的碘极丰富,总量达800 亿吨。利用晒盐后的卤水也可提取碘,从海水晒盐后的苦卤中提取碘的工艺流程如下。
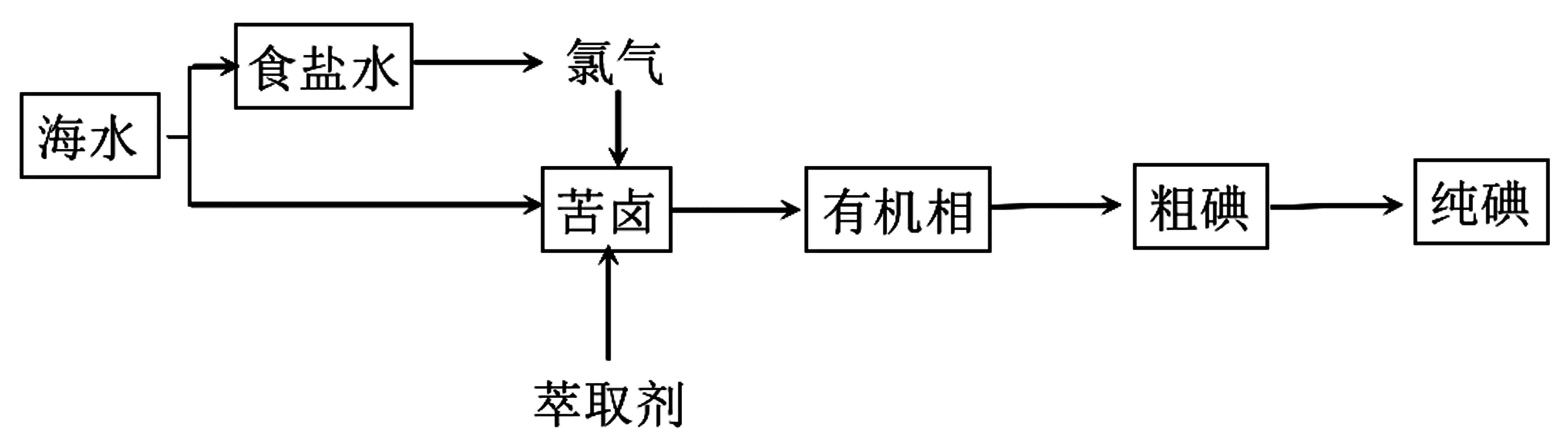
把电解食盐水得到的氯气通入苦卤中,发生氧化还原反应的离子方程式为2I-+Cl2══2Cl-+I2。得到的碘单质用有机溶剂萃取、分液后得到含碘的有机相,然后加入氢氧化钠溶液,碘迅速歧化,又进入水溶液中,从而与有机溶剂分离,进而酸化处理可得粗碘。粗碘可通过升华的方法得到高纯度的碘晶体。
某些海藻具有吸收碘的能力,例如干海带中含碘的质量分数为0.3%~0.5%,比海水中碘的浓度高10 万倍。海带是从食物中摄取碘元素的最佳食品,我们也可以利用化学基本操作从海带中提取碘。

海带灼烧得到的海带灰用蒸馏水溶解,过滤,得到含碘离子的溶液,加入过氧化氢氧化碘离子为碘单质,再加入四氯化碳萃取分液得到含碘单质的四氯化碳溶液,据此分析解答。(1)步骤②加热煮沸一会儿可以使海带灰中含碘物质快速充分溶解。(2)步骤④是在酸性条件下过氧化氢将碘离子氧化为单质碘,要注意氧化还原反应规律的理解和方程式的配平,离子方程式为2I-+H2O2+2H+══I2+2H2O。(3)步骤⑤中加入CCl4作萃取剂提取碘水中的碘,振荡、静置,可以观察到CCl4层呈紫红色,萃取所用的主要仪器是分液漏斗。
答案:(1)促使海带灰中含碘物质快速充分溶解
(2)2H++2I-+H2O2══I2+2H2O
(3)紫红 分液漏斗
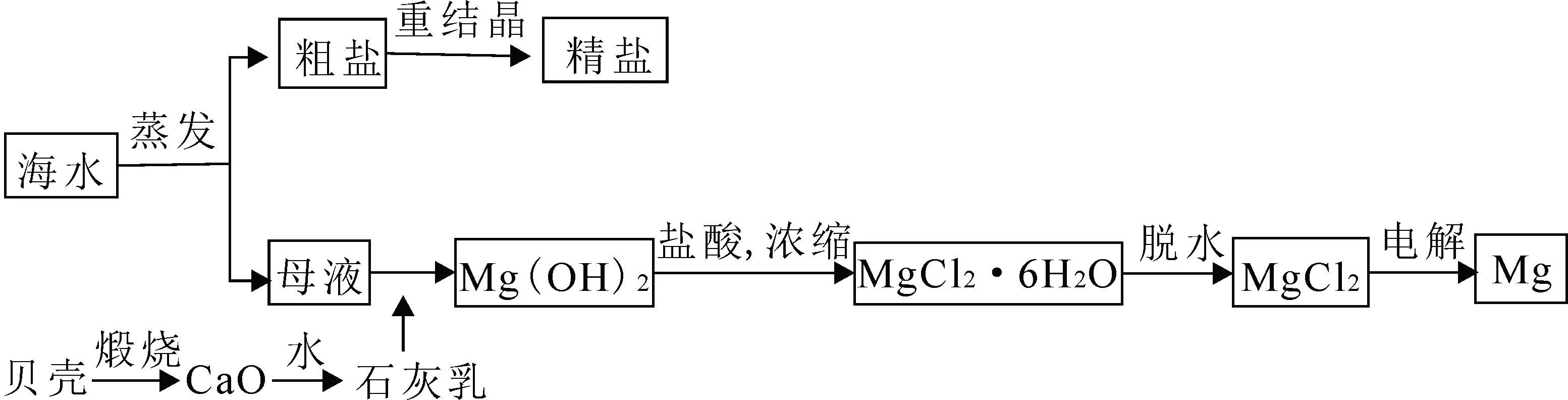
四、镁的提取
自然界中的镁主要以化合态的形式存在于地壳和海水中。海水中镁的总储量约为1.8×1015t,含量约为1.28g·L-1。目前,世界上生产的镁有60%来自海水。海水中镁的含量较大,但镁离子的浓度很低,因此我们需先将海水浓缩,利用晒盐的母液作为原料制取镁,工艺流程如下。
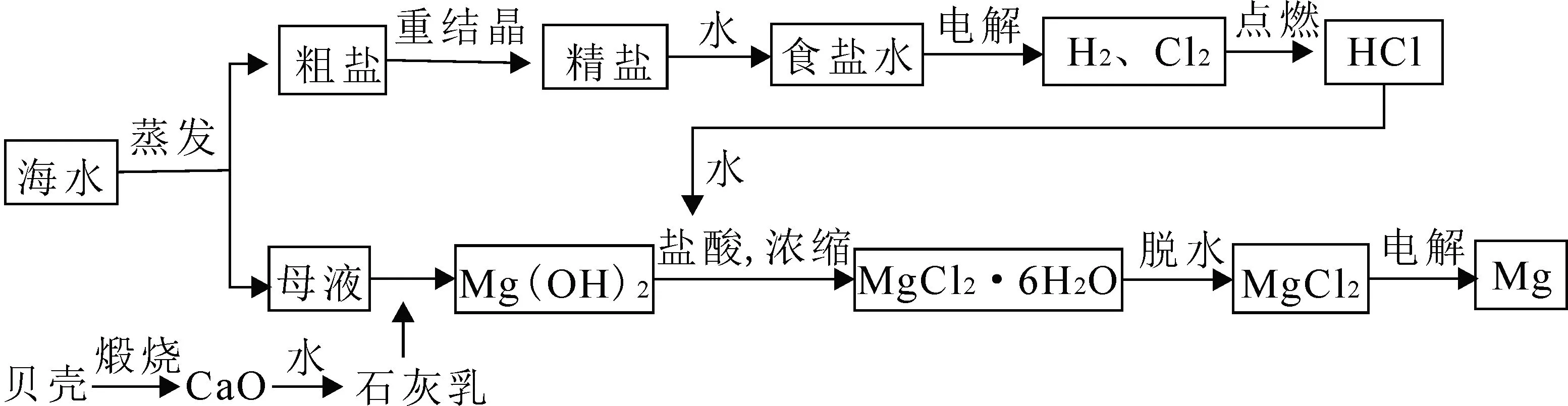
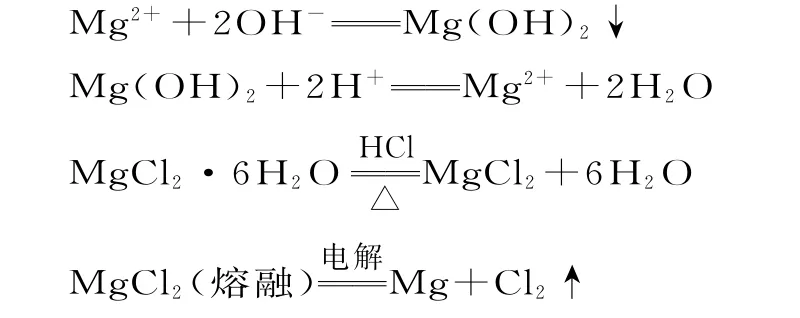
利用贝壳煅烧后制得的石灰乳作沉淀剂,使母液中的Mg2+沉淀为Mg(OH)2。接着利用盐酸与Mg(OH)2反应并浓缩、结晶后得到MgCl2·6H2O,MgCl2·6H2O 在氯化氢气流中加热脱水后得到MgCl2。最后通过电解熔融MgCl2得到金属镁。流程中涉及反应的方程式有:
例4 海水的综合利用可以制备金属镁,其流程如下。

(1)根据题给信息及质量守恒定律,MgCl2·6H2O 分解,除生成MgO 外,还应有氯化氢和水。而在干燥的HCl气流中,MgCl2·6H2O 分解得到无水氯化镁。(2)除去杂质的最好方法是把杂质转化为主体成分,因此可加入MgCl2溶液。(3)考查的是玻璃棒的作用。
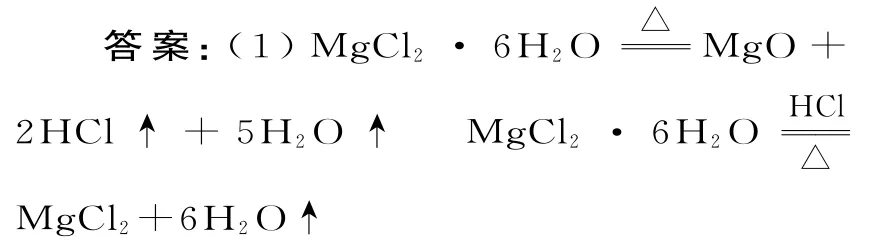
(2)加入MgCl2溶液,充分搅拌,过滤,洗涤
(3)搅拌,加速溶解 使待滤液体沿玻璃棒流入漏斗,防止外洒 搅拌,防止因局部过热使液滴或晶体飞溅
海洋中蕴藏着丰富的生物资源,不仅是人类食物的重要来源,还是重要的医药原料和工业原料。海洋中还蕴藏着丰富的矿产资源:石油、天然气、煤、硫、磷等。海洋的潮汐中蕴藏着巨大的能量,可用来发电。总之,海洋是一个丰富的宝库,爱护海洋环境是我们每一个人的义务。

