微生物固态发酵工艺对红薯淀粉渣真蛋白含量的影响
■王 妍 郑猛虎 崔欣雨 韦子海 吴冠中 徐春城*
(1.中国农业大学工学院,北京 100083;2.宁波宁兴涌优饲料有限公司,浙江 宁波 315311)
红薯是世界上的主要粮食作物之一,红薯淀粉渣(以下简称红薯渣)为红薯淀粉加工业的主要副产物。由于红薯渣含有单宁、胰蛋白酶抑制剂等多种抗营养因子,不适合直接饲喂动物。且红薯渣含水量极高,不便储存和运输,大量废弃红薯渣的堆积,极易发生腐败,造成环境的污染以及资源的浪费等问题[1]。如果能对其进行合理利用,不仅具有良好的经济与社会效益,因生产淀粉产生的环境污染问题也可以得到有效解决。
红薯渣富含水分、淀粉、纤维素等物质[2],从而可以作为许多微生物产品的发酵基质。许多学者利用红薯渣发酵生产乳酸[3]、柠檬酸[4]、酶制剂[5]、青贮饲料[6]、微生物蛋白饲料[7]等。其中,发酵红薯渣生产蛋白饲料不仅具有成本较低、工艺简单的优点,还可以缓解我国畜牧业高蛋白饲料短缺的压力。欧荣娣等[7]以红薯渣为原料,采用固态混菌二次发酵工艺生产菌体蛋白饲料,一阶段厌氧发酵,二阶段好氧发酵,产物粗蛋白含量达到了15.11%,较对照组提高了45.33%。Zhao 等[8]研究了多种微生物对红薯渣固态发酵的影响,通过复合微生物发酵使其粗蛋白含量从6.37%提高到9.75%。Zuo 等[9]利用米曲霉和枯草芽孢杆菌复合发酵红薯饮料渣,使发酵产物真蛋白含量达到15.58%。但目前为止,这些研究大都是以粗蛋白含量作为指标,由于在发酵底物中添加了尿素等无机氮作为氮源,所以粗蛋白含量的增加是必然的,并不能准确反映发酵后产物真蛋白含量的实际变化。本试验以红薯渣为研究对象,通过单因素试验分析微生物种类、微生物组合、接种比例以及接种量对红薯渣发酵产物真蛋白含量的影响,利用响应面法优化发酵条件。旨在充分利用农业食品业副产品资源,同时缓解我国高蛋白饲料的压力,为微生物复合发酵红薯渣提高真蛋白含量提供有效方法。
1 材料与方法
1.1 试验原料
红薯渣:由浙江省宁波宁兴涌优饲料有限公司提供,水分含量73.2%,真蛋白含量2.02%。
麸皮:市售麸皮,水分含量10.0%,真蛋白含量10.32%。
尿素、(NH4)2SO4、K2HPO4、MgSO4、MnSO4:北京化工厂生产的化学纯试剂。
1.2 菌种
黑曲霉(Aspergillus nigerCGMCC 3.01858)、米曲霉(Aspergillus oryazeKU320673)、里氏木霉(Trichoder⁃ma reeseiCGMCC 3.3711)、康宁木霉(Trichoderma kon⁃ingiiCGMCC 3.11416)、黄孢原毛平革菌(Phanero⁃chaete chrysosporiumCGMCC 5.829)、糙皮侧耳(Pleuro⁃tus ostreatusCGMCC 5.374)、槭射脉革菌(Phlebia aceri⁃naCGMCC 5.927)、白囊耙齿菌(Irpex lacteusCGMCC 5.809)、枯草芽孢杆菌(Bacillus subtilisKU 239979)、地衣芽孢杆菌(Bacillus licheniformisMN 658807)、巨大芽孢杆菌(Bacillus megateriumCGMCC 1.7993)、酿酒酵母(Saccharomyces cerevisiae KC 881067)、产朊假丝酵母(Candida utilisCGMCC 2.1012)、库德里阿兹威氏毕赤酵母(Picha kudriavzeviiMK 592835)均为中国农业大学工学院饲料调制与加工实验室购买或保藏菌株。
1.3 种子液的制备
1.3.1 霉菌种子液
4 ℃斜面保存的霉菌接种于PDA培养基(Nissui,日本)上活化,28 ℃培养5~7 d 以获得高密度的分生孢子,用0.9%生理盐水温和洗涤,从培养基中收集孢子,经血球计数板计数使孢子浓度为107CFU/mL。孢子悬浮液置于4 ℃冰箱保存备用。
1.3.2 白腐真菌琼脂块
4 ℃斜面保存的白腐菌用接种铲取一小块长满菌丝的培养基(约3 mm×3 mm),将其转接到PDA 培养基上活化,置于28 ℃的霉菌培养箱中培养10 d,待菌丝长满平板后,置于4 ℃冰箱中保存备用。
1.3.3 芽孢杆菌种子液
4 ℃斜面保存的芽孢杆菌接种于NB培养基(奥博星生物技术有限公司,北京)上活化,30 ℃、150 r/min条件下培养24 h,作为一级培养种子;再将一级种子液接种于NB培养基于30 ℃、150 r/min条件下振荡培养24 h,使其浓度为107CFU/mL 作为二级种子培养液。置于4 ℃冰箱备用。
1.3.4 酵母菌种子液
4 ℃斜面保存的酵母菌接种于PDB培养基(奥博星生物技术有限公司,北京)上活化,30 ℃、150 r/min条件下培养24 h,作为一级培养种子;再将一级种子液接种于PDB 培养基于30 ℃、150 r/min 条件下振荡培养24 h,使其浓度为107CFU/mL 作为二级种子培养液,置于4 ℃冰箱备用。
1.4 固态发酵
固态发酵在250 mL 锥形瓶中进行。培养基组成(干物质)为:16 g 红薯渣、4 g 麸皮、0.3 g 尿素、0.3 g(NH4)2SO4、0.12 g K2HPO4、0.01 g MgSO4、0.02 g MnSO4。在121 ℃下高压蒸汽灭菌30 min。按照试验具体设计在超净工作台接入菌种,用无菌水调节水分至60%,并用无菌玻璃棒混匀,用封口膜密封,在28 ℃、75%湿度的霉菌培养箱中发酵72 h。发酵结束后,将发酵产物置于65 ℃鼓风干燥箱烘干48 h,粉碎过1 mm 筛,用于后续成分测定。每个处理设置3 个平行。
1.5 单因素试验
1.5.1 单菌筛选
利用1.2节中的14株菌对红薯渣进行单菌发酵,接种量为1×106CFU/g DM。测定发酵产物真蛋白含量。
1.5.2 菌种组合筛选
利用1.5.1 节中筛选出的菌株,对红薯渣进行菌种复合发酵,每种组合为等比例接种,总接种量为1×106CFU/g DM。测定发酵产物真蛋白含量。
1.5.3 接种比例优化
利用1.5.2节中筛选的菌株组合,设计不同接种比例对红薯渣进行发酵,总接种量为1×106CFU/g DM。测定发酵产物真蛋白含量。
1.5.4 接种量优化
按照筛选出的菌种组合及比例,设计不同接种量,对红薯渣进行发酵,测定发酵产物真蛋白含量。
1.6 响应面法优化发酵条件
利用Design Expert 10.0 设计三因素三水平的响应面试验方案,确定发酵温度、初始含水量、发酵时间三者的最佳组合,优化发酵产物真蛋白含量。变量定义为发酵温度(X1,℃)、初始含水量(X2,%)和发酵时间(X3,h),响应变量为真蛋白含量(Y,%)。试验数据根据以下二阶多项式方程进行回归:
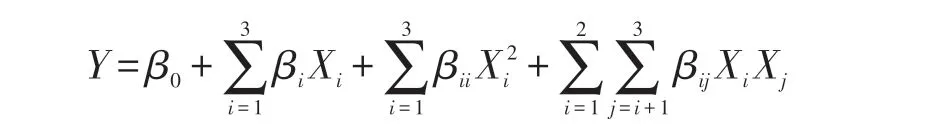
式中:β0——设计中心点(0,0,0)的拟合响应值,为常数;
βi——线性值;
βii——二次项;
βij——叉积回归项。
1.7 真蛋白的测定
称取10 g 三氯乙酸溶于500 mL 烧杯中,搅拌均匀后转入1 L容量瓶中定容,后转入带盖广口瓶,制得三氯乙酸溶液,并置于4 ℃冰箱备用。准确称取0.5 g粉碎后样品置于125 mL 锥形瓶中,加入50 mL 预冷的纯化水放置30 min,再加入10 mL配好的三氯乙酸溶液放置30 min。采用定量滤纸重力过滤,用三氯乙酸溶液冲洗2次,用预冷的纯化水冲洗2次。65 ℃将滤纸烘干,再将滤纸和残渣转入消化管,用凯式定氮法测定氮含量,以滤纸作为空白对照。
1.8 统计分析
所有数据均以3个平行的平均值表示。数据使用Excel 2019进行处理后,使用IBM SPSS Statistics 21.0进行单因素方差分析,并用Duncan’s法进行多重比较,显著性水平设置为P<0.05。使用Design Expert 13.0软件建立真蛋白含量的响应面模型,并进行方差分析。
2 结果与分析
2.1 单菌发酵
14株菌单独固态发酵红薯渣的结果见表1。未发酵的培养基的真蛋白含量为3.68%,作为对照组。4种霉菌发酵产物的真蛋白含量均显著高于对照组(P<0.05),且米曲霉的发酵产物的真蛋白含量最高。4种白腐真菌和3种芽孢杆菌的发酵产物的真蛋白含量与对照组没有显著性差异(P>0.05)。酵母菌中,产朊假丝酵母发酵产物的真蛋白含量显著高于对照组(P<0.05)。

表1 单菌发酵结果(%)
2.2 菌株组合筛选
根据单菌发酵的结果,挑选黑曲霉、米曲霉、里氏木霉、巨大芽孢杆菌、毕赤酵母、产朊假丝酵母设计了9 种不同的菌种组合,发酵结果见表2。所有复合菌种发酵组的真蛋白含量均显著高于对照组(P<0.05),其中,以米曲霉、巨大芽孢杆菌、毕赤酵母为组合的发酵产物真蛋白含量最高,达到8.81%。

表2 复合菌发酵结果(%)
2.3 接种比例
以米曲霉、巨大芽孢杆菌、毕赤酵母为组合,以不同的接种比例对红薯渣进行发酵,结果见表3。所有处理组的发酵产物真蛋白含量均显著高于对照组(P<0.05)。其中,当米曲霉∶巨大芽孢杆菌∶毕赤酵母为3∶2∶1时,真蛋白含量最高,达到9.62%。
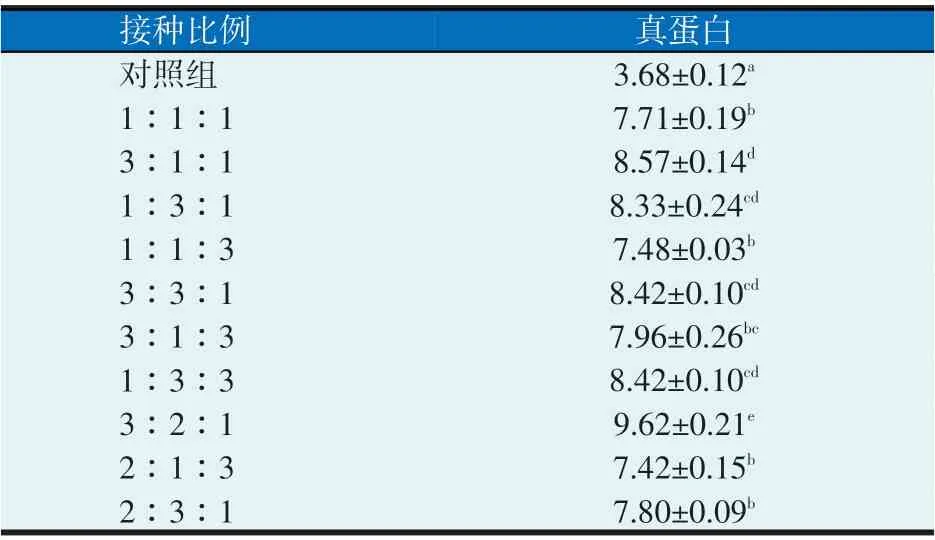
表3 不同接种比例发酵结果(%)
2.4 接种量
固定菌种的比例为米曲霉∶巨大芽孢杆菌∶毕赤酵母为3∶2∶1,以不同接种量对红薯渣进行发酵,结果见表4。所有处理组的真蛋白含量均显著高于对照组(P<0.05)。随着接种量的增加,真蛋白含量呈先升高后降低的趋势。其中,以接种量为1×106CFU/g DM时效果最佳,真蛋白含量为9.62%。

表4 不同接种量发酵结果(%)
2.5 基于响应面法优化发酵条件
以Design Expert 软件设计出的三因素三水平中心组合试验见表5,共20 组试验,其中包括6 个中心点。自变量的值表示为编码值和实际值。方差分析结果见表6,通过ANOVA 分析,该模型的F值为27.57,表明模型是极显著的(P<0.000 1)。失拟项不显著(P>0.05)。R2、R和R分别为0.961 3、0.926 4和0.846 8,均接近于1,表明试验值与预测值之间具有良好的相关性。对试验数据进行多元回归分析得出回归方程。

表5 中心组合试验设计与结果

表6 方差分析表
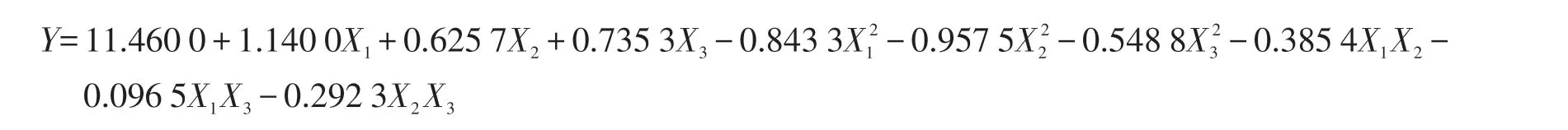
根据F检验,发酵温度、初始含水量和发酵时间的线性项和二次项均极显著(P<0.01),说明这3 个因素及他们的平方项均对响应变量有显著影响。发酵温度和初始含水量之间的交互作用显著(P<0.05),其他的交互项没有显著影响(P>0.05)。两两之间对真蛋白含量的交互作用的等高线图和响应曲面如图1~图3 所示。发酵温度和含水量之间有一定的交互效应,表现为曲线有一定坡度;温度和时间、含水量和时间的交互作用较小,曲线较为平滑,响应值变化较小,图形结果与模型分析结果相吻合。
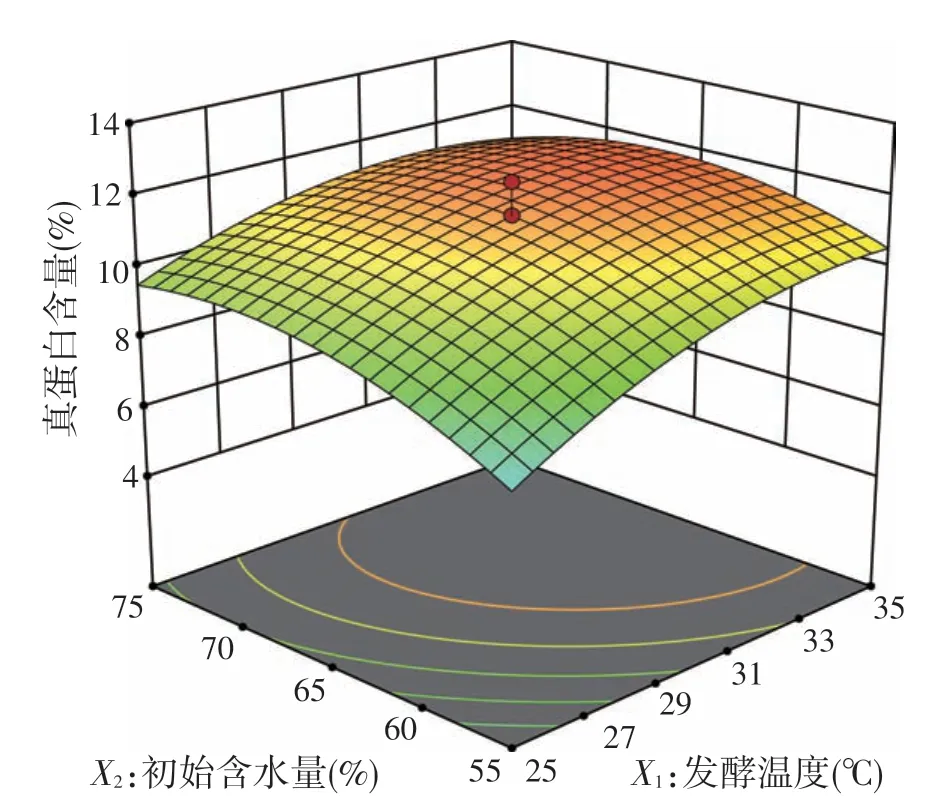
图1 发酵温度和初始含水量对真蛋白含量的影响
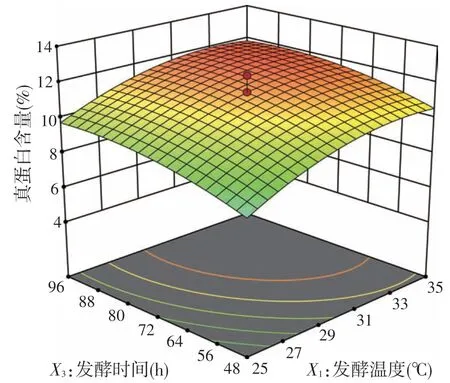
图2 发酵温度和发酵时间对真蛋白含量的影响
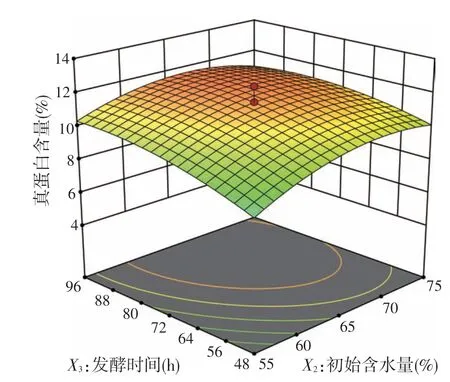
图3 初始含水量和发酵时间对真蛋白含量的影响
2.6 验证试验
为了进一步验证模型的可靠性,进行验证试验。Design Expert 软件模拟的最佳发酵条件为:发酵温度33.10 ℃、初始含水量66.12%、发酵时间86.04 h,预测此条件下的真蛋白含量为12.06%。选择发酵温度33 ℃、初始含水量66%、发酵时间86 h 条件验证,真蛋白含量为12.11%,接近模型的最优预测值。
3 讨论
3.1 菌种筛选
不同种类的微生物对红薯渣固态发酵有着不同的效果。霉菌发酵产物的真蛋白含量显著高于其他类型的微生物,表明霉菌发酵有利于发酵中真蛋白含量的增加。白腐真菌没有产生类似的效果,可能是由于发酵时间短,白腐真菌还未能在发酵基质上完全生长[10]。Zuo 等[9]使用不同种类的微生物发酵红薯饮料渣,米曲霉发酵产物的真蛋白含量从6.49%增加到13.78%,本试验的结果与其基本一致。
本试验筛选的菌种组合为米曲霉、巨大芽孢杆菌、毕赤酵母,且以3∶2∶1的比例接种1×106CFU/g DM时效果最佳,该结果与前人的研究相似。Ding等[11]使用枯草芽孢杆菌、黑曲霉和酿酒酵母的混合菌株对茶渣进行固态发酵,粗蛋白含量显著增加。Lei 等[12]使用白地霉、扣囊腹膜酵母和热带假丝酵母对马铃薯淀粉渣进行发酵,发酵终产物的真蛋白质含量为20.96%,达到马铃薯淀粉渣原料的3 倍以上。Shi 等[13]研究了黑曲霉、假丝酵母和枯草芽孢杆菌对鼓槌树叶的固态发酵,结果表明发酵后粗蛋白、小肽和氨基酸的浓度明显增加。许多研究都表明,与单菌发酵相比,混合菌株发酵对固态发酵有着更好的效果。因为微生物共同培养时,会对代谢途径产生潜在的协同作用。霉菌和芽孢杆菌酶系统发达[14],酵母菌含有蛋白质、维生素、氨基酸等营养成分[15],且可以利用小分子糖类物质生成蛋白,这或许是复合发酵更能产生高蛋白含量的原因。合适的菌种比例可以使微生物将协同作用发挥得更好。合适的接种量也是发酵过程中的一个重要因子,接种量过少,微生物不能发挥效果;接种量过多,微生物会竞争有限的生长底物。
3.2 发酵条件优化
中心组合试验等响应面法是近年来使用较多的试验优化方法,它能通过多变量试验来模拟真实极限状态面。本试验采用三因素三水平中心组合试验对发酵温度、初始含水量和发酵时间进行了优化。方差分析结果表明该模型是合理的。等高线图和三维响应面图解释了真蛋白含量与所涉及的3 个变量之间的关系,它们可以直观反映各因素之间的交互作用对响应值的影响程度,等密度线越密,曲面越陡,影响越显著[16]。本试验中发酵温度和初始含水量之间有一定的交互效应,表现为P<0.05,曲线有一定坡度,说明发酵温度和初始含水量对红薯渣固态发酵产物真蛋白含量有潜在影响。对软件分析的最优条件的多次验证试验具有稳定性,这表明模型具有良好的可靠性和重现性。
4 结论
米曲霉、巨大芽孢杆菌和毕赤酵母以3∶2∶1的比例接种1×106CFU/g DM 时可以提高红薯渣发酵后的真蛋白含量。响应面法优化的发酵条件为发酵温度33 ℃、初始含水量66%、发酵时间86 h。此条件下发酵产物的真蛋白含量最高,为12.11%,约为未发酵底物的3倍。因此,复合微生物固态发酵红薯渣可作为提高真蛋白含量的有效生产工艺。

