新辅助化疗所致预后营养指数降低预示乳腺癌患者预后不良:一项单中心回顾性队列研究
梁丽红 王维 杨芳
近年来,尽管乳腺癌的手术、化疗、分子靶向治疗和内分泌治疗等治疗手段不断发展,但乳腺癌仍是女性癌症死亡的主要原因,其中复发是制约患者预后的重要因素[1]。越来越多证据表明,营养状况可影响癌症患者的疗效及生存状况[2]。预后营养指数(prognostic nutritional index,PNI)由血清白蛋白水平和外周血淋巴细胞计数通过简单公式计算得出,是评估营养状况最常用的指标之一[3]。已有研究报道,术前低PNI是恶性肿瘤患者术后并发症发生的危险因素,在胃癌、结直肠癌、肺癌、胰腺癌和肾细胞癌等多种恶性肿瘤中提示预后不良[4-9]。然而,目前探索PNI与乳腺癌预后关系的研究有限[10-11]。
新辅助化疗(neoadjuvant chemotherapy,NAC)广泛用于局部晚期乳腺癌患者的治疗。有研究显示,接受NAC的患者预后并不亚于术后化疗患者[12]。此外,NAC还能提供重要的预后信息,如病理完全缓解率(pCR)[13]。但是,化疗可因其胃肠道不良反应包括厌食、恶心、呕吐、口腔炎和腹泻等导致营养不良[14]。MIGITA等[15]报道胃癌患者在NAC期间PNI降低与较差预后有关。然而,目前PNI变化对接受NAC的乳腺癌患者术后预后的影响尚不明确。因此,本研究旨在评估PNI变化对乳腺癌患者预后的影响。
1 资料与方法
1.1 研究对象
本研究为一项单中心回顾性队列研究。选择2008年1月至2017年12月在本院接受NAC和乳腺癌根治术的乳腺癌患者为研究对象,随访截至2020年12月。纳入标准:⑴全血化验结果和病理资料完整;⑵经病理明确诊断。排除标准:⑴导管原位癌;⑵远处转移;⑶双侧乳腺癌或炎性乳腺癌;⑷合并严重的炎症性疾病或并发症。本研究经本院伦理委员会审核批准。
1.2 数据收集及定义
通过本院电子病历系统收集患者数据。临床资料包括年龄、性别、诊断时的临床分期、组织学类型、组织学分级(HG)、雌激素受体(ER)、孕激素受体(PgR)、HER-2状态、NAC方案、手术方案、对NAC的病理反应和是否复发等。营养参数包括PNI、血清白蛋白水平(ALB)、NLR 和体质指数(BMI)等。于采集血样当天测量患者体重和身高;接受NAC前1周测量PNI(pre-PNI),末次NAC结束后4周以上再次测量PNI(post-PNI)。PNI=ALB(g/L)+5×淋巴细胞计数(109/L);NLR=中性粒细胞计数/淋巴细胞计数;BMI(kg/m2)=体重/身高2。ΔPNI、ΔALB、ΔNLR 和 ΔBMI分别为NAC前的对应值减去NAC后的对应值。无病生存期定义为从手术到局部复发或远处转移的时间(月)。
1.3 治疗方法
本研究患者共采用两种NAC方案:⑴基于蒽环类药物的方案(AC方案),包括EC方案(60~75 mg/m2表柔比星和600 mg/m2环磷酰胺)或FEC方案(500 mg/m2氟尿嘧啶,75~100 mg/m2表柔比星和500 mg/m2环磷酰胺),每3周给药1次。⑵紫杉烷方案,包括多西他赛(DOC)75 mg/m2,每3周给药1次;以及紫杉醇(PTX)80 mg/m2,每周给药1次。大多数接受4个周期AC方案的患者随后又接受了4个周期的DOC或PTX方案治疗。在接受紫杉烷方案的HER-2阳性患者中,同时给予曲妥珠单抗6 mg/kg(每3周1次)或2 mg/kg(每周1次)。
所有患者接受NAC后4~7周内行乳腺癌根治术,均行腋窝淋巴结清扫术。术中评估NAC疗效,pCR定义为无论腋窝淋巴结状态如何,在乳腺组织中无残留浸润性癌组织。
1.4 术后辅助曲妥珠单抗、内分泌和放射治疗
术后HER2阳性乳腺癌患者给予曲妥珠单抗(最初为 8 mg/kg,随后为 6 mg/kg),每3周1次,持续12个月。接受保乳手术的患者行全乳照射,剂量为50~60 Gy,术后病理检查有3个以上淋巴结转移的患者行胸壁及区域淋巴结照射,剂量为50~60 Gy。ER或PgR阳性的绝经患者接受芳香酶抑制剂治疗,绝经前患者接受他莫昔芬或他莫昔芬与促黄体激素释放激素激动剂治疗。
1.5 统计学方法
采用R 3.5.1软件进行数据分析。计量资料以均数±标准差表示,组间比较采用独立样本t检验;分类数据以n(%)表示,组间比较采用χ2检验或Fisher精确概率;Kaplan-Meier法计算累积生存率,生存曲线比较采用log-rank检验。采用时间依赖的受试者工作特征(ROC)曲线计算ΔPNI、ΔALB、ΔNLR 和 ΔBMI的截断值,因变量为第3年生存状态。采用Cox比例风险回归分析影响无病生存期的因素,计算风险比(HR)及其对应的95%可信区间(CI),以双侧P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
2008年—2017年在本院电子病历系统共筛选到357例接受NAC和乳腺癌根治术的乳腺癌患者,根据纳入排除标准排除226例后,最终纳入131例进行分析。131例患者的平均年龄为(50.9±10.8)岁,其余资料见表1。

表1 患者的临床病例资料*Tab.1 Clinicopathologic characteristics in patients*
采用时间依赖的ROC曲线以3年生存状态为因变量计算ΔPNI、ΔALB、ΔNLR 和 ΔBMI的截断值,分别为5.26、0.34、-0.17、-0.26,见图1。根据其截断值,分别将患者分为高、低两组。高ΔPNI组和低ΔPNI组的一般资料比较见表1。NAC后PNI较NAC前降低(46.4±4.5vs52.5±4.2,P<0.001),见图2。

图1 时间依赖的ROC曲线计算ΔPNI、ΔALB、ΔNLR和ΔBMI的截断值(3年)Fig.1 The cut-off values of ΔPNI,ΔALB,ΔNLR and ΔBMI calculated by time-dependent ROC curve(3 years)

图2 NAC前、后PNI的分布Fig.2 Distribution of PNI before and after NAC
2.2 ΔPNI与无病生存期的关系
术后中位随访时间为52个月(范围:1~147个月),26例(19.8%)患者出现复发。高ΔPNI组的中位无病生存率明显低于低 ΔPNI组(P<0.001),见图3和表2。但未发现ΔALB、ΔNLR和ΔBMI与无病生存期有关联(均P>0.05),见表2。

图3 高ΔPNI和低ΔPNI组患者的无病生存曲线Fig.3 Disease-free survival curves of patients with high and low ΔPNI

表2 NAC前后营养参数变化与无病生存期的关联Fig.2 Association between changes of nutrition parameters and disease-free survival before and after NAC
2.3 影响无病生存期的因素
单因素Cox比例风险回归显示,ΔPNI、NAC前的临床分期、HER-2与无病生存期有关(均P<0.05)。进一步多因素Cox比例风险回归显示,ΔPNI、NAC前的临床分期、HER-2均是无病生存期的独立影响因素(均P<0.05),见表3。
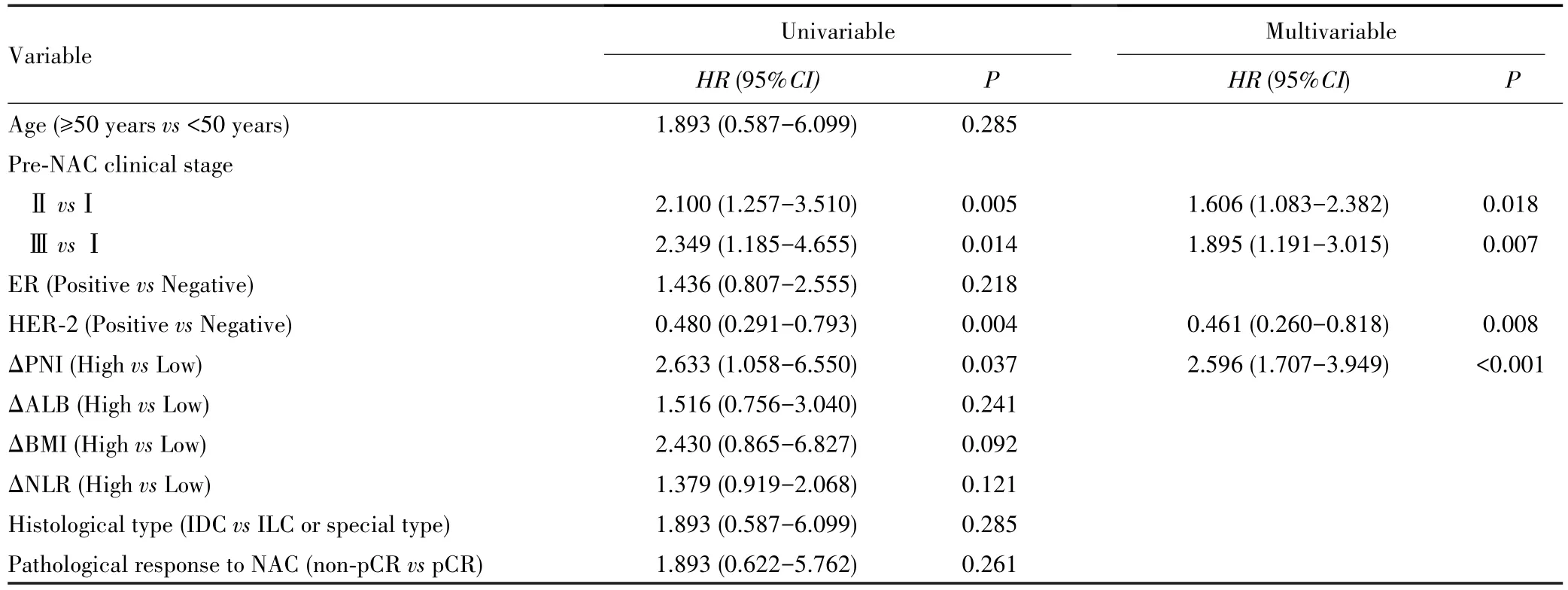
表3 影响无病生存期的单因素和多因素Cox比例风险回归分析结果Tab.3 Univariable and multivariable Cox proportional hazards regression analyses for influencing disease-free survival
3 讨论
越来越多的证据表明,术前高PNI在多种实体肿瘤中预示着更少术后并发症和更好的预后[4-9]。同时,术前高ALB水平和低NLR在多种癌症中提示预后良好[16-18]。BMI也是乳腺癌的预后因子[19],且与患者的营养状况相关[20]。以上4个因素(即 PNI、血清ALB、NLR和BMI)容易计算且从临床记录或体检中易获得。因此,本研究中使用这4个因素作为营养参数。
本研究在高ΔPNI组和低ΔPNI组的临床病理特征比较中,发现高ΔPNI组接受含DOC方案的患者比例高于低ΔPNI组。然而,3种NAC方案(仅AC,AC后使用PTX和/或曲妥珠单抗,AC后使用DOC和/或曲妥珠单抗)与无病生存期无统计学关联,表明在不同ΔPNI分组中无病生存率的差异不取决于化疗方案的类型。对于高ΔPNI组中接受含DOC方案的患者数量较多原因之一是与PTX相比,DOC方案的胃肠道不良反应更强[21-22]。此外,接受DOC方案治疗的患者可能会出现外周水肿[21,23],这可能与低白蛋白血症有关。最终,本研究发现高ΔPNI组的无病生存率明显低于低ΔPNI组,且多因素Cox回归显示,ΔPNI是无病生存期的独立影响因素。而发现ΔALB、ΔNLR和ΔBMI与无病生存期无关联,提示ΔPNI用于预测患者的预后更有价值。
从免疫的角度来看,免疫状况良好可提高癌症的生存率。营养不良已被证明与癌症进展有关,因其与弱免疫反应有关[24-25]。因此,在乳腺癌的各种抗肿瘤治疗过程中,免疫反应亦被证明与更好的预后相关[26]。以上研究结果支持在NAC期间维持PNI可能有益于预防乳腺癌患者的不良预后。本研究易获得一致的结果,表明在NAC期间提供营养支持可通过维持营养状况来改善患者的预后。根据本研究结果,营养干预可进一步应用于新辅助治疗中。
本研究存在几个局限性问题需要注意。首先,本研究为单中心回顾性研究,且样本量较小。除了乳腺癌的异质性,较小的样本量可能会降低统计效能。其次,NAC方案因患者而异,不同的治疗方案发生变化时,结果可能会存在偏倚。因此,需要进一步开展前瞻性大样本研究来验证本研究的结果。
综上所述,本研究发现PNI降低可预测乳腺癌患者NAC后预后不良,因此NAC期间监测营养状况具有重要意义。

