CalliSpheres载药微球经肝动脉化疗栓塞治疗全身化疗失败的不可切除结直肠癌肝转移的疗效及预后因素分析
刘松 于广计 王庆东
对于不可切除的结直肠癌肝转移,基于氟尿嘧啶类联合奥沙利铂或伊立替康的化疗或化疗联合靶向治疗(单克隆抗体)的标准治疗方案可有效延长生存期和改善生活质量[1]。然而,该类患者大多在全身治疗中出现疾病进展或不可耐受的毒性,需要接受二线甚至三线治疗,因此这一群体也成为临床上治疗的难点。经导管肝动脉化疗栓塞术(transcatheter chemoembolization,TACE)是非手术治疗肝癌有效的治疗方法,应用载药微球可以提高肿瘤反应率。目前DEB-TACE治疗在不可切除结直肠癌肝转移治疗中展现了良好的应用前景。已有研究报道,载药微球TACE(drug-eluting bead transarterial chemoembolization,DEB-TACE)较传统 TACE(conventional transarterial chemoembolization,c-TACE)可以获得更好的肿瘤缓解率(68.0%vs39.3%)[2]。一项纳入13项研究包含850例不可切除结直肠癌肝转移患者的Meta分析显示[3],DEB-TACE治疗后患者肿瘤缓解率为51.1%,总生存期(overall survival,OS)达16.8个月。但目前国内尚未见DEB-TACE用于治疗全身化疗失败的不可切除结直肠癌肝转移的研究报道。本研究旨在探讨DEBTACE治疗全身化疗失败的不可切除结直肠癌肝转移的安全性和有效性。
1 资料与方法
1.1 研究对象
收集2018年6月—2020年6月本院收治并行DEBTACE治疗的结直肠癌肝转移患者42例。所有患者接受TACE前均经多学科综合诊疗团队(MDT)评估,明确为不可手术切除、二线及以上全身化疗失败的结直肠癌肝转移患者。纳入标准:⑴经肝脏穿刺病理活检证实为结直肠癌肝转移;⑵年龄≥18岁;⑶美国东部肿瘤协作组(ECOG)体能评分0~2分;⑷肝功能Child-Pugh分级A级或B级,心肺肾功能正常,无治疗禁忌证;⑸预计生存期3个月以上。排除标准:⑴合并其他重要脏器严重功能障碍;⑵不能有效控制肝外转移病灶,如肺、骨、脑等部位转移。本研究经本院伦理委员会批准,患者在治疗前均签署知情同意书。
1.2 DEB-TACE治疗方法
CalliSpheres载药微球制备:选择100~300 μm规格的CalliSpheres载药微球(1 g/瓶,苏州恒瑞迦俐生生物医药科技有限公司,国械注准20153771072),用20 mL注射器抽出后竖立放置5 min,直至微球完全沉降,然后将上清液推出。伊立替康160~200 mg溶解后与载药微球充分混合,每5 min摇匀1次,共30 min,再静置5 min,排出上清液后,按1∶1与非离子型对比剂碘克沙醇混匀(约10 mL)。
采用Seldinger法穿刺右侧股动脉,引入5F-RH导管常规行腹腔干动脉造影,观察肿瘤部位、大小、多少及肿瘤染色情况,辅助膈动脉、肠系膜上动脉、胃左动脉、右肾动脉等造影排除异位供瘤动脉。对于可以超选择者,采用微导管分别超选择后缓慢推注配置好的载药微球直至血流停滞;对于弥漫多发不能超选择者,将导管头端置于肝固有动脉,避开胆囊动脉后,采用小量(每次约0.5 mL)脉冲式注射载药微球,当血流减慢立即停止栓塞,然后行造影进一步评估肿瘤染色情况,栓塞终点为肿瘤染色消失,肝动脉分支呈枯树枝状。若造影后评估一支载药微球不能达到栓塞终点,则在载药微球加载药物后用适量等规格空白微球与之充分混合制成混合微球后再行栓塞,直至达到栓塞终点。
1.3 疗效评价
术后5~7d复查上腹部强化CT/MRI,之后每1~2个月行1次上腹部增强CT/MRI检查,观察病灶大小、坏死程度及有无新发病灶。依据影像学结果并参照修订后的实体瘤疗效评价标准(mRECIST)进行近期疗效评价,完全缓解(complete response,CR):CT或MRI显示所有目标病灶动脉期强化消失;部分缓解(partial respense,PR):目标病灶(动脉期强化显影)直径总和减少≥30%;疾病进展(progressive disease,PD):目标病灶(动脉期强化显影)直径总和增加≥20%,或出现新病灶;疾病稳定(stable disease,SD):目标病灶(动脉期强化显影)直径总和减少未达到PR或增加未达到PD。客观缓解率(objective response rate,ORR)定义为达到CR及PR患者的比例;疾病控制率(disease control rate,DCR)定义为达到CR、PR和SD患者的比例。重点观察肿瘤具有活性的范围,综合评估介入治疗效果及确定是否再次接受介入治疗。如患者达CR则进入临床随访;如为PR或SD或1次治疗内为PD,则给予重复治疗,重复治疗前确保肝功能恢复到基线水平;对于接受过2次DEB-TACE后仍为PD的患者,不再接受DEB-TACE治疗。记录无进展生存期(progression-free survival,PFS)和OS,OS定义为首次介入治疗开始到患者死亡或末次随访的时间。PFS定义为首次介入治疗开始到患者疾病进展或死亡的时间。按照美国国立癌症研究所常见不良反应分级标准(CTCAE)3.0版评估不良反应,分为0~4级。
1.4 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以均数±标准差()描述,分类资料以例数(百分比)描述。采用Kaplan-Meier法计算累积生存率并绘制生存曲线。采用Cox比例风险回归分析影响OS的因素。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 基线资料
纳入本研究的42例患者中男性25例,女性17例;平均年龄(60.50±11.20)岁(范围:43~77岁);接受介入治疗平均次数为(2.18±0.60)次(范围:1~4次),其余资料见表1。

表1 42例结直肠癌肝转移患者的临床特征[n(%)]Tab.1 Cinical characteristics of 42 patients with liver metastasis from colorectal cancer[n(%)]
2.2 近期疗效
42例患者接受DEB-TACE术后5~7d复查CT/MRI,可见肿瘤明显坏死,无强化或残留部分轻度强化。mRECIST评价近期疗效,术后2、4、6个月的ORR分别为 83.3%、81.0%、71.4%;DCR分别为 100.0%、90.5%,80.9%。见表2。

表2 42例结直肠癌肝转移患者DEB-TACE术后的近期疗效[n(%)]Tab.2 Short-term efficacy of DEB-TACE in 42 patients with liver metastases from colorectal cancer[n(%)]
2.3 生存情况
随访截至2021年6月,中位随访15个月(范围:9~30个月),无失访病例,存活12例,死亡30例,其中因肿瘤进展死亡28例,因晚期肿瘤并发症死亡2例(1例为消化道大出血,1例为肝功能衰竭)。中位PFS为11.0个月(95%CI:9.6~12.3个月),6个月和12个月的无进展生存率分别为81.1%、32.0%。中位OS为16.0个月(95%CI:13.0~18.9个月),1年和2年总生存率分别为79.8%、30.1%。见图1。

图1 42例结直肠癌肝转移患者的生存曲线Fig.1 Survival curves of 42 patients with liver metastasis from colorectal cancer
2.4 不良反应
42例患者治疗期间不良反应均为1~2级,未见3~4级不良反应,主要包括发热、疼痛、恶心呕吐、乏力及肝功能损害等。所有患者均有不同程度的发热(37.0~38.0℃),大部分患者在3~7 d内逐步缓解。1例患者出现轻型胆囊炎,1例患者出现直径约2 cm胆汁瘤,临床症状不明显,给予消炎、利胆、保肝治疗后逐渐恢复。不良反应发生情况见表3。
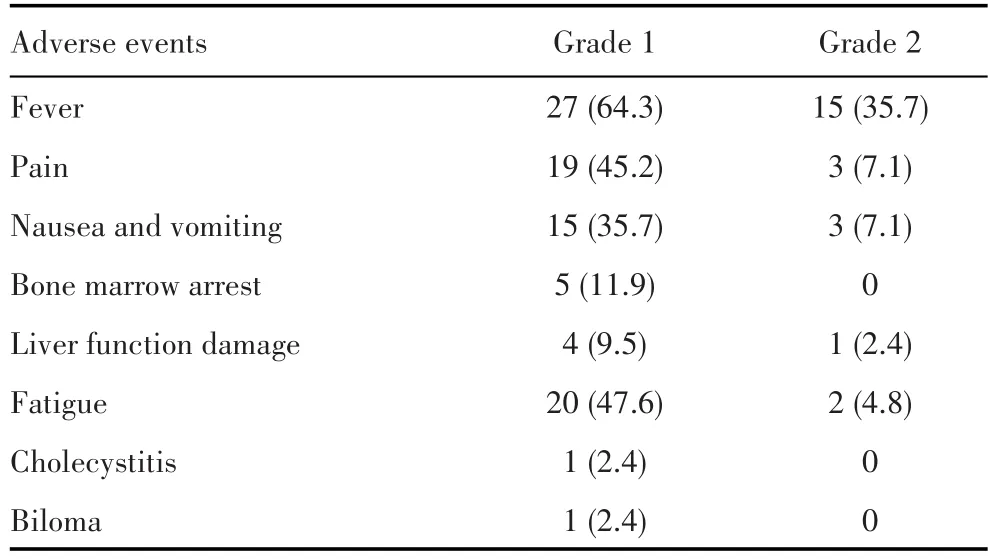
表3 42例结直肠癌肝转移患者DEB-TACE术后的不良反应[n(%)]Tab.3 Adverse reactions after DEB-TACE in 42 patients with liver metastases from colorectal cancer[n(%)]
2.5 影响患者DEB-TACE术后OS的Cox回归分析
单因素Cox回归分析显示,同时性转移(HR=0.676,95%CI:0.378~0.912,P=0.038)、Child-Pugh分级(HR=1.824,95%CI:1.153~3.347,P=0.010)、肿瘤数目(HR=1.368,95%CI:1.106~2.617,P=0.031)、肝外转移(HR=0.456,95%CI:0.218~0.851,P=0.023)可能是 OS的影响因素。多因素Cox回归分析显示,同时性肝转移(HR=0.446,95%CI:0.279~0.780,P=0.002)、肝外转移(HR=0.311,95%CI:0.134~0.968,P=0.007)是OS的独立影响因素。见表4。
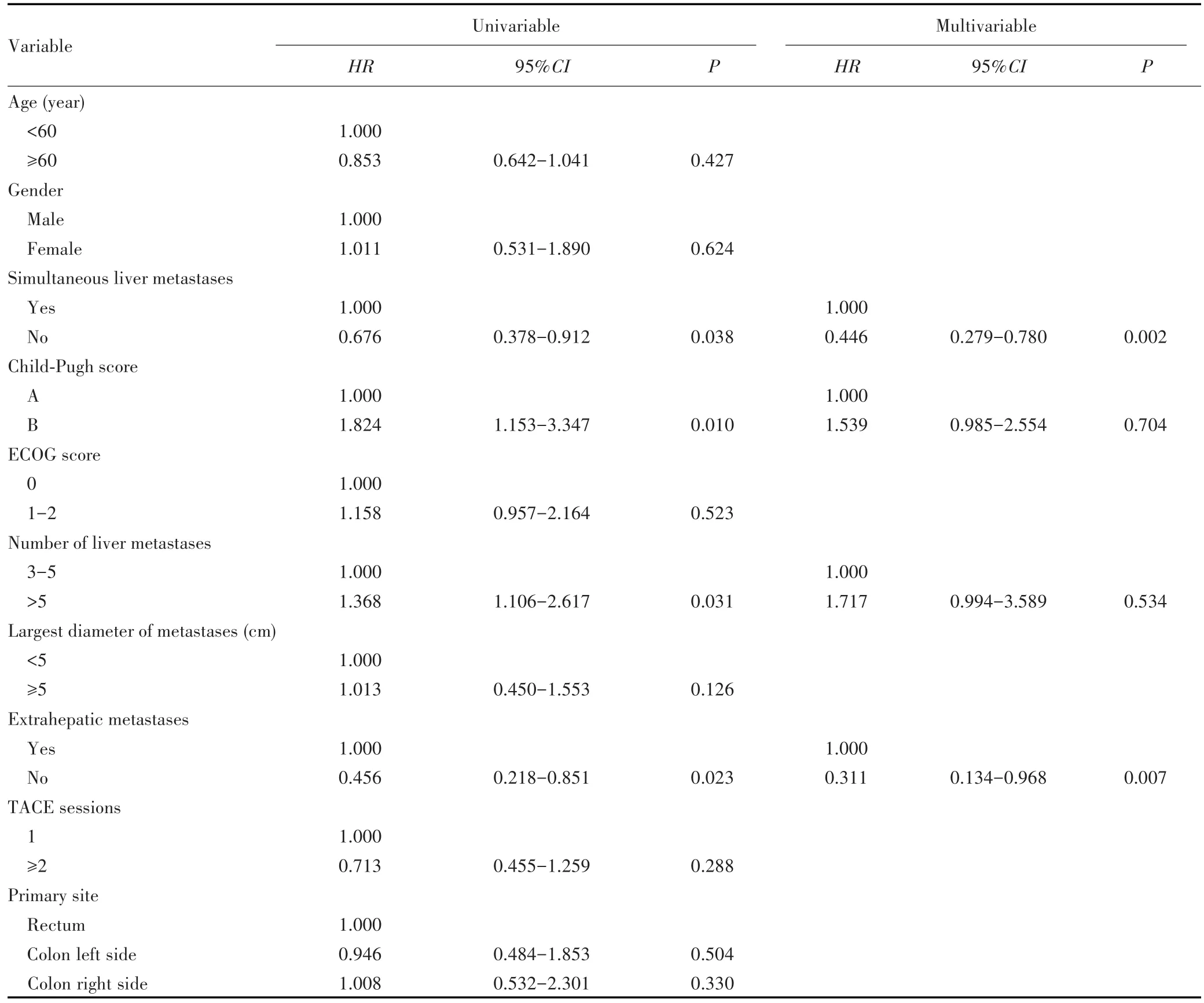
表4 影响患者OS的Cox回归分析Tab.4 Cox regression analysis on the OS of patients
3 讨论
在TACE治疗中,栓塞剂是阻断肿瘤供血的主要物质,也是TACE技术的核心,对控制肿瘤、降低复发转移具有重要作用[4]。结直肠癌肝转移大多为乏血供类型的肝癌,肿瘤供血血管较纤细,传统栓塞材料碘化油难以进入供瘤动脉,中远期疗效并不理想[5]。多发病灶者一般不能做到供瘤动脉的超选择,盲目的进行碘化油栓塞会导致肝功能损害及肝硬化,严重影响患者的生存获益[6]。DEB-TACE是近年来发展较快的介入技术,载药微球具备栓塞肿瘤动脉和缓慢释放化疗药物杀灭肿瘤的双重作用,在肝细胞癌介入治疗中发挥越来越重要的作用[7-8],尤其在乏血供肝癌治疗中展现了极大的优势[9-10]。对于转移性肝癌,尤其是对化疗相对敏感的结直肠癌肝转移患者,DEBTACE理论上具有更大的优势。已有研究显示,相较c-TACE,DEB-TACE治疗结直肠癌肝转移不仅肿瘤反应率较高,不良反应发生率也更低[11-12]。一项随机对照研究显示,在OS、PFS及生活质量评分方面,DEB-TACE组均显著优于FOLFOX组,其中DEB-TACE组24个月生存率达56%,对照组仅为32%[13]。本研究中所有纳入研究的患者都至少接受了二线化疗,但仍未有效控制病情,应用CalliSphere载药微球加载化疗药物伊立替康行TACE治疗后患者仍然获益,其中术后6个月ORR超过70%,DCR超过80%;中位PFS为11个月,中位OS为16个月,疗效优于国内同类临床研究结果[14],说明载药微球与化疗药物具有一定协同增强效应,可作为一种有效的组合治疗方法。此外,本研究在术后5~7 d复查可见肝内肿瘤低密度坏死改变,部分呈现蜂窝状改变;术后2、4、6个月的ORR分别为83.3%、81.0%、71.4%;DCR分别为 100.0%、90.5%、80.9%,说明本研究所选的载药微球规格可以使肝转移瘤载瘤动脉有效栓塞,从而促进肿瘤坏死,最终获得良好的近期疗效。
本研究还发现,同时性肝转移和肝外转移是影响患者生存的独立因素,与其他文献报道结论一致[15]。同时性肝转移和肝外转移患者一般具有更强的侵袭性,容易出现全身播散,进而导致更差的预后,因此这部分患者也成为临床上治疗的难点。对于伴肝外转移的患者,TACE作为一种局部治疗手段,术后联合其他治疗或可让患者更好获益。一项随机对照研究显示[16],FOLFOX联合TACE治疗结直肠癌肝转移的ORR明显高于单纯化疗组,且不增加不良事件的发生率。本研究中,所有患者在行DEB-TACE术后均可获得较满意的疗效,且未受肿瘤大小和数目的影响。因此,对于多发性肿瘤,建议采用超选择肿瘤供血动脉栓塞与区域性栓塞相结合的形式,因为区域性栓塞更符合恶性肿瘤根治性治疗的本质,且肝转移癌患者不存在肝炎、肝硬化等肝细胞癌患者的不良因素,因此肝脏功能可耐受。在不良反应发生方面,本研究显示所有患者术后并发症均为1~2级,且对症治疗后大部分于1周内缓解,未出现肝功能衰竭、肝脓肿及肝破裂等严重并发症。
综上所述,采用DEB-TACE全身化疗失败的不可切除结直肠癌肝转移患者可获得良好的临床疗效,且不良反应可控,同时性肝转移和合并肝外转移是影响患者OS的独立危险因素。但本研究为回顾性研究且样本量较小,因此有关结论仍需开展大样本多中心的前瞻性随机对照研究进一步证实。

