替加环素对重症急性胰腺炎患者肝功能、淀粉酶及凝血功能的影响
宋小玲,龚明,吕燕妮,钟海利,魏伯翠
南昌大学第一附属医院,江西 南昌 330006
重症急性胰腺炎是临床常见的急重症,占急性胰腺炎患病率的10%~20%,病情凶险,并发症多,总体病死率高达30%。重症急性胰腺炎后期继发感染治疗难度大,抗菌药物疗程长,常合并多重耐药革兰阴性菌感染[1]。替加环素是首个甘酰胺环素类抗菌药物,对产超广谱β-内酰胺酶及碳青霉烯酶肠杆菌目细菌和碳青霉烯类耐药鲍曼不动杆菌有良好的抗菌活性。由于缺乏其他有效的抗菌药物,替加环素常用于治疗多重耐药革兰阴性菌感染的重症患者。说明书批准剂量为负荷剂量100 mg,维持50 mg,2 次/d。对于多重耐药菌的感染,替加环素维持剂量可增至100 mg,2 次/d[2-3]。替加环素最常见的不良反应是消化道反应,上市后不良反应报告包括急性胰腺炎、肝脏胆汁淤积、黄疸及凝血功能异常等。因此本研究对重症急性胰腺炎患者使用替加环素治疗感染进行回顾分析,探讨替加环素对肝功能指标、淀粉酶及凝血指标的影响。
1 资料与方法
1.1 一般资料
采用回顾性分析方法,借助医院信息系统(hospital information system,HIS)和美康合理用药监测系统(prescription automatic screening system,PASS),从某医院2017 年6 月至2019 年5 月出院患者中诊断为重症或危重症急性胰腺炎合并感染,使用替加环素的病例。根据替加环素剂量的不同,将剂量组分为标准剂量组(负荷剂量为静脉滴注100 mg,随后50 mg,1 次/12 h)和高剂量组(负荷剂量200 mg 或无负荷剂量,随后100 mg,1次/12 h)。
1.2 纳入与排除标准
(1)纳入标准:重症或危重症急性胰腺炎诊断符合基于器官功能障碍和感染两项预后因素(DBC分级)的分级标准。感染诊断根据患者症状、体征、实验室检查或放射、超声等影像学结果。(2)排除标准:①替加环素治疗小于72 h;②妊娠或哺乳期妇女;③年龄小于18 岁;④严重肝功能不全者(child-pugh C 级);⑤存在血友病等先天凝血障碍疾病;⑥病历资料不全。
1.3 观察指标
安全性观察指标为患者使用替加环素前后住院期间的总胆红素(TBIL)、直接胆红素(DBIL)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、淀粉酶(AMY)、纤维蛋白原(FBG)、凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)。
1.4 肝功能指标及其他观察指标异常评价标准
参照CTCAE 5.0 版不良事件评价标准,将TBIL或DBIL>1.5 倍正常上限(基线值正常)或1 倍基线值(基线值不正常),或ALT>3 倍正常上限(基线值正常)或1.5 倍基线值(基线值不正常),或AST>3 倍正常上限(基线值正常)或1.5 基线值(基线值不正常),或ALP>2.5 倍正常上限(基线值正常)或2 倍基线值(基线值不正常),定义为肝功能指标异常。AMY>正常值上限~1.5 倍正常上限定义为AMY 水平升高。参照医院检验值范围、“全国临床检验操作规程”及CTCAE 5.0 版不良事件评价标准,将FBG<1.0~0.75 倍正常值下限,如基线值异常,比基线下降25%,或PT>正常值3 s,或APTT>正常值10 s 定义为凝血指标异常。
采用Narnajo 评分对不良反应与替加环素的关联性进行分析评价,总分≥9 分为肯定,5~8 分为很可能,1~4 分为可能。评价为可能、很可能、肯定均认为是替加环素相关的不良反应。
1.5 统计学方法
采用SPSS 23.0 统计学软件,正态分布的计量资料以表示,非正态分布的计量资料用中位数和四分位区间表示计数资料,以例(%)表示,组间比较采用χ2检验。P<0.05 认为差异有统计学意义。
2 结果
2.1 患者基本情况
共有73 例重症胰腺炎合并感染患者接受替加环素治疗,根据排除标准排除后,共51 例患者纳入研究。其中男性35 例(68.6%),女性16例(31.4%),年龄(47.18±10.94)岁,年龄范围28~76 岁。胰腺炎类型为胆源型27 例(52.9%),酒精型4 例(7.8%),高脂型17 例(33.3%),混合型3 例(5.9%)。6 例腹腔感染合并血流感染,10 例腹腔感染合并肺部感染,35 例腹腔感染;鲍曼不动杆菌12 株,肺炎克雷伯菌17 株,其他肠杆菌共18 株。替加环素治疗时间为5~48 d,平均(18.31±10.7)d。所有患者均在替加环素基础上联合用药,包括头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、亚胺培南和美罗培南等。共有29 例接受替加环素的标准剂量治疗,22 例接受高剂量治疗。
2.2 替加环素对肝功能指标的影响
用药前TBIL 及DBIL 高于其正常值上限1.5 倍定义为TBIL 及DBIL 异常组,TBIL 及DBIL 不高于其正常值1.5 倍定义为TBIL 及DBIL 正常组。用药前ALT 及AST 高于其正常值上限3 倍定义为ALT及AST 异常组,ALT 及AST 不高于其正常值上限3倍定义为ALT 及AST 正常组。用药前ALP 高于正常值上限2.5 倍定义为ALP 异常组,不高于正常值上限2.5 倍定义为ALP 正常组。
随着替加环素使用时间延长,TBIL、DBIL 升高的比例呈上升趋势,异常组发生比例高于正常组。在用药3 d 和7 d,ALT、AST异常组未见ALT、AST 升高,而ALT、AST 正常组用药7 d 分别有2例出现ALT 升高,1 例出现AST 升高;在用药14 d,ALT 异常组未见ALT 升高,AST 异常组有1 例出现AST 升高而ALT、AST 正常组各有1 例出现ALT、AST 升高。ALP 异常组用药后未见ALP 升高,正常组在用药3 d 和14 d 有升高趋势,用药后共有4 例出现升高。见表1。
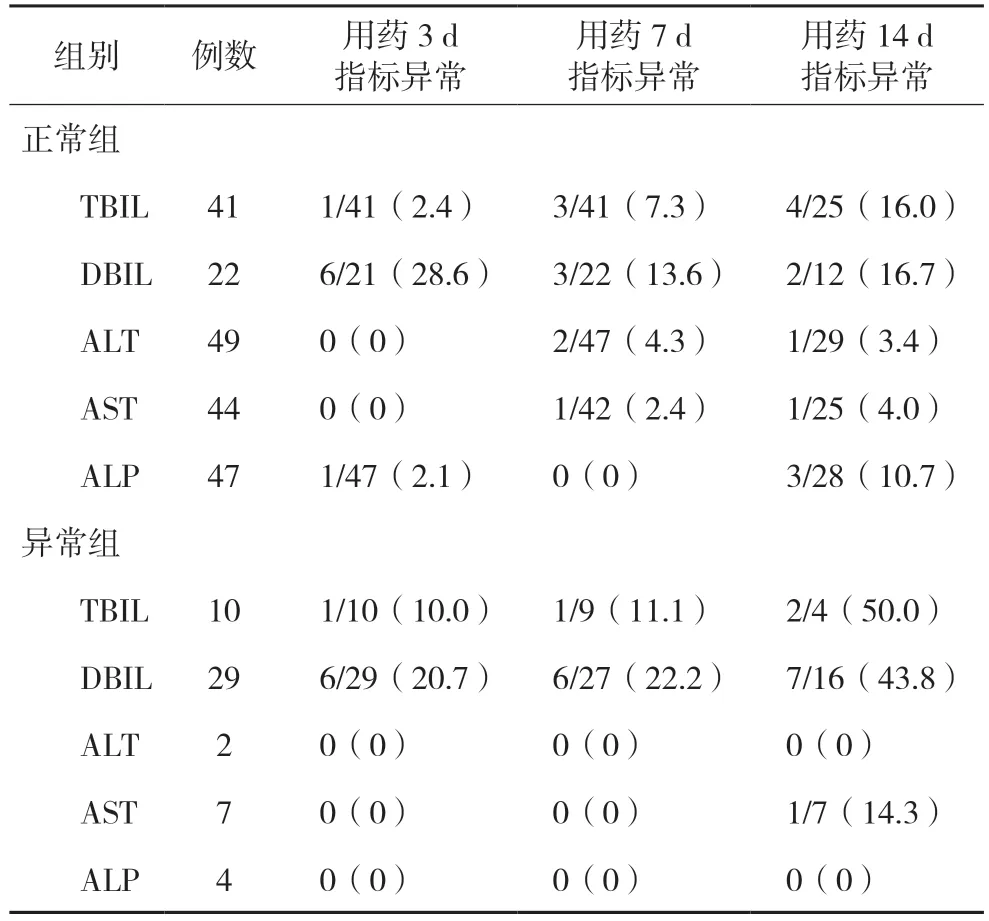
表1 替加环素对肝功能指标的影响[例(%)]
2.3 替加环素对AMY 的影响
用药前AMY 高于正常值上限定义为AMY 异常组,AMY 在正常值范围内定义为AMY 正常组。随着替加环素用药时间延长,异常组AMY 未见升高,正常组用药3 d 出现AMY 升高1 例,用药7 d 仍有升高,用药14 d 恢复正常。见表2。
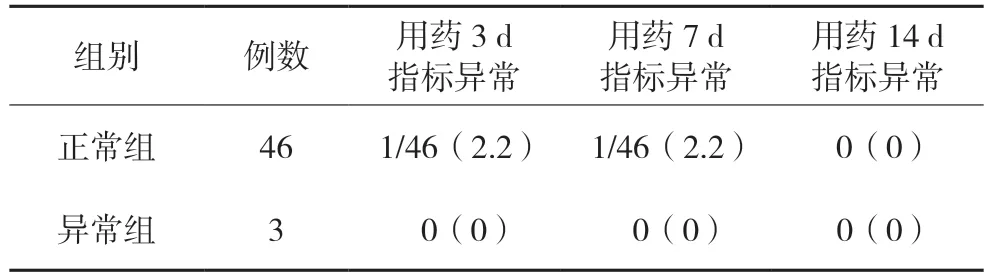
表2 替加环素对AMY的影响[例(%)]
2.4 替加环素对凝血指标的影响
用药前PT>正常值上限3 s 定义为PT 异常组,PT 在正常值范围内或≤正常值上限3 s 定义为PT 正常组。用药前APTT>正常值上限10 s 定义为APTT 异常组,APTT 在正常值范围内或≤正常值上限10 s 定义为APTT 正常组。用药前FBG 高于正常值上限或低于0.75 倍正常值下限定义为FBG 异常组,FBG 在正常值范围内或>0.75 倍正常值下限定义为FBG 正常组。
随着替加环素使用时间延长,PT、APTT 延长的发生率增加,FBG 降低的发生率增加。PT、APTT 及FBG 异常组指标异常的发生率高于其正常组,FBG 虽有降低,但多数病例仍处于正常范围内。见表3。
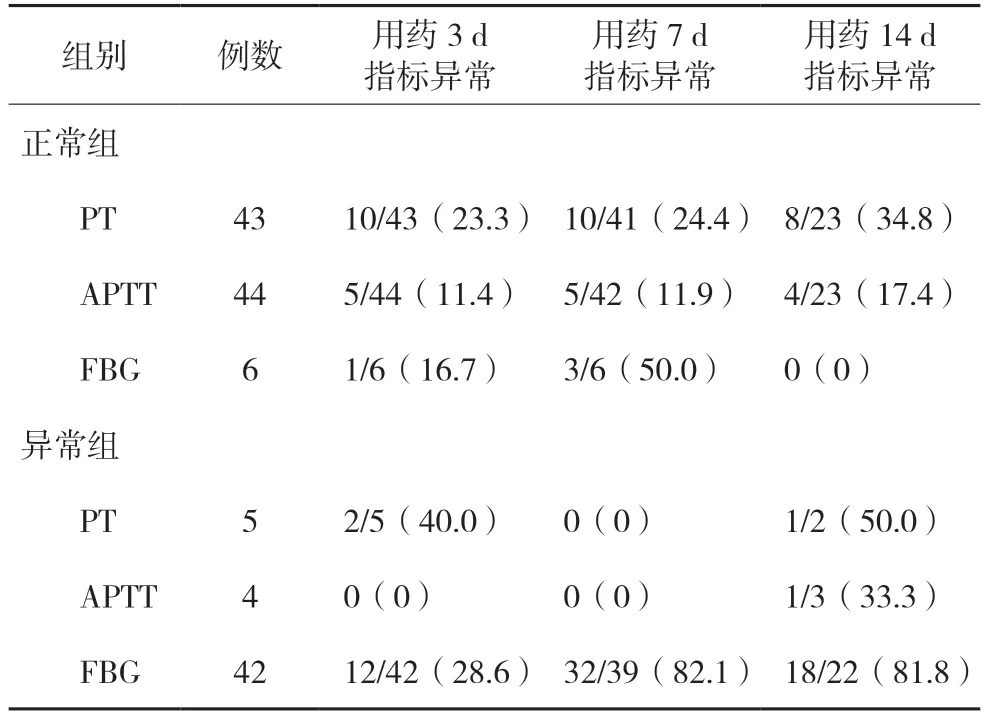
表3 替加环素对凝血指标的影响[例(%)]
2.5 不良事件发生情况
纳入51 例,使用替加环素后出现肝功能异常20 例(39.2%),标准剂量组和高剂量组各10例,两组肝功能异常的发生率差异无统计学意义(P=0.43)。肝功能出现异常的中位时间8 d。而使用替加环素后仅观察到1 例AMY 升高,两组差异无统计学意义(P=0.36)。使用替加环素后出现凝血功能异常41 例(85.4%),标准剂量组22 例,高剂量组19 例,其中高剂量组PT 和APTT 延长发生例次显著高于标准剂量组(P=0.02 和P=0.01),而FBG 降低的发生例次两组差异无统计学意义(P=0.26)。凝血功能出现异常的中位时间6 d。见表4。
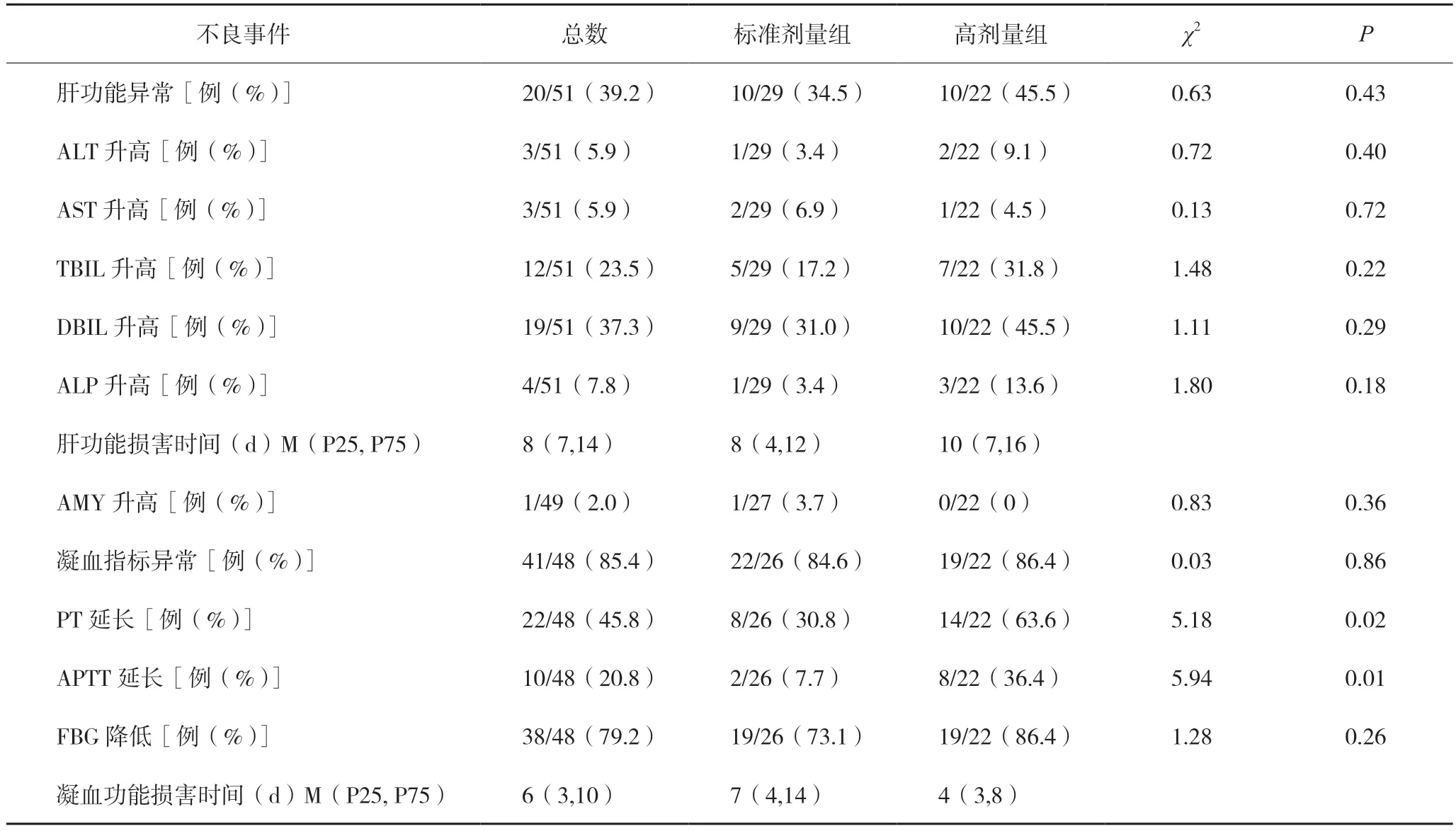
表4 比较替加环素不同剂量组发生不良事件的例次和时间
2.6 停药后肝功能指标及凝血指标的影响
20 例替加环素相关肝功能指标异常的病例中,13 例获得停药后随访资料,其中1 例患者停药后胆红素仍持续升高,停药后21 d 开始下降,12 例患者在停药中位时间5 d(3~14 d)肝功能好转或恢复正常。41 例替加环素相关凝血功能指标异常的病例中,30 例获得停药后随访资料,其中3 例停药后凝血指标未恢复,27 例患者在停药中位时间4 d(2~10 d)凝血功能好转或恢复正常。
3 讨论
替加环素于2011 年在我国上市,主要用于复杂性腹腔内感染、复杂性皮肤和皮肤软组织感染、社区获得性细菌性肺炎。替加环素是治疗广泛耐药(XDR)肠杆菌目、XDR 鲍曼不动杆菌感染的主要方案之一[2]。近年来,替加环素在临床感染性疾病治疗中的地位逐渐上升,其随之而来的不良反应也逐渐引起重视。说明书提示替加环最常见的不良反应包括恶心、呕吐和肝脏胆汁淤积等[3]。有报道替加环素可致急性胰腺炎,临床表现主要为腹痛、腹胀以及血清淀粉酶升高[4]。近年资料表明,替加环素致急性胰腺炎有所增加,Okon 等[5]报道了FDA的ADRs 数据库中替加环素相关胰腺炎情况,发生率呈现上升趋势,占比达5%。另外,随着替加环素的广泛使用和剂量增加,一些潜在严重的不良反应被认识。
本研究结果显示,纳入病例肝功能指标异常的发生率高达39.2%(20/51),其中以TBIL 及DBIL升高为主,ALT、AST 及ALP 升高发生率较低。随着替加环素使用时间延长,TBIL、DBIL 升高的比例呈上升趋势,异常组发生率高于正常组,ALT、ALP 异常组指标值升高的发生比例低于正常组。文献报道[6],使用替加环素后,肝功能指标异常发生率为18%,其中总胆红素升高发生率为55.6%。本研究肝功能指标异常发生率高于文献报道,可能原因:纳入病例中胆源性胰腺炎比例为52.9%,患者在用药前存在胆管梗阻、胆囊结石等疾病,使用替加环素后TBIL、DBIL 升高的发生率增加。而用药前ALT、AST 升高的患者,在使用护肝药的情况下,使用替加环素后ALT、AST 升高的病例数较少。替加环素引起的肝功能异常的发生率在高剂量组和标准剂量组差异无统计学意义,提示肝功能损伤与替加环素的剂量无相关性,更可能与长疗程相关,对于长疗程使用替加环素的患者更需警惕肝功能损伤的进展,特别是在用药后第10 天,予以相应保肝治疗后几乎都可以恢复[6]。
通过本研究发现,使用替加环素后仅1 例出现AMY 升高,发生率为2.0%,且在用药14 d 恢复正常。而胰腺炎患者大多存在腹胀、腹痛等表现,并接受通便治疗,本研究未对替加环素相关胰腺炎的症状和腹泻等不良反应进行讨论。因此,替加环素用于重症胰腺炎合并感染患者是否会诱发胰腺炎再次发作,本研究暂无相关结论。
PT、APTT 延长及FBG 降低可能导致出血风险增加。本研究结果显示,凝血功能指标异常的发生率高达85.4%,其中以FBG 降低为主,PT、APTT延长发生率相对较低。随着替加环素使用时间延长,PT、APTT 延长的发生率增加,FBG 降低的发生率增加。PT、APTT 及FBG 异常组指标异常的发生率高于其正常组。FBG 虽有降低,但仍处于正常范围内,替加环素对FBG 的影响有待进一步研究。与标准剂量组相比,高剂量组PT 和APTT延长的发生率显著升高(P=0.02 和P=0.01)。使用替加环素可导致凝血功能异常,但停药后凝血功能可恢复[7-9],与文献研究基本一致。
替加环素致肝功能异常的可能原因为替加环素属于四环素类,而四环素类药物能提高白细胞介素18 水平及致肝细胞凋亡。替加环素引起凝血功能障碍的机制,一方面与四环素相似,可影响肠道维生素K 的吸收以及直接作用于体内的凝血瀑布,另一方面,替加环素致肝功能损伤可能引起凝血酶和凝血因子合成障碍,致凝血功能异常[10]。现有研究表明[11-12],糖皮质激素、IL-6、IL-1β 可影响FBG 基因的表达水平,替加环素或其代谢产物是否会影响上述物质水平仍不明确,需进一步研究;另一研究发现[13],发生凝血功能异常的患者血清微小核糖核酸122(miR-122)水平明显增加,而miR-122 水平与 APTT、FBG 水平相关,但仍需进一步验证替加环素是否会影响血清miR-122 的水平。
综上所述,替加环素可引起TBIL、DBIL 升高,PT、APTT 延 长,FBG 降低,对ALT、AST、ALP及AMY 影响相对较小,在临床使用替加环素期间应对患者肝功能指标、凝血指标进行监测,尤其对用药前存在指标异常的患者应密切监测。本研究样本量较少,研究方法存在一定的局限性,研究结果可能存在偏倚,需进一步设计大样本的对照研究加以验证。

