甘蓝型油菜苗期氮高效吸收转运特征研究
巢成生,王玉乾,沈欣杰,代晶,顾炽明,李银水,谢立华,胡小加,秦璐,廖星
甘蓝型油菜苗期氮高效吸收转运特征研究
巢成生,王玉乾,沈欣杰,代晶,顾炽明,李银水,谢立华,胡小加,秦璐*,廖星*
中国农业科学院油料作物研究所/农业农村部油料作物生物学与遗传育种重点实验室,武汉 430062
【目的】氮素吸收效率是影响作物氮效率的重要方面,开展油菜氮高效吸收转运特征研究旨在为提升油菜氮吸收效率及产量提供理论依据。【方法】为探究油菜氮高效吸收转运机理,以一对氮效率差异显著的油菜种质:氮高效种质‘498’和氮低效种质‘428’为试验材料,在营养液培养条件下,设置正常供氮(9.5 mmol∙L-1)和低氮(0.475 mmol∙L-1)处理,研究不同氮浓度下油菜在3个生长时期(物候生长期12、14和16)的生理指标差异;并运用15N同位素示踪技术研究不同种质对NO3-和NH4+的吸收和转运能力。同时,利用实时荧光定量PCR技术分析氮吸收转运相关基因(、和)在氮效率不同油菜种质中的表达差异。【结果】不同氮浓度处理下,油菜种质‘498’的植株生长和根系发育均表现较强优势,根系形态指标(主根长、总根长、根表面积、根体积和侧根数)、生物量、氮累积量和氮吸收效率均显著高于油菜种质‘428’。15N同位素示踪试验也表明,油菜种质‘498’对NO3-和NH4+的吸收累积强于‘428’,尤其是NH4+,‘498’在高低氮浓度处理下植株15NH4+累积量均显著高于‘428’。实时荧光定量PCR分析结果进一步显示,在正常供氮处理下,参与NO3-、NH4+吸收与转运的基因(、、、、、、、、和)在‘498’中的相对表达量显著高于‘428’;而在低氮处理下,‘498’根中参与NO3-吸收与转运的基因(、和)的相对表达量显著低于‘428’,但是参与调控NO3-转运及再分配的基因(和)表达水平较高,同时,参与NH4+吸收转运的基因(、、、、和)的表达水平也显著高于‘428’。【结论】与氮低效种质‘428’相比,氮高效种质‘498’的根长、根表面积(体积)、侧根数均表现出显著优势,并且其对氮(尤其是NH4+)的吸收累积能力较强;正常供氮处理下,参与NO3-、NH4+吸收转运的基因在‘498’中表达相对较高,而低氮处理下参与NO3-转运与再分配及NH4+吸收转运的基因在‘498’中相对表达量显著高于‘428’,说明‘498’相对较高的氮吸收效率可能与部分和基因的高表达水平相关。
甘蓝型油菜;氮高效;根系形态;吸收转运;氮转运蛋白基因
0 引言
【研究意义】甘蓝型油菜(L.)是我国重要的油料作物,除油用外,还具有菜用、花用(观赏)、蜜用、饲用、肥用等多种用途[1]。氮是油菜生长发育必需的重要营养元素之一,农业生产上油菜对氮肥依赖度较高,但利用率偏低[2],超过一半的氮肥流失在环境中[3],不仅影响经济效益,还会对环境造成污染[4]。在化肥减施增效和农业绿色高质量发展的背景下,挖掘油菜生物学潜力培育氮高效油菜品种是提升油菜氮效率的有效途径之一,可以在降低氮肥施用量的同时不影响油菜产量。研究油菜氮高效吸收转运特征,旨在为提升油菜氮效率及产量提供理论依据。【前人研究进展】氮利用效率(nitrogen use efficiency,NUE)是遗传因素和环境因素相互作用的结果,包括氮吸收效率(N uptake efficiency,NUpE)、氮利用(同化)效率(N utilization(assimilation)efficiency,NUtE)、氮转运效率(N transport efficiency,NTE)等[5]。前人关于油菜氮高效机理研究主要集中在生理机理的解析,例如根系与氮效率的相关性,许多研究表明,良好的根系发育是作物氮高效吸收的基础[6-8]。WANG等[9]研究发现,在不同供氮处理下培养23 d后,氮高效油菜根系均比氮低效的发达。KAMH等[10]研究进一步发现,氮高效油菜种质对氮的高吸收效率是因为根系生长,而不是单位根长的高吸收。除了根系之外,油菜对氮的吸收、转运和利用均会影响油菜氮效率。研究发现,低氮处理下氮高效油菜种质的优势体现在对硝酸盐的吸收,而正常供氮处理下表现在对植株体内累积硝酸盐的再利用[11]。洪娟等研究进一步解析了油菜氮高效的可能机理:氮胁迫下,氮高效种质拥有较为发达的根系,对氮的吸收、转运和同化能力较强,油菜长势相对较好,通过其较强的光合能力形成较多的光合产物,而光合产物又运往根部以促进根系生长,形成一个良性循环[12]。众所周知,硝态氮(NO3-)和铵态氮(NH4+)是植物从土壤中吸收的主要氮素来源[13],它们主要通过相应的转运蛋白进入植物体。植物对硝酸盐的吸收是由低亲和性(low-affinity)和高亲和性(high-affinity)的硝酸盐转运体(nitrate transporters,NRT)介导的[14]:NRT2(nitrate transporters 2)是高亲和性硝酸盐转运体,而大多数NRT1(nitrate transporters 1)是低亲和性硝酸盐转运体[15],其中AtNRT1.1 (CHL1/ NPF6.3)比较特别,它被证明是一种双亲和性(dual-affinity)硝酸盐转运体,根据T101残基的磷酸化程度表现出对NO3-高或低亲和性[16]。最近,Léran等通过系统发育树将NRT1重新命名为NPF(nitrate transporter 1/peptide transporter family)[17]。铵态氮的吸收则与铵态氮转运蛋白基因(ammonium transporter,AMT)相关[18]。关于硝酸盐或者铵盐转运蛋白基因与油菜氮效率相关性方面也有一些报道。如HAN等发现,在根系中,NO3-的液泡固存能力的降低将促进NO3-向地上部运输,通过促进NO3-向地上部分分配(可能通过和的协调调节)有助于形成较高的NUE[19]。Wang等研究发现,在不同供氮浓度下培养23 d后,氮高效油菜叶片和根系组织中的相对表达量均显著高于氮低效油菜[9]。张玉莹等研究表明,不同供氮处理下,氮高效油菜根系组织中的相对表达量均显著高于氮低效,但基因表达量无显著差异[20]。【本研究切入点】可见,关于氮效率差异油菜品种氮转运蛋白基因的表达已有一些研究,但是,氮效率差异油菜对氮素的吸收、转运规律以及氮转运蛋白家族基因的表达特征尚未开展系统研究。【拟解决的关键问题】因此,本研究在比较氮效率差异油菜种质根系形态和氮吸收积累规律的基础上,利用实时荧光定量PCR技术分析氮吸收转运相关基因(、和)的表达特征,系统总结油菜氮高效吸收转运的特征,旨在为提高油菜氮效率、保障油菜绿色高质量发展提供理论依据。
1 材料与方法
1.1 试验材料
供试材料为一对氮效率显著差异油菜种质:‘498’(氮高效)和‘428’(氮低效),是本团队前期通过3次水培试验,以苗期生物量为主要依据,从350份甘蓝型油菜种质中筛选得到,并在田间进行了验证[21]。试验于2019年11月在中国农业科学院油料作物研究所试验棚进行,以改良后的1/2浓度Hoagland营养液(pH:5.8—6.0,硝铵比为8.5﹕1)培养,设置两个氮浓度处理,正常供氮(CK,9.5 mmol·L-1)和低氮(LN,0.475 mmol·L-1),每个处理设置3个生物学重复,培养方法和营养液配制参照徐子先[21]的研究:首先挑选饱满且大小一致的油菜种子,将其置于铺有洁净纱布的蓝色不透光周转箱(盛有改良后的1/4 Hoagland营养液)上育苗,育苗时避光处理,待胚根完全长出后恢复正常光照。待油菜子叶完全展开后,将油菜转移到蓝色周转箱(32 cm×24 cm×12 cm)中培养,移苗第一周用改良后的1/4 浓度Hoagland营养液培养,之后均用改良后的1/2 Hoagland浓度营养液培养,每隔7 d更换一次营养液。在油菜物候生长期(phenological growth stages)12、14和16(即第二叶展开、第四叶展开和第六叶展开的时期,以正常供氮处理下氮高效种质‘498’的物候生长期为标准)[22],分别收获整株用于植株表型观察及生物量、根系指标、氮含量测定。并在油菜物候生长期16收获同一叶位功能叶和根系用锡纸包裹后立即于液氮中速冻,保存于-80℃冰箱中用于总RNA提取。
1.2 表型及生理指标测定方法
每个取样时期用单反相机(型号为Nikon D800)拍照记录油菜幼苗的表型特征。生物量测定:将整株植株分成地上部和根部,经105℃杀青30 min,随后80℃烘干至恒重,用千分之一分析天平称量干重。二维根系指标测定:用根系扫描仪(EPSON V700 J221A)和根系分析软件(WinRHIZO Pro 2012b)对根系形态相关指标进行分析。植株样品氮含量用凯氏定氮法测定,测定方法参照《土壤农化分析》[23]。
氮效率相关指标的计算方法参照XU和顾炽明等的研究[5,24]:
氮累积量(N accumulation,NA,mg/plant)=生物量×氮含量;
氮利用效率(N use efficiency,NUE,%)=生物量/植株氮累积量×100;
氮吸收效率(N uptake efficiency,NUpE,%)=植株体氮吸收总量/介质供氮量×100(介质供氮量=营养液中氮浓度×累计更换营养液的体积);
氮转运效率(N transport efficiency,NTE,%)=地上部全氮/整株全氮×100。
1.3 15N同位素示踪试验
15N同位素示踪试验在光照培养箱进行,育苗培养方法同1.1。挑选不同氮浓度培养下长势一致的油菜幼苗(物候生长期16),用去离子水冲洗根部后放入锥形瓶(装有300 mL改良的1/2浓度Hoagland营养液)中,瓶身用锡纸包裹避光,氮素替换为等浓度(4.75 mmol·L-1)的15NH4NO3和 NH415NO3(10atom%,麦克林Macklin),加入硝化抑制剂双氰胺(35.34 mg·L-1)[25]。随后置于光照培养箱中培养,光照培养箱条件设置为:光强12 000 Lux,温度22℃,光照时间为16 h/8 h(昼/夜),相对湿度60%。培养12 h后收取整株,将其分为地上部和根部。取样后样本于105℃杀青30 min,80℃烘干至恒重,用千分之一分析天平称取干重,用研钵研磨成粉末后过100目筛,装入自封袋中密封烘干3 d,用同位素质谱仪(EA-Delta VMS, Thermo Scientific, USA)测定15N丰度。以上试验和检测均包含3个独立的生物学重复。
15N相关指标参照晏娟等[26]的方法计算:
15N原子百分超=样品或15N标记氮源的15N丰度-15N天然丰度;
Ndff(%)= 样品的15N原子百分超/标记氮源的15N原子百分超×100;
式中,自然丰度为0.3663%;Ndff %(The percentage of N drived from15N-fertilizer)为植株体内的氮素来自标记15N氮源的百分比。
植株组织或器官的15N累积量=该组织或器官全氮量×该组织或器官的Ndff %。
1.4 实时荧光定量PCR检测
1.4.1 同源序列查找与引物设计s同源序列获得:首先挑选在拟南芥中已报道家族基因[27],然后从拟南芥基因组数据库https://www.arabidopsis.org中查询s家族基因序列,接着到油菜基因组数据库http://www.genoscope.cns.fr/ brassicanapus和蛋白数据库https://www.uniprot.org中进行比对,获得油菜中相似度最高的同源序列(甘蓝型油菜为异源四倍体,基因组为AACC,因此分别在油菜A和C基因组上各挑选一条相似性最高的同源序列),在https://biodb.swu.edu.cn/qprimerdb/中查询qPCR引物[28]。油菜基因序列参照本团队研究(暂未发表),油菜序列参照TONG等[29]的研究, qPCR引物序列具体见附表1。
1.4.2 总RNA提取与RT-qPCR 用植物RNA提取试剂盒(HiPure Plant RNA Mini Kit, Magen)提取油菜叶片和根系组织总RNA,使用PrimeScript RT reagent Kit with gDNA Eraser(TaKaRa, Kyoto,Japan)进行反转录得到cDNA双链,使将其稀释10倍作为反应模板。内参基因为油菜肌动蛋白()[30],使用荧光定量PCR仪(Bio-Rad, Hercules, USA)进行qPCR。反应体系和程序参照通用荧光定量PCR试剂盒(Biosharp,Universal SYBR qPCR Master Mix)说明书,相对表达量计算采用2-ΔΔCt[31]法,热图绘制的计算公式为:log10(2-ΔΔCt),以正常供氮处理为标准进行归一化处理。
1.5 数据处理
采用Excel 2019和 Graph Pad Prism 8进行数据分析和作图,数据间差异显著性检验采用SPSS 26进行,基因相对表达量分析使用T检验,其余均采用单因素方差分析(ANOVA),事后检验采用Duncan’s法。
2 结果
2.1 不同氮浓度对氮效率差异油菜幼苗形态和生物量的影响
在本试验设置的不同氮浓度处理下,氮效率差异油菜种质地上部在处理早期(物候生长期12)表型无明显差异(图1-a),随着处理时间的延长,不同氮浓度处理间表现出差异(图1-b),尤其是在物候生长期16,差异明显(图1-c),且低氮处理对氮效率差异油菜幼苗生长的影响较为一致:与正常对照相比,氮高效种质‘498’和氮低效种质‘428’在低氮处理下的生物量分别降低51.2%和49.0%(图2)。并且,在物候生长期16阶段,氮效率差异油菜种质在不同氮浓度处理下的植株长势和生物量均存在显著差异(图1-c,图 2),氮高效种质‘498’的长势和生物量显著优于氮低效种质‘428’,氮高效种质‘498’在正常供氮和低氮处理下的生物量分别比氮低效种质‘428’高36.6%和30.8%(图2)。
2.2 不同氮浓度对氮效率差异油菜根系形态相关指标的影响
从图1可以看出,从物候生长期12开始,相比地上部,根系对介质氮浓度的变化已有较为明显的响应,两个油菜种质根系在3个取样时期对低氮的适应性变化趋势基本一致,其中物候生长期16变化幅度最大(图1,图3)。在物候生长期16,与正常供氮处理相比,低氮处理下,氮高效种质‘498’的主根长、总根长、根表面积、根体积和侧根数分别增加46.5%、155.5%、72.7%、23.2%和226.3%;同样,氮低效种质‘428’也分别增加83.1%、141%、57.3%、1.8%和304.9%(图3)。并且,不同氮浓度下根系形态相关指标在氮效率差异油菜种质间存在明显差异(图3),与氮低效种质‘428’相比,氮高效种质‘498’在根系发育方面表现出较强的优势,以物候生长期16差异最为明显,主要体现在:正常供氮处理下,与氮低效种质‘428’相比,氮高效种质‘498’的主根长、总根长、根表面积、根体积、侧根数分别增加50.8%、62.4%、48.5%、23.9%和125.4%;低氮处理下,则分别增加20.6%、72.2%、63.0%、49.9%和81.7%(图3)。

根据生长发育周期BBCH划分法确定油菜物候生长期(以正常供氮处理下氮高效种质‘498’为标准),(a)12;(b)14;(c)16。12:第二叶展开;14:第四叶展开;16:第六叶展开。下同
每张图从左往右依次是氮高效种质‘498’正常供氮处理、氮低效种质‘428’正常供氮处理、氮高效种质‘498’低氮处理、氮低效种质‘428’低氮处理
Definition of the phenological growth stages of rapeseed (L.) according to the BBCH-scale (the stage of N efficient germplasm ‘498’ under normal N supply as standard), (a) 12; (b) 14; (c) 16.12: second leaf unfolded; 14: fourth leaf unfolded; 16: sixth leaf unfolded.The same as below
Each picture from left to right is N efficient germplasm ‘498’ with normal N treatment, N inefficient germplasm ‘428’ with normal N treatment, N efficient germplasm ‘498’ with low N treatment, N inefficient germplasm ‘428’ with low N treatment
图1 不同氮浓度对氮效率差异油菜种质苗期生长的影响
Fig.1 Effects of different N concentrations on the growth of rapeseed germplasms with contrasting N efficiency at seedling stage

CK:正常供氮;LN:低氮处理;‘498’:氮高效种质;‘428’:氮低效种质;不同小写字母表示处理间在0.05水平差异显著。图3、表1、图4同

图3 不同氮浓度对氮效率差异油菜种质苗期根系形态相关指标的影响
2.3 不同氮浓度对氮效率差异油菜种质氮效率相关指标的影响
在不同时期对氮效率差异油菜种质氮含量的检测及氮效率相关指标的计算结果发现,与正常供氮处理相比,低氮处理下,氮效率差异油菜种质幼苗的氮浓度、氮累积量和氮转运效率显著下降(表 1),而氮吸收效率、氮素利用效率显著提高,这一变化趋势在3个取样时期均一致,其中以物候生长期16的变化幅度最大。在物候生长期16,与正常供氮处理相比,低氮处理下,氮高效种质‘498’和氮低效种质‘428’的氮吸收效率分别提高5.17倍和5.03倍(表1)。
在不同氮浓度处理下,氮效率差异种质的氮累积量、氮吸收效率和氮利用效率在物候生长期16均存在显著差异(表1),与氮低效种质‘428’相比,氮高效种质‘498’在正常供氮和低氮处理下的氮吸收效率分别提高29.9%和33.4%。而氮利用效率呈现出不同的趋势,正常供氮处理下,‘498’的氮利用效率高于‘428’,而在低氮条件下,‘498’的氮利用效率低于‘428’(表1)。并且,低氮处理下氮高效种质‘498’在3个取样时期的氮吸收效率均显著高于氮低效种质‘428’(表1),说明本研究供试的油菜种质氮效率差异主要体现在氮吸收效率上,与氮低效种质‘428’相比,氮高效种质‘498’具有更强的氮吸收效率。

表1 不同氮浓度对氮效率差异油菜种质苗期氮浓度及氮效率相关指标的影响
进一步利用15N同位素示踪试验比较氮效率差异油菜对不同形态氮的吸收积累规律发现,与正常供氮处理相比,低氮处理下,氮效率差异油菜种质幼苗的15N累积量显著降低(图4),说明低氮胁迫虽然能促进油菜根系发育(图3),但是油菜在遭受胁迫后对氮素的吸收能力可能受到抑制。比较氮效率差异油菜种质发现,不同种质间的15N累积量存在显著差异,不同氮浓度处理后,氮高效种质‘498’的15N累积量均高于氮低效种质‘428’(图4),其中15NH4+差异达到显著水平。具体表现为:与‘428’相比,正常供氮处理下,‘498’地上部和根部的15NO3-累积量分别提高10.2%和32.4%,15NH4+累积量则分别提高36.0%和76.9%;而在低氮处理下,‘498’地上部和根部的15NO3-累积量分别提高9.8%和15.0%,15NH4+累积量分别提高49.3%和1.8%(图4)。综上,相较于氮低效种质‘428’,氮高效种质‘498’对N的吸收累积(尤其是NH4+)表现出较强的优势。

图4 油菜物候生长期16幼苗不同部位15N累积量
2.4 油菜氮转运蛋白基因家族表达特征
为进一步探明氮效率差异油菜种质对氮素的吸收积累差异是否与氮转运蛋白基因相关,本研究利用RT-qPCR技术检测油菜氮转运蛋白基因(、和)在氮效率差异油菜叶片和根系中的表达差异,并参考拟南芥中已报道的基因功能[27, 32]预测油菜同源基因的功能。可以看出,与正常供氮处理相比,低氮处理下,油菜叶片中大多数、和家族基因表达上调;在根系中,情况有所不同,大多数家族基因表达下调,而大部分和家族基因表达上调(图5)。
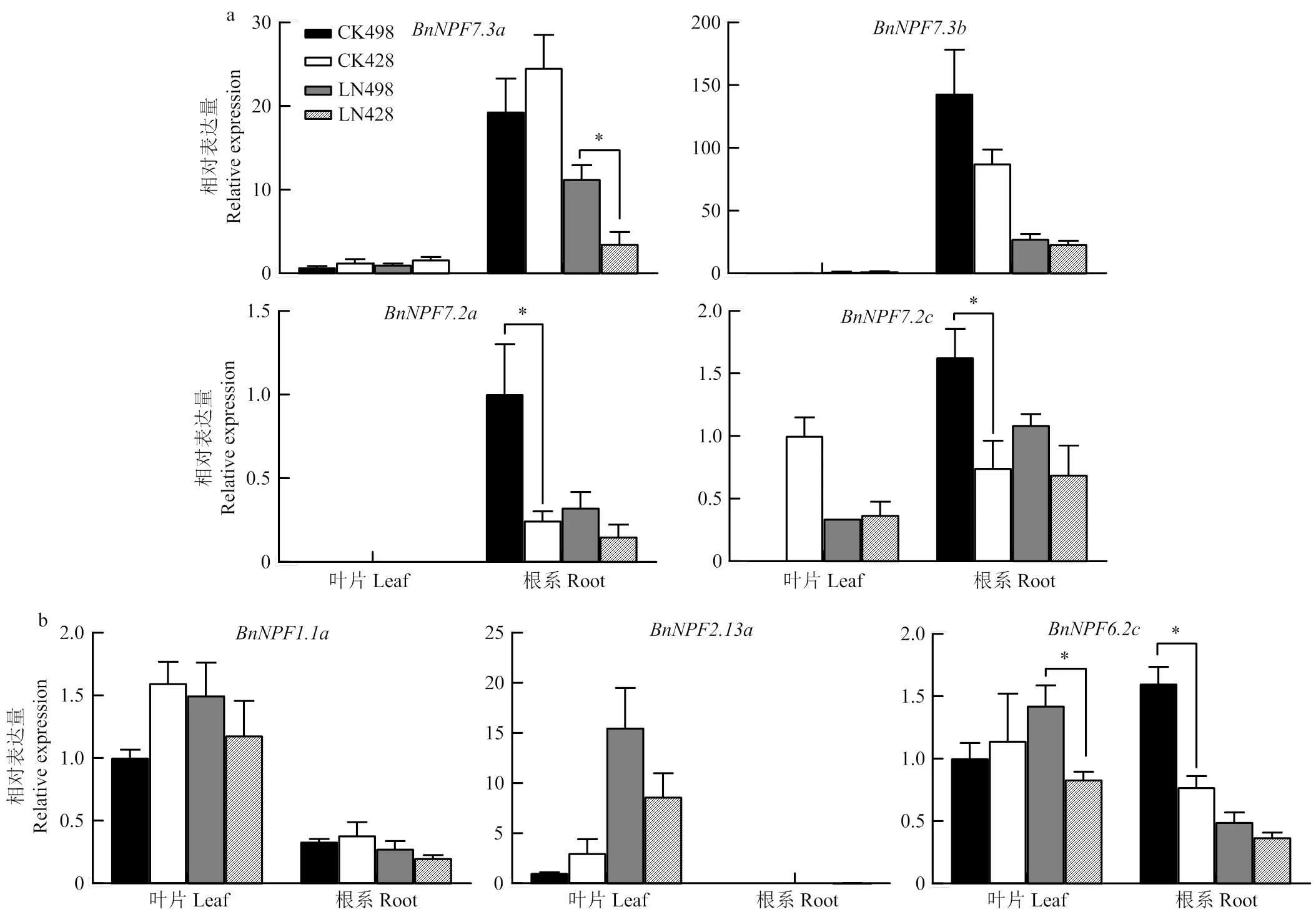
推测可能参与油菜NO3-吸收的基因中,与正常供氮相比,低氮处理下油菜根系中、、和的相对表达量降低;而、、、和的相对表达量提高(图6),说明油菜中和可能主要参与较高氮浓度下根系对硝酸盐的吸收,和可能主要负责低氮胁迫下根系对硝酸盐的吸收。
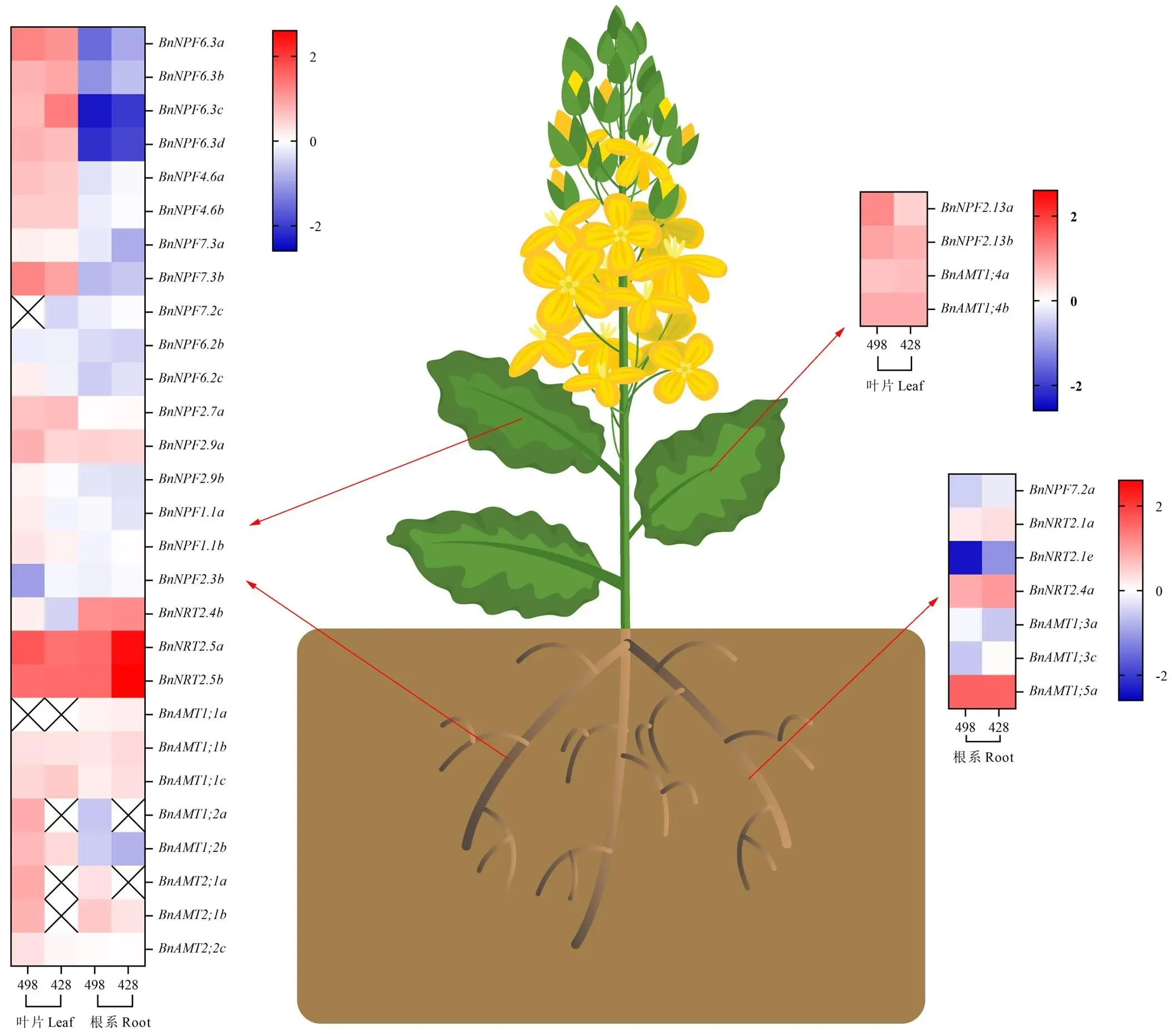
用于检测氮吸收转运相关基因相对表达量的样本为油菜物候生长期16时收获的功能叶和根系样本,双箭头指向在叶片和根系中均有表达的基因,单箭头指向仅在叶片或根系中表达的基因,红色表示表达上调,蓝色表示表达下调
根据拟南芥同源基因推测和主要调控NO3-在木质部转运,如图7-a所示,与正常供氮相比,低氮处理下油菜根系中、的相对表达量降低,说明在低氮胁迫下,油菜对NO3-的转运能力可能受到影响。此外,是一类可能参与调控NO3-在叶片和叶柄中积累,介导NO3-从木质部向韧皮部的转移以及从源叶向库叶的再分配的硝酸盐转运蛋白基因;而高亲和硝酸盐转运蛋白和除了在根系中表达外,在叶片中也有表达,说明可能参与硝酸盐的叶片再动员和韧皮部运输。本研究发现,与正常供氮处理相比,缺氮处理下油菜叶片中和的相对表达量提高(图6-b和图7-b),说明在低氮胁迫下,油菜对NO3-的再分配能力可能提高,而根系中的表达降低(图7-b),可能引起NO3-在木质部积累。

用于检测NO3-吸收相关基因相对表达量的样本为油菜物候生长期16时收获的功能叶和根系样本。根据拟南芥和基因功能研究报道对油菜和基因进行功能分类,包括a:低亲和NO3-吸收;b:高亲和NO3-吸收;c:介导NO3-外排。*表示<0.05;**表示<0.01
The samples (functional leaves and roots) used to detect the relative expression of genes involved in NO3-uptake were harvested at BBCH 16 stage.Functional classification of rapeseedandgene was conducted according to the previous studies ofandgene in, including, a: Low-affinity NO3-uptake; b: High-affinity NO3-uptake; c: Mediating NO3-efflux.* represents<0.05; ** represents<0.01
图6 不同氮浓度下氮效率差异油菜种质中负责NO3-吸收相关基因表达分析
Fig.6 Expression analysis of NO3-uptake related genes in rapeseed germplasms with contrasting N efficiency under different N concentrations
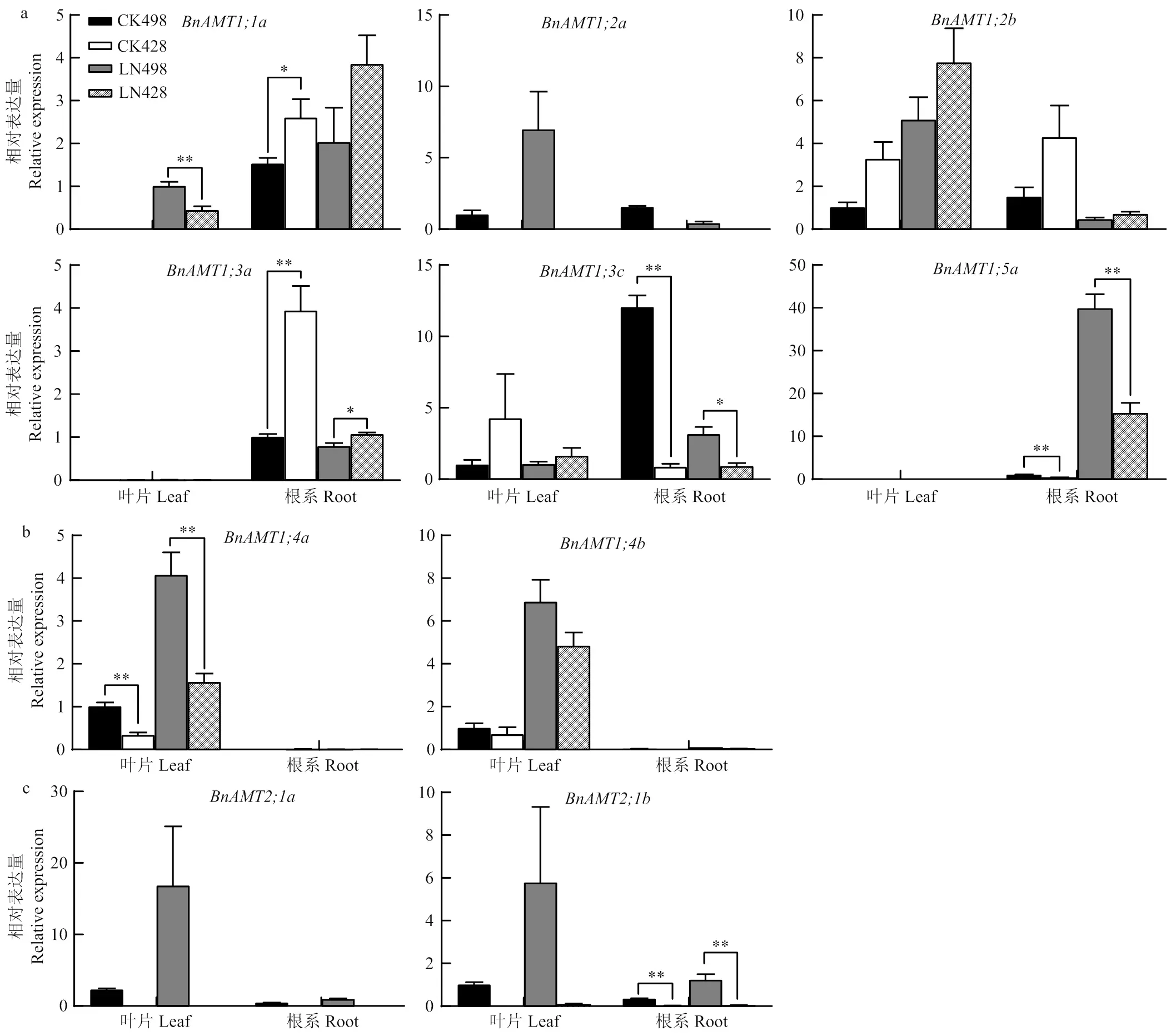
同时,与正常供氮处理相比,低氮处理下油菜、、和的表达上调(图8),这类基因推测共同参与NH4+的吸收和转运,说明在低氮处理下油菜对NH4+的吸收和转运能力可能增强。
进一步比较发现,氮吸收转运相关基因在不同氮效率油菜种质中的表达存在一定差异(图6—8)。主要表现在:与氮低效种质‘428’相比,正常供氮下,低亲和硝酸盐转运蛋白基因和在氮高效种质‘498’根系中的表达水平更高(图6-a);而在低氮处理下,高亲和硝酸盐转运蛋白基因、和在氮高效种质‘498’根系中的相对表达水平反而更低(图6-b),说明正常供氮条件下,‘498’对硝酸盐的吸收表现出较强优势,这与15N同位素标记结果一致(图4)。而在低氮处理下氮低效种质根系中高亲和转运蛋白基因上调可能与其对外界低氮胁迫较为敏感相关。同时,可以看到,低氮胁迫下在氮低效种质‘428’中的表达量较高(图6-c),说明‘428’将NO3-从根系排出外部环境的能力相对较强。
用于检测NO3-转运和再分配相关基因相对表达量的样本为油菜物候生长期16时收获的功能叶和根系样本。根据拟南芥NPFs基因功能研究报道对油菜NPFs基因进行功能分类,包括a:调控NO3-在木质部转运;b:调控NO3-在叶片和叶柄中积累,介导NO3-从木质部向韧皮部的转移以及从源叶向库叶的再分配。*表示P<0.05;**表示P<0.01
另一方面,可以看到,正常供氮处理下‘498’根系中和的相对表达量显著高于‘428’中的表达;而在低氮处理下,‘498’中相对表达量显著高于‘428’中的表达(图7-a)。这一类基因在拟南芥中的同源基因主要是负责木质部NO3-的装载与卸载[33-34],暗示低氮处理下‘498’在木质部NO3-转运上表现出较强的优势。此外,可以看到,低氮胁迫下氮高效油菜种质‘498’叶片组织中的相对表达量更高(尤其差异显著)(图6-b,图7-b),这类基因介导NO3-从木质部向韧皮部的转移以及从源叶向库叶的再分配,调控NO3-在叶片和叶、柄中积累(和也参与NO3-的再分配)[27],说明低氮胁迫下‘498’对NO3-的再分配能力可能更强。
植物对NH4+的吸收是通过AMT转运体(定位于细胞质膜上)来完成的。比较氮效率差异种质中基因表达发现,不同供氮处理下,与氮低效种质‘428’相比,氮高效种质‘498’中和相对表达量较高,其中在氮低效种质‘428’中几乎检测不到表达量(图8)。同时,同位素示踪试验表明,‘498’对NH4+的吸收能力较强(图4),这些基因较高的表达水平可能有利于油菜对NH4+的吸收和转运。
用于检测NH4+吸收转运相关基因相对表达量的样本为油菜物候生长期16时收获的功能叶和根系样本。根据拟南芥基因功能研究报道对油菜基因进行功能分类,包括a:高亲和NH4+吸收;b:在叶片中调控NH4+转运;c:有一定的低亲和NH4+吸收功能,主要参与根到茎的NH4+转运。*表示<0.05;**表示<0.01
The samples (functional leaves and roots) used to detect the relative expression of genes involved in NH4+uptake and transport were harvested at BBCH 16 stage.Functional classification of rapeseedgene was conducted according to the previous studies ofgene in, including: a: High-affinity NH4+uptake; b: Regulating NH4+transport in leaves; c: It has low-affinity NH4+absorption function, mainly involved in the NH4+transport from root to stem.*represents<0.05; ** represents<0.01
图8 不同氮浓度下氮效率差异油菜种质负责NH4+吸收转运相关基因表达分析
Fig.8 Expression analysis of genes related to NH4+uptake and transport in rapeseed germplasms with contrasting N efficiency under different N concentrations
根据本研究结果初步对油菜苗期氮高效可能的机理进行总结,如图9所示,氮高效油菜‘498’具有较为发达的根系,主要体现在其主根长、总根长、根表面积、根体积和侧根数均显著高于氮低效种质。并且与氮低效种质‘428’相比,氮高效种质‘498’对NO3-和NH4+的吸收累积表现出一定优势,这可能与一些氮吸收运转相关基因(和)在氮效率差异油菜种质中的表达水平差异有关。综上所述,油菜种质中根系形态及氮转运蛋白基因表达的差异都可能影响油菜苗期对氮的吸收运转,进而影响油菜苗期生长发育。
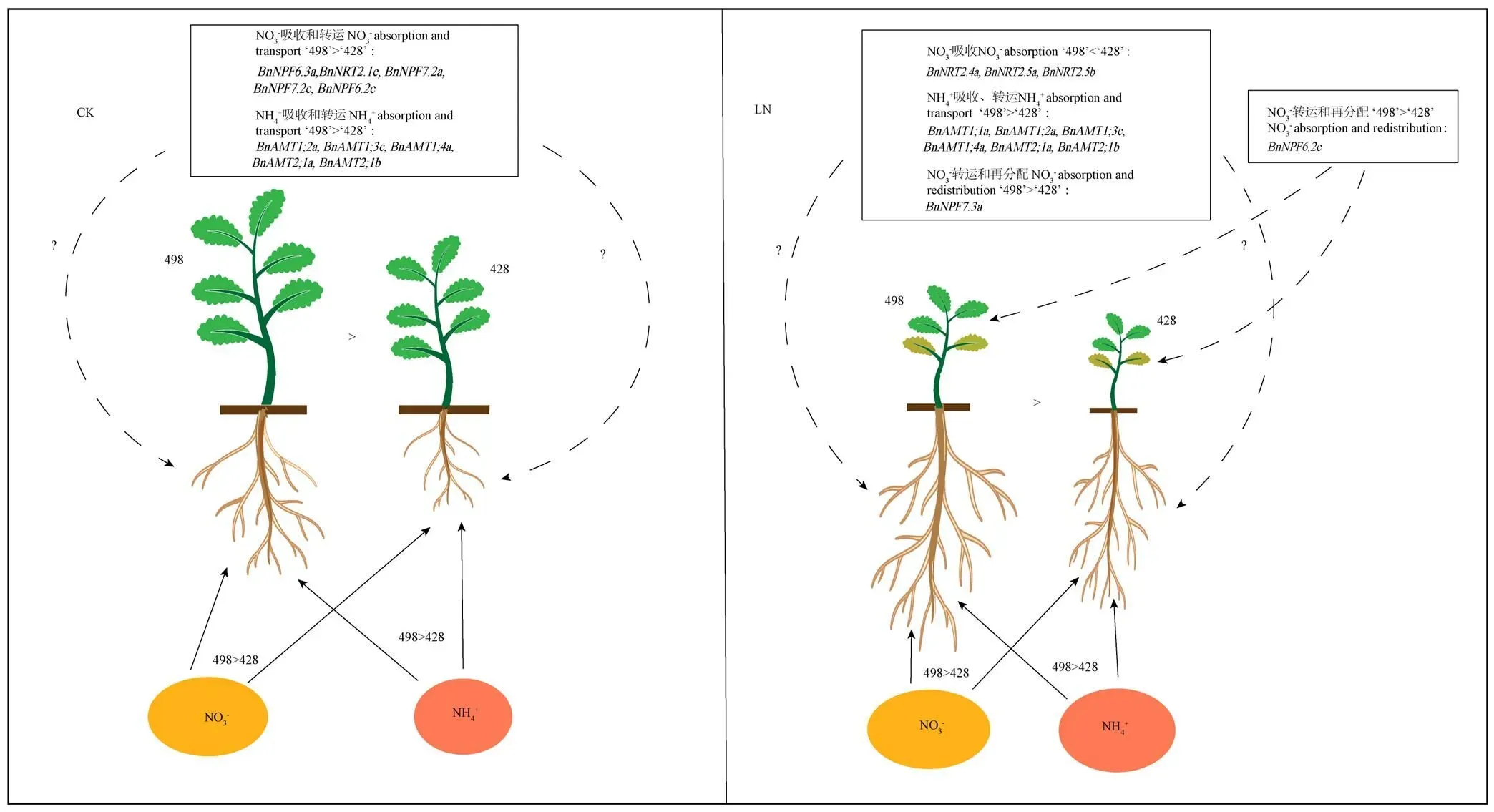
实线表示根系对氮素的吸收,虚线表示在氮效率差异油菜种质在根系或叶片中差异表达的转运蛋白基因
3 讨论
3.1 根系形态差异是造成油菜氮效率差异的基础
根系是植物吸收土壤养分的主要器官,它们的大小和分布影响着植物对土壤养分的获取[13]。根系形态与氮素吸收关系密切,这在许多作物上都有类似发现,如康亮等研究表明,发达的根系有利于提高木薯对氮素的吸收[6];同时,刘代平等也发现油菜氮效率与根体积、根吸收表面积密切相关[7];熊淑萍等也证明较高的根系生物量、根系活力、根系总吸收面积和根系活跃吸收面积有利于氮高效基因型小麦对氮素的吸收[8]。这充分说明发达的根系是氮素高效吸收利用的基础,根系形态与氮素的吸收利用密切相关。本研究发现氮胁迫会促进根系发育(图3),这在其他作物上已得到证实[25,35-36];但是吴宇等研究表明低氮处理下,水稻根系向地上部运输铵态氮的能力降低[35],同时本研究也发现,与正常供氮相比,低氮处理下油菜地上部和根部15N累积量下降(图4)。相关资料表明,根系吸收氮的整体效率不仅取决于根系构型,还取决于光合作用提供的碳的可用性[5]。说明低氮胁迫虽然会促进油菜根系发育,但由于地上部生长受到严重抑制,光合碳同化过程受阻,不能提供足够的光合产物供给根系,导致油菜对氮素的吸收能力下降。对油菜而言,如何更好地协调根系和地上部生长可能是其应对低氮胁迫的适应性机理。
许多作物上的研究表明,相较于氮低效品种,氮高效品种具有更发达的根系。如王改丽等研究发现,氮高效油菜种质的总根长、根表面积和根体积均显著大于氮低效种质[25];康亮等研究也表明氮高效型木薯品种的总根长、根系体积和根系表面积均显著大于氮低效型木薯品种[6];魏海燕等研究也指出氮高效水稻的根系干重、根系体积、总吸收表面积等均显著大于氮低效水稻[37];在本研究中,不同氮浓度下,与氮低效种质‘428’相比,氮高效种质‘498’根系发育均表现出明显优势,其氮吸收效率也更高,尤其是在低氮处理下,从物候生长期12就表现出差异(表1),进一步的15N同位素示踪试验结果也表明,氮高效种质‘498’对N(尤其是NH4+)的吸收利用能力强于氮低效种质‘428’(图4)。进一步说明发达的根系可以促进油菜对氮的吸收,为植株生长提供更多的营养物质。
油菜是喜硝作物,但是在供应硝态氮的条件下适当添加铵态氮(75%NO3-+ 25%NH4+)能够促进油菜生长、增强光合作用、提高产量[38]。本研究中15N示踪技术使用的营养液中硝铵比为1﹕1(图4),相较于氮低效种质‘428’,氮高效种质‘498’对NH4+的吸收表现出明显优势。众所周知,植物吸收硝态氮是需要消耗较多能力的主动吸收过程,而对铵态氮的吸收能量消耗较少[39],同时,油菜苗期干物质积累较少,适当添加铵态氮能降低油菜的能量消耗,从而促进干物质累积[38],因此推测‘498’对NH4+的吸收优势可能有利于其苗期的生物量积累。值得注意的是,15N同位素示踪试验中,除了正常供氮处理下氮高效种质‘498’根系中15NO3-累积量显著高于‘428’,其他处理下氮高效种质‘498’的15NO3-累积量虽然表现出高于氮低效种质‘428’,但是差异并不显著(图4),可能的原因是处理时间较短,‘498’对15NO3-的吸收转运优势没有完全体现。
顾炽明等研究表明,相较于氮利用效率,氮吸收效率高更有利于油菜苗期生物量积累[24];LI等研究也发现,较高的氮吸收利用效率、维持光合作用和协调的C/N代谢有助于提高油菜的氮效率[40]。这与本研究结果相吻合,说明维持较高的氮吸收效率对油菜苗期的生长发育更为重要,而根系发育在油菜氮吸收效率上起着重要的作用,这为今后通过遗传改良提高油菜氮效率提供了参考方向。
3.2 氮转运蛋白基因与油菜氮效率的关系
为进一步探明氮高效油菜对氮素的吸收优势是否与氮转运蛋白基因相关,本研究分析了、和等基因在氮效率差异油菜叶片和根系中的表达差异。拟南芥中硝酸盐转运蛋白基因的研究较为广泛,已鉴定的NPF家族成员有53个,NRT2 有7个,到目前为止,大部分基因的功能已被揭示。本研究根据拟南芥已报道的基因序列[27],在油菜中鉴定了对应的同源基因并开展研究。通过比较硝酸盐转运蛋白基因在氮效率差异油菜中的表达差异发现,在正常供氮处理下,与氮低效种质‘428’相比,氮高效种质‘498’中参与NO3-的吸收、转运相关基因的相对表达量较高;而低氮处理下,‘498’中参与NO3-吸收的基因相对表达量虽然低于‘428’,但是调控NO3-转运和再分配的基因相对表达量较高(图 6和图7),这可能是‘498’具有更高氮累积量的原因之一。
在硝酸盐转运蛋白方面,VERA等[41]研究表明,水稻中3个同源基因在对氯酸盐的吸收和接收其他硝酸盐转运体的表达信号上表现出不同的能力;此外,Hu等研究发现,的变异在很大程度上解释了籼稻和粳稻之间硝酸盐利用的差异,-indica能够提高粳稻的氮素利用效率[42]。在本研究中,()在油菜叶片和根系中均有表达,低氮处理下,叶片中表达明显上调,而根系中表达下调(图 6),因此,猜测在根系中主要负责NO3-吸收,而在叶片中负责接收其他硝酸盐转运体的表达信号,对NO3-的吸收和转运起调控作用;与氮低效种质‘428’相比,氮高效种质‘498’中的表达水平更高,张玉莹等研究也有类似的发现[20],说明的表达可能有利于油菜NO3-的吸收和转运。此外,在拟南芥中的研究表明,基因缺失突变体chl1-5具有氯酸盐耐受性,并能破坏基因表达的信号通路[43];LI等研究发现,氮饥饿处理下,氮高效油菜中的表达上调,而氮低效油菜无显著变化[40]。本研究发现低氮处理下,油菜根系中的表达明显上调,而的表达明显下调,‘498’和‘428’的变化趋势一致,这与LI等研究结果存在一定出入,基因对低氮胁迫的响应差异是否与处理时期或者低氮的处理程度相关,有待进一步研究验证。
在拟南芥中,硝酸盐在木质部的长距离运输,被认为与两个NPF转运蛋白相关,其中AtNPF7.3(NRT1.5)负责将NO3-从中柱鞘运出,装载到木质部,转运到地上部分[44],而AtNPF7.2(NRT1.8)的作用与AtNPF7.3相反,通过卸载木质部中的NO3-来影响NO3-从根到地上部分的运输[34],两个基因共同影响了NO3-向上运输。ZHANG等研究表明,与氮低效油菜相比,氮高效油菜根系中的表达水平更高,而的表达水平更低;表达上调,而8表达下调,能促使更多的NO3-从根系向地上部长距离运输[19]。然而在本研究中,和对外界NO3-浓度变化的响应趋势与拟南芥等相似,但是()在两个氮效率差异种质中的表达水平与ZAHNG等的研究有所差异,与氮低效种质‘428’相比,氮高效种质‘498’根系中()和()的相对表达水平均更高,这可能与供试材料的氮效率差异特征及植株的生育阶段有一定关系。而在低氮处理下,氮低效种质‘428’根系中和(负责高亲和性NO3-吸收)的表达水平高于氮高效种质‘498’;然而,王改丽等研究发现,氮高效油菜中的表达水平显著高于氮低效油菜[9]。而本研究发现,在低氮处理下,‘498’和‘428’对NO3-的吸收能力无显著差异(图4),这可能由油菜种质、取样时间和培养条件不同等多方面因素导致。
除了硝态氮之外,铵态氮也是植物吸收的主要无机氮源之一,但是过量吸收会对细胞产生毒害,因此,它的吸收和吸收受到严格的控制[32]。系统进化分析表明,植物AMT蛋白可分为两大类:AMT1与AMT2家族,AMT1和AMT2成员之间可能存在一定的功能重叠或互补,共同调节植物对铵态氮的吸收,维持植物体内铵态氮的稳定[45]。在拟南芥中,AMT1型蛋白AtAMT1;1, AtAMT1;2, AtAMT1;3和AtAMT1;5是根系负责高亲和性铵吸收的主要转运蛋白[46-47],AtAMT2;1除了在低亲和力范围内对根的吸收有一定的贡献外,还参与根到茎的铵转运[48]。本研究结果表明,不同供氮处理下,氮高效油菜种质‘498’对NH4+的吸收、累积表现出较强的优势(图4)。进一步分析发现,和以及和在‘498’根系中的相对表达量高于‘428’,其中在‘428’中几乎不表达(图 8),说明这些基因表达可能有利于氮高效油菜对NH4+的吸收和转运;然而,与‘498’相比,在氮低效种质中的相对表达量较高,并且在叶片和根系中的表达呈现出相反的趋势,是否暗示基因在氮效率差异种质中可能存在不同的适应低氮胁迫及调控铵稳态的机制,有待进一步深入研究。拟南芥中的研究表明,NH4+在侧根发育中与硝酸盐形成互补,其对侧根发育的促进作用依赖AMT1;3[49],在本研究中,与侧根发育可能相关的同源基因和在‘498’和‘428’中的表达水平呈现出相反的趋势,两个基因是否会影响油菜侧根发育,作用机理有待深入解析。AtAMT1;4介导了花粉质膜对铵的吸收,并通过铵的吸收或再利用促进了花粉的氮营养[50]。值得注意的是,‘498’叶片中的表达水平高于‘428’。据报道,大白菜里的同源基因在叶片NH4+转运中发挥重要作用[51],说明油菜‘498’叶片对NH4+的转运能力可能强于‘428’。
综上所述,油菜氮吸收转运基因的表达差异可能影响其对硝态氮或铵态氮的吸收运转,从而影响油菜对氮素的吸收积累,具体的分子机理有待通过对关键基因开展进一步深入的功能研究来阐明。
4 结论
与氮低效油菜‘428’相比,氮高效油菜‘498’具有较为发达的根系,主要体现在其主根长、总根长、根表面积、根体积和侧根数均显著高于氮低效种质。与氮低效种质‘428’相比,氮高效种质‘498’对NO3-和NH4+的吸收累积表现出一定优势。正常供氮处理下,参与NO3-、NH4+吸收转运的基因在油菜‘498’中表达相对较高,而低氮处理下参与NO3-转运与再分配及NH4+吸收转运的基因在油菜‘498’中相对表达量显著高于‘428’,说明‘498’相对较高的氮吸收效率可能与部分和基因的高表达水平相关。综上所述,油菜种质根系形态及氮转运蛋白基因表达的差异都可能影响油菜苗期对氮的吸收运转,进而影响油菜苗期的生长发育。不同功能氮转运蛋白基因的协同作用,是维持油菜氮高效吸收转运效率的重要因素之一。
[1] 王汉中.以新需求为导向的油菜产业发展战略.中国油料作物学报, 2018, 40(5): 613-617.doi:10.7505/j.issn.1007-9084.2018.05.001.
WANG H Z.New-demand oriented oilseed rape industry developing strategy.Chinese Journal of Oil Crop Sciences, 2018, 40(5): 613-617.doi:10.7505/j.issn.1007-9084.2018.05.001.(in Chinese)
[2] BOUCHET A S, LAPERCHE A, BISSUEL-BELAYGUE C, SNOWDON R, NESI N, STAHL A.Nitrogen use efficiency in rapeseed.A review.Agronomy for Sustainable Development, 2016, 36(2): 1-20.doi:10.1007/s13593-016-0371-0.
[3] LASSALETTA L, BILLEN G, GRIZZETTI B, ANGLADE J, GARNIER J.50 year trends in nitrogen use efficiency of world cropping systems: the relationship between yield and nitrogen input to cropland.Environmental Research Letters, 2014, 9(10): 105011.doi:10.1088/1748-9326/9/10/105011.
[4] 朱兆良, 金继运.保障我国粮食安全的肥料问题.植物营养与肥料学报, 2013, 19(2): 259-273.doi:10.11674/zwyf.2013.0201.
ZHU Z L, JIN J Y.Fertilizer use and food security in China.Plant Nutrition and Fertilizer Science, 2013, 19(2): 259-273.doi:10.11674/ zwyf.2013.0201.(in Chinese)
[5] XU G H, FAN X R, MILLER A J.Plant nitrogen assimilation and use efficiency.Annual Review of Plant Biology, 2012, 63: 153-182.doi:10.1146/annurev-arplant-042811-105532.
[6] 康亮, 梁琼月, 姚一华, 蒋强, 董蒙蒙, 顾明华, 何冰.不同氮效率木薯品种根系形态、构型及氮吸收动力学特征.植物营养与肥料学报, 2019, 25(11): 1920-1928.doi:10.11674/zwyf.19024.
KANG L, LIANG Q Y, YAO Y H, JIANG Q, DONG M M, GU M H, HE B.Root morphology, configuration and nitrogen absorption kinetics of cassava cultivars with different nitrogen efficiencies.Journal of Plant Nutrition and Fertilizers, 2019, 25(11): 1920-1928.doi:10.11674/zwyf.19024.(in Chinese)
[7] 刘代平, 宋海星, 刘强, 荣湘民, 彭建伟, 谢桂先, 刘浩荣.油菜根系形态和生理特性与其氮效率的关系.土壤, 2008, 40(5): 765-769.doi:10.3321/j.issn: 0253-9829.2008.05.015.
LIU D P, SONG H X, LIU Q, RONG X M, PENG J W, XIE G X, LIU H R.Relationship between root morphologic and physiological properties and nitrogen efficiency of oilseed rape cultivars.Soils, 2008, 40(5): 765-769.doi:10.3321/j.issn: 0253-9829.2008.05.015.(in Chinese)
[8] 熊淑萍, 吴克远, 王小纯, 张捷, 杜盼, 吴懿鑫, 马新明.不同氮效率基因型小麦根系吸收特性与氮素利用差异的分析.中国农业科学, 2016, 49(12): 2267-2279.doi:10.3864/j.issn.0578-1752.2016.12.003.
XIONG S P, WU K Y, WANG X C, ZHANG J, DU P, WU Y X, MA X M.Analysis of root absorption characteristics and nitrogen utilization of wheat genotypes with different N efficiency.Scientia Agricultura Sinica, 2016, 49(12): 2267-2279.doi:10.3864/j.issn.0578-1752.2016.12.003.(in Chinese)
[9] WANG G L, DING G D, LI L, CAI H M, YE X S, ZOU J, XU F S.Identification and characterization of improved nitrogen efficiency in interspecific hybridized new-type.Annals of Botany, 2014, 114(3): 549-559.doi:10.1093/aob/mcu135.
[10] KAMH M, WIESLER F, ULAS A, HORST W J.Root growth and N-uptake activity of oilseed rape (L.) cultivars differing in nitrogen efficiency.Journal of Plant Nutrition and Soil Science, 2005, 168(1): 130-137.doi:10.1002/jpln.200421453.
[11] 刘强, 宋海星, 荣湘民, 彭建伟, 谢桂先.不同品种油菜氮效率差异及其生理基础研究.植物营养与肥料学报, 2008, 14(1): 113-119.doi:10.3321/j.issn: 1008-505X.2008.01.018.
LIU Q, SONG H X, RONG X M, PENG J W, XIE G X.Differences in nitrogen use efficiency among different rape varieties and their physiological basis.Plant Nutrition and Fertilizer Science, 2008, 14(1): 113-119.doi:10.3321/j.issn: 1008-505X.2008.01.018.(in Chinese)
[12] 洪娟.油菜氮高效种质的筛选及其生理机制的初步研究[D].武汉: 华中农业大学, 2007.
HONG J.Screening of nitrogen efficient germplasm and preliminary study on its phsiological mechanism in rapeseed[D].Wuhan: Huazhong Agricultural University, 2007.(in Chinese)
[13] TENG W, HE X, TONG Y P.Transgenic approaches for improving use efficiency of nitrogen, phosphorus and potassium in crops.Journal of Integrative Agriculture, 2017, 16(12): 2657-2673.doi:10.1016/ S2095-3119(17)61709-X.
[14] FAN X R, NAZ M, FAN X R, XUAN W, MILLER A J, XU G H.Plant nitrate transporters: from gene function to application.Journal of Experimental Botany, 2017, 68(10): 2463-2475.doi:10.1093/jxb/ erx011.
[15] TSAY Y F, CHIU C C, TSAI C B, HO C H, HSU P K.Nitrate transporters and peptide transporters.FEBS Letters, 2007, 581(12): 2290-2300.doi:10.1016/j.febslet.2007.04.047.
[16] LIU K H, TSAY Y F.Switching between the two action modes of the dual-affinity nitrate transporter CHL1 by phosphorylation.The EMBO Journal, 2003, 22(5): 1005-1013.doi:10.1093/emboj/cdg118.
[17] LÉRAN S, VARALA K, BOYER J C, CHIURAZZI M, CRAWFORD N, DANIEL-VEDELE F, DAVID L, DICKSTEIN R, FERNANDEZ E, FORDE B, GASSMANN W, GEIGER D, GOJON A, GONG J M, HALKIER B A, HARRIS J M, HEDRICH R, LIMAMI A M, LACOMBE B.A unified nomenclature of NITRATE TRANSPORTER 1/PEPTIDE TRANSPORTER family members in plants.Trends in Plant Science, 2014, 19(1): 5-9.doi:10.1016/j.tplants.2013.08.008.
[18] LUDEWIG U, NEUHÄUSER B, DYNOWSKI M.Molecular mechanisms of ammonium transport and accumulation in plants.FEBS Letters, 2007, 581(12): 2301-2308.doi:10.1016/j.febslet.2007.03.034.
[19] HAN Y L, SONG H X, LIAO Q, YU Y, JIAN S F, LEPO J E, LIU Q, RONG X M, TIAN C, ZENG J, GUAN C Y, ISMAIL A M, ZHANG Z H.Nitrogen use efficiency is mediated by vacuolar nitrate sequestration capacity in roots of.Plant Physiology, 2016, 170(3): 1684-1698.doi:10.1104/pp.15.01377.
[20] 张玉莹.不同氮效率油菜NRT基因的表达差异研究[D].杨凌: 西北农林科技大学, 2013.
ZHANG Y Y.The expression differences study on the NRT rape genes of different nitrogen efficiency[D].Yangling: Northwest A & F University, 2013.(in Chinese)
[21] 徐子先.甘蓝型油菜氮效率评价及其差异的生理机制探究[D].北京: 中国农业科学院, 2017.
XU Z X.Researches on nitrogen efficiency evaluation in rapeseed (L.) germplasm and its physiological mechanism[D].Beijing: Chinese Academy of Agricultural Sciences, 2017.(in Chinese)
[22] MEIER U.Growth stages of mono-and dicotyledonous plants.2001.https://www.politicheagricole.it/flex/AppData/WebLive/Agrometeo/MIEPFY800/BBCHengl2001.pdf.
[23] 鲍士旦.土壤农化分析.3版.北京: 中国农业出版社, 2000.
BAO S D.Soil and Agricultural Chemistry Analysis.Beijing: Chinese Agriculture Press, 2000.(in Chinese)
[24] 顾炽明, 韩配配, 胡琼, 李银水, 廖祥生, 张志华, 谢立华, 胡小加, 秦璐, 廖星.甘蓝型油菜苗期氮效率评价.中国油料作物学报, 2018, 40(6): 851-860.doi:10.7505/j.issn.1007-9084.2018.06.015.
GU C M, HAN P P, HU Q, LI Y S, LIAO X S, ZHANG Z H, XIE L H, HU X J, QIN L, LIAO X.Nitrogen efficiency evaluation in rapeseed (L.) at seedling stage.Chinese Journal of Oil Crop Sciences, 2018, 40(6): 851-860.doi:10.7505/j.issn.1007-9084.2018.06.015.(in Chinese)
[25] 王改丽.新型甘蓝型油菜氮高效种质的筛选及其氮高效机制的研究[D].武汉: 华中农业大学, 2014.
WANG G L.Screening of high nitrogen efficient germplasms and its mechanism in new-type[D].Wuhan: Huazhong Agricultural University, 2014.(in Chinese)
[26] 晏娟, 沈其荣, 尹斌, 万新军.应用15N示踪技术研究水稻对氮肥的吸收和分配.核农学报, 2009, 23(3): 487-491, 496.
YAN J, SHEN Q R, YIN B, WAN X J.Fertilizer-n uptake and distribution in rice plants using 15n tracer technique.Journal of Nuclear Agricultural Sciences, 2009, 23(3): 487-491, 496.(in Chinese)
[27] O'BRIEN J A, VEGA A, BOUGUYON E, KROUK G, GOJON A, CORUZZI G, GUTIÉRREZ R A.Nitrate transport, sensing, and responses in plants.Molecular Plant, 2016, 9(6): 837-856.doi:10.1016/j.molp.2016.05.004.
[28] LU K, LI T, HE J, CHANG W, ZHANG R, LIU M, YU M N, FAN Y H, MA J Q, SUN W, QU C M, LIU L Z, LI N N, LIANG Y, WANG R, QIAN W, TANG Z L, XU X F, LEI B, ZHANG K, LI J N.qPrimerDB: a thermodynamics-based gene-specific qPCR primer database for 147 organisms.Nucleic Acids Research, 2017, 46(D1): D1229-D1236.doi:10.1093/nar/gkx725.
[29] TONG J F, WALK T C, HAN P P, CHEN L Y, SHEN X J, LI Y S, GU C M, XIE L H, HU X J, LIAO X, QIN L.Genome-wide identification and analysis of high-affinity nitrate transporter 2 (NRT2) family genes in rapeseed (L.) and their responses to various stresses.BMC Plant Biology, 2020, 20(1): 464.doi:10.1186/s12870-020- 02648-1.
[30] HU J H, ZHANG F G, GAO G Z, LI H, WU X M.Auxin-related genes associated with leaf petiole angle at the seedling stage are involved in adaptation to low temperature in.Environmental and Experimental Botany, 2021, 182: 104308.doi:10.1016/j.envexpbot.2020.104308.
[31] LIVAK K J, SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod.Methods, 2001, 25(4): 402-408.doi:10.1006/meth.2001.1262.
[32] TEGEDER M, MASCLAUX-DAUBRESSE C.Source and sink mechanisms of nitrogen transport and use.New Phytologist, 2018, 217(1): 35-53.doi:10.1111/nph.14876.
[33] LIN S H, KUO H F, CANIVENC G, LIN C S, LEPETIT M, HSU P K, TILLARD P, LIN H L, WANG Y Y, TSAI C B, GOJON A, TSAY Y F.Mutation of theNRT1.5 nitrate transporter causes defective root-to-shoot nitrate transport.The Plant Cell, 2008, 20(9): 2514-2528.doi:10.1105/tpc.108.060244.
[34] LI J Y, FU Y L, PIKE S M, BAO J, TIAN W, ZHANG Y, CHEN C Z, ZHANG Y, LI H M, HUANG J, LI L G, SCHROEDER J I, GASSMANN W, GONG J M.Thenitrate transporter NRT1.8 functions in nitrate removal from the xylem sap and mediates cadmium tolerance.The Plant Cell, 2010, 22(5): 1633-1646.doi:10.1105/tpc.110.075242.
[35] 吴宇.低氮诱导的水稻根系形态解剖结构变化及其对氮素吸收分配的影响[D].武汉: 华中农业大学, 2020.
WU Y.Low nitrogen induced changes of morphological and anatomical characterics and its effects on nitrogen uptake and distribution in rice[D].Wuhan: Huazhong Agricultural University, 2020.(in Chinese)
[36] 岳慧芳, 任永哲, 李乐, 王新博, 吕伟增, 龚璞, 王志强, 辛泽毓, 林同保.不同基因型小麦品种根系形态对低氮胁迫的响应.河南农业大学学报, 2017, 51(4): 447-452.doi:10.16445/j.cnki.1000-2340.2017.04.001.
YUE H F, REN Y Z, LI L, WANG X B, LÜ W Z, GONG P, WANG Z Q, XIN Z Y, LIN T B.The response of root morphological traits to low nitrogen stress in different genotypic wheat cultivars.Journal of Henan Agricultural University, 2017, 51(4): 447-452.doi:10.16445/ j.cnki.1000-2340.2017.04.001.(in Chinese)
[37] 魏海燕, 张洪程, 张胜飞, 杭杰, 戴其根, 霍中洋, 许轲, 马群, 张庆, 刘艳阳.不同氮利用效率水稻基因型的根系形态与生理指标的研究.作物学报, 2008, 34(3): 429-436.doi:10.3321/j.issn: 0496-3490.2008.03.013.
WEI H Y, ZHANG H C, ZHANG S F, HANG J, DAI Q G, HUO Z Y, XU K, MA Q, ZHANG Q, LIU Y Y.Root morphological and physiological characteristics in rice genotypes with different N use efficiencies.Acta Agronomica Sinica, 2008, 34(3): 429-436.doi:10.3321/j.issn: 0496-3490.2008.03.013.(in Chinese)
[38] 唐伟杰, 官春云, 林良斌, 李丽萍, 张振华, 王峰, 肖钢, 李博, 刘屹湘.不同硝铵比对油菜生长、生理与产量的影响.植物营养与肥料学报, 2018, 24(5): 1338-1348.doi:10.11674/zwyf.17495.
TANG W J, GUAN C Y, LIN L B, LI L P, ZHANG Z H, WANG F, XIAO G, LI B, LIU Y X.Effects of nitrate and ammonium supply ratios on growth, physiology and yield of oilseed rape (L.).Journal of Plant Nutrition and Fertilizers, 2018, 24(5): 1338-1348.doi:10.11674/zwyf.17495.(in Chinese)
[39] 李生秀.中国旱地土壤植物氮素.北京: 科学出版社, 2008.
LI S X.Soil and Plant Nitrogen in Dryland Areas of China.Beijing: Science Press, 2008.(in Chinese)
[40] LI Q, DING G D, YANG N M, WHITE P J, YE X S, CAI H M, LU J W, SHI L, XU F S.Comparative genome and transcriptome analysis unravels key factors of nitrogen use efficiency inL.Plant, Cell & Environment, 2020, 43(3): 712-731.doi:10.1111/pce.13689.
[41] VERA J S, SPERANDIO M V L, FERNANDES M S, SANTOS L A.Overexpression of rice genes OsNRT1.1A and OsNRT1.1B restores chlorate uptake and NRT2.1/NAR2.1 expression inchl1-5 mutant.Journal of Plant Growth Regulation, 2021, 40(4): 1701-1713.doi:10.1007/s00344-020-10219-9.
[42] HU B, WANG W, OU S J, TANG J Y, LI H, CHE R H, ZHANG Z H, CHAI X Y, WANG H R, WANG Y Q, LIANG C Z, LIU L C, PIAO Z Z, DENG Q Y, DENG K, XU C, LIANG Y, ZHANG L H, LI L G, CHU C C.Variation in NRT1.1B contributes to nitrate-use divergence between rice sub species.Nature Genetics, 2015, 47(7): 834-838.doi:10.1038/ng.3337.
[43] HO C H, LIN S H, HU H C, TSAY Y F.CHL1 functions as a nitrate sensor in plants.Cell, 2009, 138(6): 1184-1194.doi:10.1016/j.cell.2009.07.004.
[44] ZHENG Y, DRECHSLER N, RAUSCH C, KUNZE R.Thenitrate transporter NPF7.3/NRT1.5 is involved in lateral root development under potassium deprivation.Plant Signaling & Behavior, 2016, 11(5): e1176819.doi:10.1080/15592324.2016.1176819.
[45] ZHOU Y, BAI L, SONG C P.Ammonium homeostasis and signaling in plant cells.Science Bulletin, 2015, 60(8): 741-747.doi:10.1007/ s11434-015-0759-2.
[46] LOQUÉ D, YUAN L X, KOJIMA S, GOJON A, WIRTH J, GAZZARRINI S, ISHIYAMA K, TAKAHASHI H, VON WIRÉN N.Additive contribution of AMT1;1 and AMT1;3 to high-affinity ammonium uptake across the plasma membrane of nitrogen-deficientroots.The Plant Journal, 2006, 48(4): 522-534.doi:10.1111/j.1365-313x.2006.02887.x.
[47] YUAN L X, LOQUÉ D, KOJIMA S, RAUCH S, ISHIYAMA K, INOUE E, TAKAHASHI H, VON WIRÉN N.The organization of high-affinity ammonium uptake inroots depends on the spatial arrangement and biochemical properties of AMT1-type transporters.The Plant Cell, 2007, 19(8): 2636-2652.doi:10.1105/tpc.107.052134.
[48] GIEHL R F H, LAGINHA A M, DUAN F Y, RENTSCH D, YUAN L X, VON WIRÉN N.A critical role of AMT2;1 in root-to-shoot translocation of ammonium in.Molecular Plant, 2017, 10(11): 1449-1460.doi:10.1016/j.molp.2017.10.001.
[49] LIMA J E, KOJIMA S, TAKAHASHI H, VON WIRÉN N.Ammonium triggers lateral root branching inin an AMMONIUM TRANSPORTER1;3-dependent manner.The Plant Cell, 2010, 22(11): 3621-3633.doi:10.1105/tpc.110.076216.
[50] YUAN L X, GRAFF L, LOQUÉ D, KOJIMA S, TSUCHIYA Y N, TAKAHASHI H, VON WIRÉN N.AtAMT1;4, a pollen-specific high-affinity ammonium transporter of the plasma membrane in.Plant and Cell Physiology, 2008, 50(1): 13-25.doi:10.1093/pcp/pcn186.
[51] ZHONG L H, HUANG X M, ZHU Y N, KOU E F, LIU H C, SUN G W, CHEN R Y, SONG S W.Characterization and expression analysis of BcAMT1;4, an ammonium transporter gene in flowering Chinese cabbage.Horticulture, Environment, and Biotechnology, 2019, 60(4): 563-572.doi:10.1007/s13580-019-00155-3.
Characteristics of Efficient Nitrogen Uptake and Transport of Rapeseed at Seedling Stage
CHAO ChengSheng, WANG YuQian, SHEN XinJie, DAI Jing, GU ChiMing, LI YinShui, XIE LiHua, HU XiaoJia, QIN Lu*, LIAO Xing*
Oil Crops Research Institute, Chinese Academy of Agricultural Sciences /Key Laboratory of Biology and Genetics Improvement of Oil Crops, Ministry of Agriculture and Rural Affairs, Wuhan 430062
【Objective】Nitrogen (N) uptake efficiency is one of the important factors affecting crop N efficiency, investigating characteristics of efficient N uptake and transport was the purpose to provide the theoretical basis for improving N efficiency and yield of rapeseed (L.) varieties.【Method】To explore the mechanisms underlying high N uptake and transport in rapeseed, two rapeseed germplasms with contrasting N efficiency (N efficient germplasm ‘498’ and N inefficient germplasm ‘428’) were used in this study under normal N (9.5 mmol·L-1) and low N (0.475 mmol·L-1) conditions at three different growth stages (Phenological growth stages 12, 14 and 16) in hydroponic culture.At the same time, the15N isotope tracer technique was applied to study the uptake and transport capacity of NO3−and NH4+.Additionally, the expression level of genes (,and)related to N uptake and transport in rapeseed germplasms with contrasting N efficiency were further analyzed by real-time quantitative PCR (RT-qPCR).【Result】Rapeseed germplasm ‘498’ showed superior advantages in plant growth and root development under different N concentrations, and the root morphological indexes (main root length, total root length, root surface area, root volume and lateral root number), biomass, N accumulation and N uptake efficiency were all significantly greater than those of germplasm ‘428’.15N isotope tracer test also showed that ‘498’ showed greater advantage in the uptake and accumulation of NO3-and NH4+, especially for NH4+, as indicated by the significant differences in the accumulation of15NH4+between two germplasms.The RT-qPCR analysis further found that under normal N conditions, the relative expressions of,,,,,,,;and(involved in the uptake and transport of NO3-and NH4+) was significantly higher in ‘498’ than that in ‘428’.While under low N stress, the relative expressions of,and(involved in NO3-uptake and transport) was significantly lower in the root of ‘498’ than that of ‘428’, but the expression level ofand(referred to NO3-transport and redistribution) was significantly higher in ‘498’ than that in ‘428’, as well as the expression level of,,,,and(involved in NH4+uptake and transport).【Conclusion】Compared with N-inefficient germplasm ‘428’, N-efficient germplasm ‘498’ were superior in root length, root surface area (volume) and lateral root number, additionally with greater ability in N (especially NH4+) uptake and accumulation.Under normal N application conditions, the expression of genes involved in NO3-and NH4+absorption and transport were relatively higher in ‘498’, while the relative expression of genes involved in the NO3-transport and redistribution as well as NH4+absorption and transport were significantly higher in ‘498’ than that in ‘428’ under low N stress, illustrating the relative higher N uptake efficiency of ‘498’ possibly linked to the higher expressions of severalsand.
rapeseed, high nitrogen efficiency, root morphology, uptake and transport, nitrogen transporter genes
2021-02-03;
2021-04-13
国家绿肥产业技术体系专项(CARS-22-05)、国家重点研发计划(2016YFD0100202-5)、中国农业科学院科技创新工程(CAASASTIP- 2013-OCRI)
巢成生,E-mail:chaocsxl@foxmail.com。通信作者秦璐,E-mail:qinlu@oilcrops.cn。通信作者廖星,E-mail:liaox@oilcrops.cn
(责任编辑 李云霞)

