利用Aag2细胞过表达体系筛选埃及伊蚊对DENV2易感相关免疫基因*
王 迪 谢晓雪 周新宇 赵 腾 郭晓霞 邢 丹 李春晓
(军事科学院军事医学研究院微生物流行病研究所,病原微生物生物安全国家重点实验室,媒介生物危害和自然疫源性疾病北京市重点实验室,北京 100071)
登革热被认为是人类流行性最强和传播最迅速的蚊媒病毒性疾病(Guzmanetal., 2015)。在过去的50年里,登革热的发病率增加了30倍,世界上100多个国家50%以上的人口生活在有DENV感染风险的地区(Harapanetal., 2020)。随着其传播范围、病例数量和病情严重程度的增加,登革热已成为影响社会和经济发展的重大公共卫生问题。埃及伊蚊是登革病毒(dengue virus,DENV)的主要传播媒介,它在城市中的扩散促进了登革热疫情在整个热带和亚热带地区的暴发(Bhattetal., 2013)。因此,控制传播媒介、切断传播途径是防控登革热疫情的重要措施。
DENV通常会导致人体出现病理性症状,而对埃及伊蚊不会产生明显的病理性改变(Pattersonetal., 2016)。埃及伊蚊对DENV的媒介效能取决于其允许病毒在组织细胞中感染、复制和传播的基因、分子和通路。DENV会使蚊虫产生先天免疫反应,从而改变其基因表达谱。因此,从其变化的基因入手,不仅可以研究DENV感染的免疫机制、阐明媒介效能的分子生物学机制,同时也可为靶向调控甚至阻断病毒在蚊虫体内的复制和传播提供理论基础。鉴于埃及伊蚊的胚胎源性细胞系Aag2和蚊虫个体的免疫特性相似,且可以持续维持DENV的复制,因此,Aag2细胞系是进行蚊虫感染DENV免疫研究的理想模型(Castillo-Méndezetal., 2020)。
根据抗原差异,DENV可以分为DENV1-4,4个血清型,其中DENV2比其他血清型更常见,可以引起更严重的登革热大流行(Rico-Hesse, 2003)。本研究中,在前期埃及伊蚊感染DENV2后中肠和唾液腺转录组学分析和Aag2细胞感染DENV2转录组分析的基础上,筛选出12个可能与埃及伊蚊感染DENV2调控相关的基因。利用Aag2细胞构建相应基因的过表达体系,进一步探究12个基因与DENV2感染的关系,寻找蚊虫与病毒相互作用中可能涉及的免疫调节基因,为后续研究某种基因对控制和减少蚊媒病毒在蚊虫种群内传播以及对人类宿主的传播提供理论依据。
1 材料与方法
1.1 实验材料
Aag2细胞系为实验室保存细胞系,长期传代培养,冻存于液氮罐中。DENV2由广东省疾病预防控制中心提供,保存于-80℃冰箱。SPF级1~2日龄昆明乳鼠和6~8周昆明雌鼠,为北京维通利华实验动物技术有限公司提供。所有程序均按照《动物护理与使用指导原则》(GB/T 35892-2018)进行,并经病原微生物生物安全国家重点实验室伦理委员会批准。蚊虫为海口株埃及伊蚊,由本实验室采集并长期传代饲养。
PSL1180polyUBdsRED质粒购自Addgene (Addgene plasmid # 49327)。目的基因表达量检测引物为自行设计,交由北京六合华大基因科技有限公司合成。无内毒素质粒大提试剂盒购自天根生化科技(北京)有限公司。胎牛血清(fetal bovine serum, FBS)、DMEM培养基(Dulbecco′s modified Eagle′s Medium)和SDM培养基(Schneider′s Drosophila Medium)购自赛默飞世尔科技有限公司。转染试剂FuGENE@6 Transfection Reagent(Promega,E2691)购自普洛麦格生物技术有限公司。TransScript® Green One-Step qRT-PCR SuperMix购自北京全式金生物技术股份有限公司。登革病毒Ⅱ型核酸免提取检测试剂盒购自北京三目生物科技有限公司。
1.2 乳鼠鼠脑DENV2病毒悬液制备及滴度检测
使用无菌注射器吸取DENV2悬液,从1~2日龄乳鼠脑颅眼睛到耳缘连线的中心点向脑颅方向注射0.01~0.02 mL,4~5 d发病后,将乳鼠解剖,左右脑组织分别放入EP管中,冷冻研磨仪60 Hz/45 s研磨2次,离心后收集上清放置-80 ℃冰箱冻存备用。
BHK-21细胞于10% FBS的DMEM培养基中常规传代培养(37 ℃, 5% CO2)。将BHK-21细胞传至12孔板培养24 h形成单层细胞后,将DENV2悬液按10-1、10-2、10-3、10-4、10-5、10-6梯度稀释后感染BHK-21细胞,培养5 d后观察。结晶紫和4%甲醛溶液按照14∶1混合,固定染色30 min。统计空斑数,计算病毒滴度,病毒滴度(PFU/mL)=(平均空斑数×空斑形成所在梯度)/0.1 mL(病毒悬液量)。
1.3 差异基因的筛选
在基因的选择上,根据前期研究结果,首先根据感染DENV2的埃及伊蚊中肠和唾液腺转录组与未感染DENV2的蚊虫中肠和唾液腺转录组进行对比的结果,筛选出10个基因表达差异倍数较大且调整P值<0.05的基因(表1)。其中,3个基因在唾液腺中表达下调,7个基因在唾液腺中表达上调;4个基因在中肠中表达下调,6个基因在中肠中表达上调。同时,根据Aag2细胞感染DENV2转录组测序分析结果(Lietal., 2020),同样筛选出2个表达差异较大的基因(表1)。其中,1个基因在Aag2细胞中表达下调,1个基因在Aag2细胞中表达上调。将上述12个感染DENV2后变化较大的基因CDS片段分别构建过表达质粒,得到可以进行瞬时转染的实验质粒载体,转染Aag2细胞使其能在几天内产生多个拷贝, 进行高水平的表达,从而研究目标基因对Aag2细胞感染DENV2的影响。
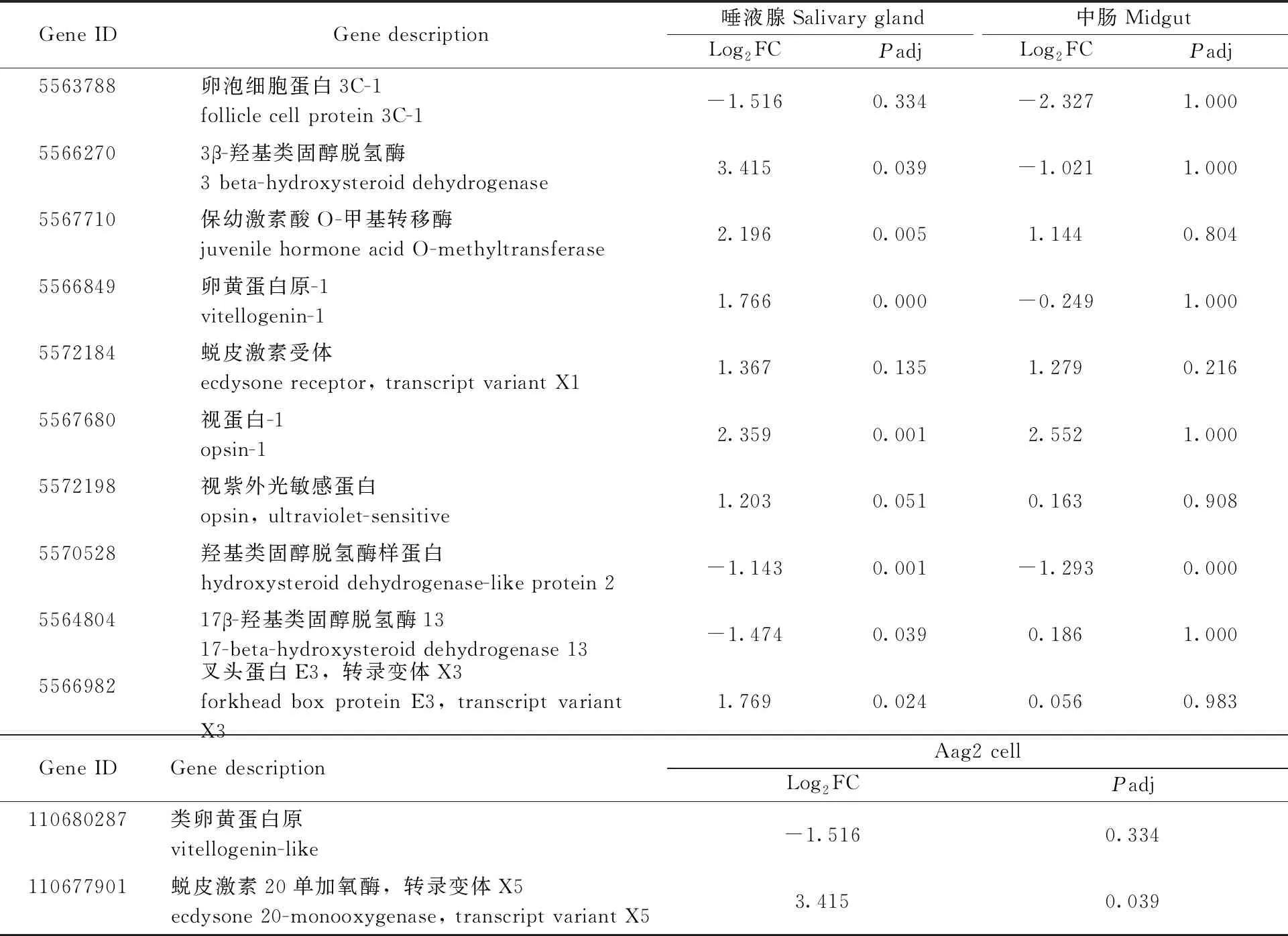
表1 根据转录组分析结果筛选的12个差异基因
1.4 质粒构建与提取
利用可表达红色荧光蛋白的PSL1180polyUBdsRED质粒构建实验质粒载体。首先应用Snapgene软件采用双酶切法(Tolmachov, 2009)加入增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)和嘌呤霉素两个位点。将目的基因的CDS片段替换EGFP位点构建为实验质粒,以未替换EGFP位点为对照质粒,实验和对照质粒设计由生工生物(上海)股份有限公司合成。质粒提取参照说明书使用无内毒素质粒大提试剂盒进行提取。
1.5 Aag2细胞过表达体系的构建
埃及伊蚊Aag2细胞于10% FBS的SDM培养基中常规传代培养(28 ℃, 5%CO2)。使用含2% FBS的SDM培养基将Aag2细胞洗脱并吹打混匀,采用自动细胞计数仪检测细胞浓度,控制细胞悬液浓度为1×105cells/mL。十二孔板中每孔加入1 mL细胞悬液,培养3 d使其贴壁牢固。使用转染试剂FuGENE@6 Transfection Reagent进行细胞转染,十二孔板每孔细胞最佳转染体系:质粒,1 μg(根据上述实验提取的质粒浓度换算);Transfection Reagent 8 μL;Opti-MEM培养液补足至50 μL。每组4个生物学重复,以含有EGFP的质粒为阴性对照,培养(28 ℃, 5%CO2)24 h后,在荧光显微镜下观察荧光表达情况。
1.6 Aag2细胞感染DENV2及取样
细胞转染24 h后,将乳鼠鼠脑扩增的DENV2悬液稀释到合适比例使得MOI为0.1直接加入细胞培养基中。细胞感染后2、4、6 d取样,将每孔的细胞洗脱并混匀,使用自动细胞计数仪对每孔细胞计数。2 000 r/min,5 min离心后将上清转移至新EP管,细胞沉淀中加入1 mL Trizol保存。
1.7 细胞中目的基因表达量的定量检测
在每个细胞沉淀样品中加入5~7颗研磨珠,60 Hz/45 s,研磨2次。常温反应5 min,使其完全裂解,离心后将液体转移至新的1.5 mL EP管中,加入0.2 mL氯仿,充分混匀反应2~3 min,离心后将上层水相转移至新的EP管中,加入等体积冷冻的异丙醇0.5 mL,反应10 min小心吸除上清液,加入1 mL 75%乙醇悬液沉淀,轻微振动,离心后小心倒出上清在生物安全柜中干燥约10 min。加入100 μL RNase-free water溶解RNA,-80 ℃冰箱保存备用。
采用TransScript® Green One-Step qRT-PCR SuperMix进行定量检测。反应体系:2×PerfectStartTMGreen One-Step qPCR SuperMix,10 μL;TransScript® Green One-Step RT/RI Enzyme Mix,0.4 μL;Forward Primer(表2,10 μmol/L),0.4 μL;Reverse Primer(表2,10 μmol/L),0.4 μL;Passive Reference Dye(50×),0.4 μL;RNA模板,2 μL;Nuclease-free Water,补足至20 μL。使用实时荧光定量PCR仪(QuantStudio 7 Flex)进行定量检测,反应程序:45 ℃,5 min;94 ℃,30 s;94 ℃,5 s,60 ℃,30 s,40个循环。每个样品做3个技术重复。
1.8 细胞上清液中病毒载量检测
按照说明书用登革病毒Ⅱ型核酸免提取检测试剂盒检测病毒含量,该试剂盒选用登革Ⅱ型病毒特异性的保守区域作为检测靶基因,设计荧光检测的特异性引物Forward Primer(5’-A A T T A G A G A G C A G A T C T C T G A T G AA-3’)、Reverse Primer(5’-A G C A T T C C A A G T G A G A A T C T C T T T GT-3’)、探针(Taqman探针:FAM-A G C T G T T G C A C A G T T G A C A C G CG-BHQ1)。反应体系:2×登革病毒Ⅱ型扩增反应液,10 μL;登革病毒Ⅱ型引物及探针混合液,1 μL;RT-PCR酶混合液,0.5 μL;细胞上清液,4 μL;双蒸水,补足至20 μL。使用实时荧光定量PCR仪(QuantStudio 7 Flex)进行定量反应,反应条件(Reporter: FAM, Quencher: None):50 ℃,10 min;95 ℃,10 min;95 ℃,15 s,60 ℃,30 s,40个循环。每个样品3个技术重复。
1.9 数据处理
运用Excel 2019处理数据,运用SPSS软件独立样本t检验,对目的基因的表达量、细胞上清中DENV2拷贝数进行统计学分析。
2 结果
2.1 Aag2过表达体系的建立
通过分别构建含有12个基因的质粒载体,使用细胞转染技术在Aag2细胞中建立目标基因的瞬时转染过表达模型。在将构建好的过表达载体转染进Aag2细胞中后,利用荧光显微镜对插入的质粒表达进行验证,结果中,EGFP对照组在荧光显微镜下显示出红色、绿色两种荧光,目的基因组只显示出红色荧光(图1),表示已经构建的转染质粒可以在Aag2细胞成功表达。

图1 质粒在Aag2细胞中表达的荧光效果图
验证了带有目的基因的表达载体可以在Aag2细胞中表达之后,为进一步验证此表达体系在细胞染毒或未染毒的状态下都可以使目的基因的表达量显著上升,本研究设计了每一段目的基因的引物(表2),在构建过表达体系后,感染DENV2的2、4、6 d时分别检测各组目的基因的表达情况。结果显示,对于各组目的基因的过表达体系建立之后,无论是未染毒组(图2)还是染毒组(图3),相比于EGFP组,带有目的基因的组别相应基因的表达量均有明显提升,其比值log10FC(Fold Change,倍数差异)值均大于0。因此,所有的过表达体系细胞在染毒或未染毒的状态下,在6 d之内均能保持目的基因的过表达状态。

表2 过表达基因的验证引物
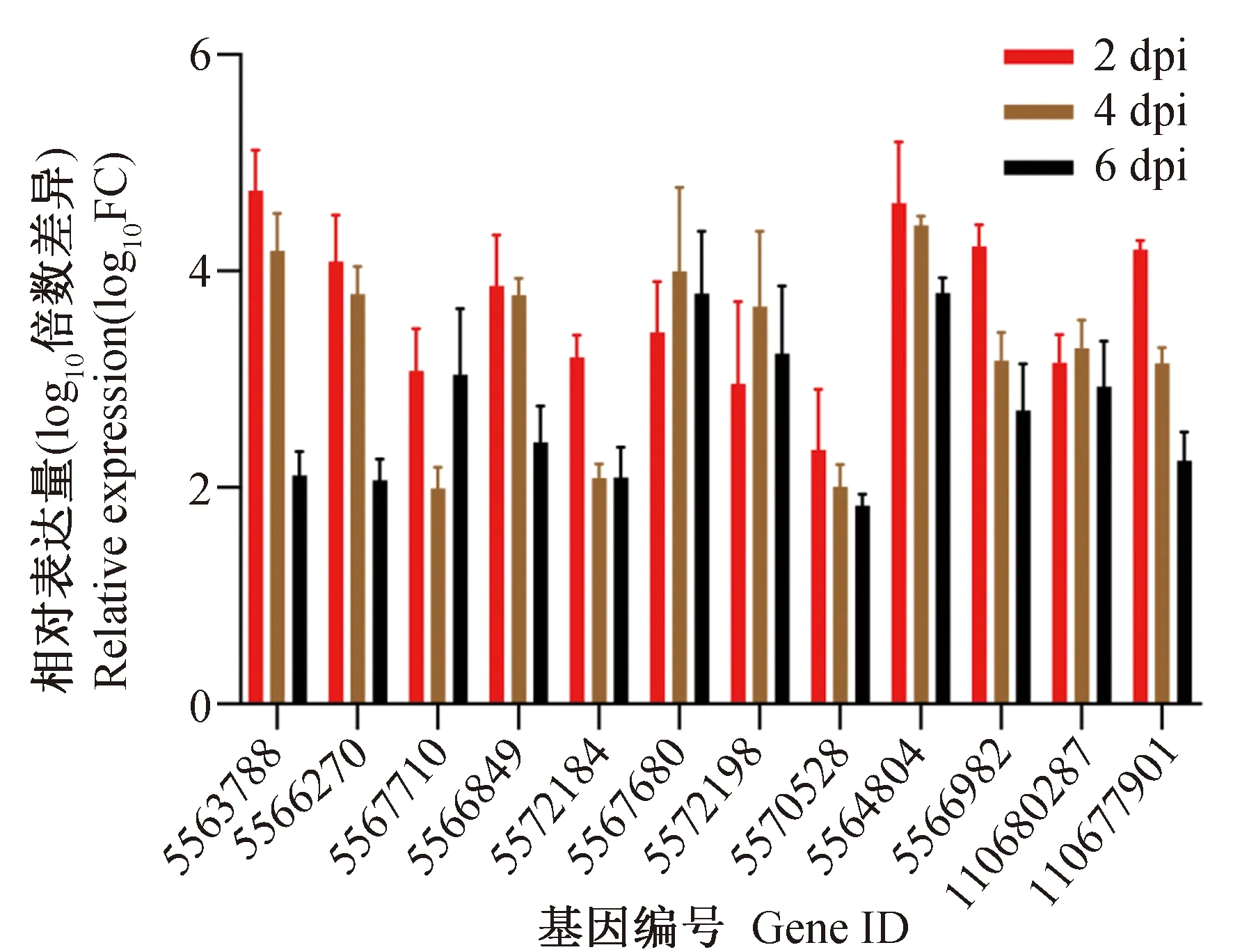
图2 Aag2细胞过表达体系12个基因表达(n=4)
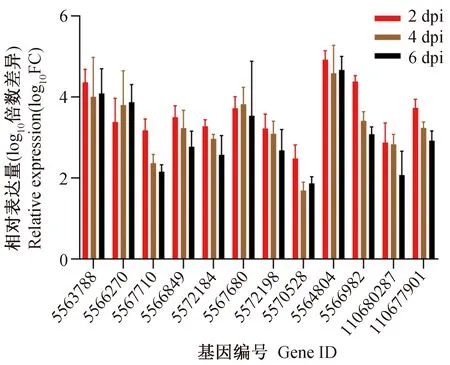
图3 Aag2细胞过表达体系感染DENV2时12个基因表达情况
此外,由于Aag2细胞感染病毒实验中细胞数量会显著影响到最终的病毒载量,为了保证后续Aag2细胞感染病毒实验中,不会因为带有表达载体的细胞生长速度出现变化而造成假阳性结果,本研究分别对在构建过表达体系后,感染DENV2的2、4、6 d进行细胞计数。结果显示,过表达体系建立后,无论是感染病毒组还是未感染病毒组,过表达目的基因的Aag2细胞密度相对于EGFP组Aag2细胞密度的比值都约为1,说明过表达目的基因组与EGFP组对比细胞增殖并没有出现明显的异常(图4、5)。因此,所有的过表达体系细胞在感染病毒或未感染病毒的状态下,在6 d之内细胞生长速率不会对最终病毒载量结果产生过大的干扰。
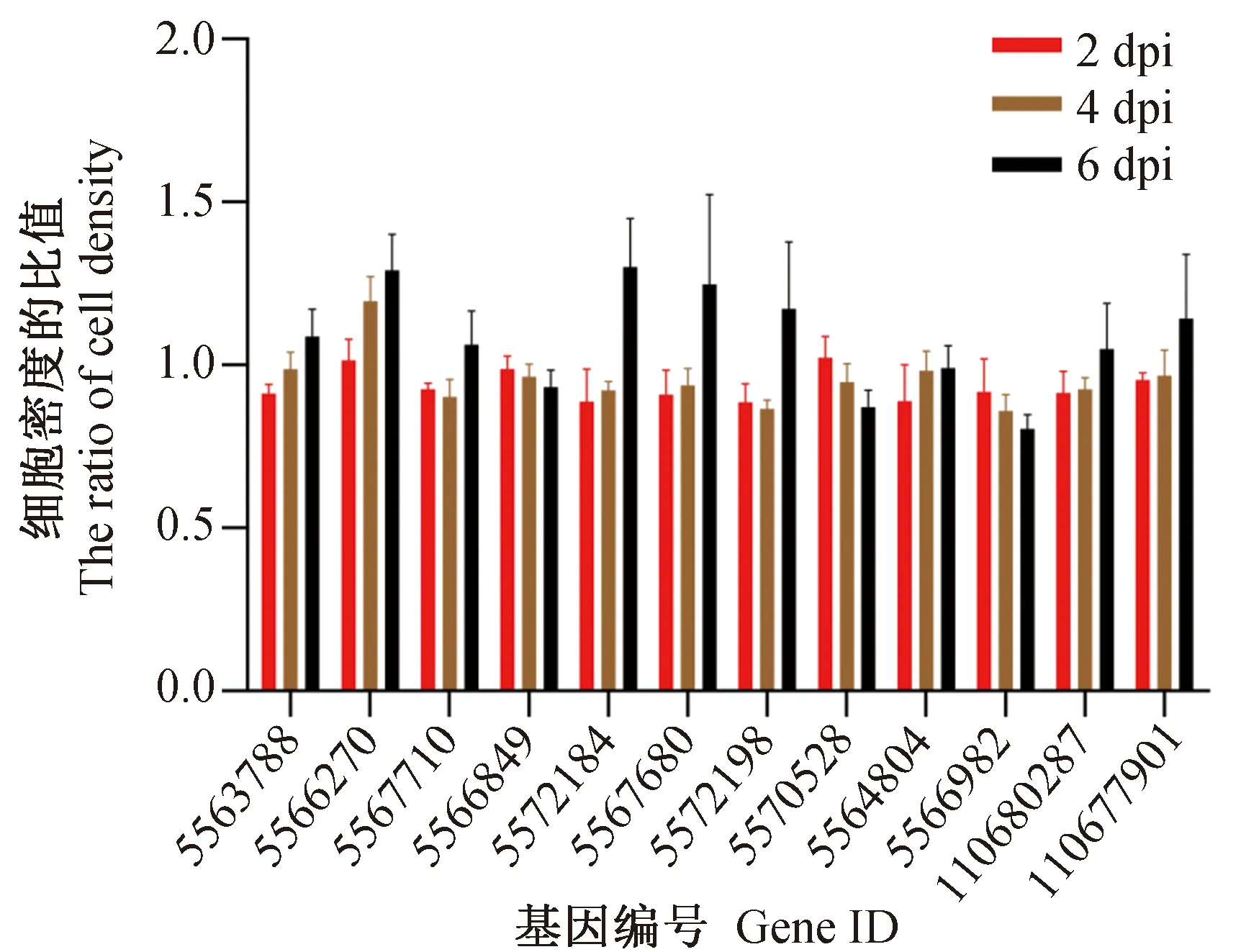
图4 Aag2细胞过表达体系细胞密度差异

图5 Aag2细胞过表达体系感染DENV2时细胞密度差异
2.2 目的基因过表达对Aag2细胞上清中DENV2载量的影响
在相应基因过表达的状态下使Aag2细胞感染DENV2,在2、4、6 d测量细胞上清中病毒载量,以探究这些基因Aag2细胞感染DENV2过程中可能发挥的作用。结果显示,在2 d时,ID为110677901、5563788、5566270、5564804的基因过表达后细胞上清液中DENV2 RNA拷贝数相较于过表达EGFP对照组差异具有统计学意义,目的基因组log10DENV2 RNA拷贝数/EGFP对照组log10DENV2 RNA拷贝数计算得FC值在0.787~0.954之间。在4 d时,ID为5570528、5566270、5564804的基因过表达后细胞上清液中DENV2 RNA拷贝数相较于过表达EGFP对照组差异具有统计学意义,FC值在0.910~1.169之间。在6 d时,ID为5570528、5567680、5566849、110677901、5566270的基因过表达后细胞上清液中DENV2 RNA拷贝数相较于过表达EGFP对照组差异具有统计学意义,FC值在0.787~1.066之间(表3)。总体来看,ID为5570528、110677901、5566270 的3个基因在Aag2细胞中过表达后,在6 d之内其组别的病毒载量相较于EGFP对照组均有显著的降低。

表3 目的基因过表达后细胞上清液中DENV2 RNA拷贝数差异统计学分析
3 讨论
目前,人们对昆虫的病毒感染传播相关机制已进行了一系列的研究,蚊虫感染虫媒病毒后会产生先天免疫反应,产生一系列病原体宿主相互作用,例如,在节肢动物中,先天免疫通过抗菌肽等效应分子的产生,吞噬、包埋、分泌等物理屏障和黑化作用(Messinaetal., 2014),在抑制病原体感染方面发挥重要作用。冈比亚按蚊Anophelesgambiae感染病毒后诱导激活的18个基因中包括一种70 kDa的热休克蛋白因子,该因子后来被证明可影响病毒在蚊媒中复制的能力(Simetal., 2007)。然而,蚊虫感染病毒后很多调控激活的分子机制以及其他例如吞噬、自噬、蛋白水解等多方面与病毒调控有关的机制尚不清楚(Alonso-Palomaresetal., 2018)。
本文通过构建Aag2细胞的过表达体系,研究12个基因过表达对Aag2细胞感染DENV2的载量变化。结果筛选出3个在蚊虫感染DENV2时,可能与蚊虫免疫相关的基因。其中,基因ID 110677901编码蛋白为蜕皮激素20单加氧酶(ecdysone 20-monooxygenase),是一种和昆虫生长发育、蜕皮与繁殖相关的酶,是蜕皮激素(ecdysone)转化为20-羟基脱皮酮(20-hydroxyecdysone, 20E)酶系统中的关键物质(Smithetal., 1983)。蜕皮激素是一种昆虫内的类固醇激素(Smithetal., 1979),是全变态昆虫蜕皮和繁殖的关键调节因子,也是幼虫蛹发育关键时期的主要血淋巴蜕皮甾体。20-羟基脱皮酮则是蜕皮激素经转化后变成的一种更具有生物活性的形式,它们对发育、蜕皮和变态至关重要(Matsushimaetal., 2019)。基因ID 5570528编码的蛋白为羟基类固醇脱氢酶样2(hydroxysteroid dehydrogenase-like protein 2,HSDL2),是一种含甾醇载体蛋白2(sterol carrier protein 2,SCP2)结构域的蛋白质,定位于过氧化物酶体,调节脂肪酸合成(Ruokunetal., 2016)。在哺乳动物内HSDL2的代谢异常与肿瘤相关,相关组织癌细胞中的HSDL2往往表现出上调,人为下调或敲除HSDL2后细胞的增殖会受到抑制甚至凋亡(Sunetal., 2018; Jiaetal., 2019)。基因ID 5566270 编码的蛋白为3β-羟基类固醇脱氢酶(3 beta-hydroxysteroid dehydrogenase),是一种非常重要的酶,催化了所有类固醇激素生物合成的重要一步(Simardetal., 1995),蜕皮激素就是一种类固醇激素,因此3β-羟基类固醇脱氢酶的上调可能也与20-羟基脱皮酮的合成相关联。
本研究通过埃及伊蚊和Aag2细胞感染DENV2的转录组结果和Aag2细胞的过表达体系验证实验筛选出了3个不同的基因,这3个基因可能都与20-羟基脱皮酮的调节有关。在迄今为止的大多数昆虫中,已证明蜕皮激素20单加氧酶活性在胚胎后发育期间波动剧烈,表明蜕皮激素20单加氧酶在胚胎后发育中起着关键作用(Horikeetal., 1999)。另外,在近期的一些报道中20-羟基脱皮酮可以促进昆虫的先天免疫反应(Sunetal., 2016),例如,20-羟基脱皮酮可以促进宿主细胞和动物中免疫相关基因的表达,特别是AMP基因的表达(Smithetal., 1983),20-羟基脱皮酮还可以促进昆虫的细胞免疫,如诱导冈比亚按蚊细胞系酚氧化酶的表达(Ahmedetal., 1999),注射20-羟基脱皮酮提高果蝇浆细胞的吞噬活性等等(Lanotetal., 2001)。这提示蚊虫在感染DENV2时可能会激活与20-羟基脱皮酮相关的先天免疫过程,因此在蚊虫感染DENV2时,20-羟基脱皮酮介导的先天免疫过程可能是蚊虫非常重要的调控机制之一。

