猪瘟活疫苗(兔源)免疫猪体后血液转录组学变化初探
包松英,庄许诺,江兴华,王全溪
(1.兆丰华生物科技(福州)有限公司,福州 350014;2.福建农林大学 福建省兽医中药与动物保健重点实验室,福州 350002;3.福建农林大学 中西兽医结合与动物保健福建省高等学校重点实验室,福州 350002)
猪瘟是一种由猪瘟病毒(Classical swine fever virus, CSFV)引发的接触性传染病,临床特点为高热、出血,并伴随高死亡率,严重危害了养猪业的健康稳定发展。近年来,在亚洲、南美、中美洲及加勒比地区近年来,在亚洲、南美、中美洲及加勒比地区CSFV仍然流行。自2015年起被正式指定为无猪瘟疫情的日本,于2018年在家猪和野猪中暴发猪瘟疫情[1-2]。目前,我国猪瘟疫病流行特点为:中小猪场零星散发,野生型猪瘟的毒力降低,病程从急性和亚急性转向慢性发展,多种病原混合感染。疫苗免疫仍是控制猪瘟的主要手段[3]。20世纪50年代,我国科学家经兔体传350多代后获得了安全、免疫原性好的优势猪瘟疫苗株——C株,C株弱毒疫苗的大范围推广应用,对于我国猪瘟防控起到了至关重要的作用,且在现阶段流行毒株复杂的形势下,C株疫苗仍安全有效[4-5]。猪瘟活疫苗(兔源)又叫猪瘟脾淋苗,是C株接种健康家兔,收获出现定型热兔体的脾脏和肠系膜淋巴结研磨制备而成的疫苗,良好保留了病毒免疫原性,免疫猪体后快速产生保护力,且副反应小,可有效控制临床常见的慢性、温和型猪瘟以及非典型猪瘟[6]。
RNA-seq是目前应用最多也是最成熟的转录组测序技术,大范围应用于临床研究。RNA-seq技术通过统计细胞转录组学表达量数据,研究生命体某个过程的作用机理,重要基因的表达模式与调控机制等[7]。在兽医领域,该技术已应用于破译基因组结构与功能,揭示病原体致病机理以及遗传育种[8-10]等方面。
目前,已有针对猪瘟兔化弱毒株感染家兔后不同时间段,兔体对病毒的免疫反应研究[11-12],而猪瘟脾淋苗对猪体的免疫机理研究尚少。本文通过对猪体免疫猪瘟脾淋苗,以脾淋组织作为对照,采集免疫后第3 d的血液样本,进行RNA-seq测序分析,以期研究脾淋苗接种早期机体的免疫应答,为了解疫苗免疫机理提供理论参考。
1 材料与方法
1.1 试验动物与免疫物 4周龄小猪10头,购自福州市永泰县某猪场,试验猪未普免,经检测为非洲猪瘟病毒(African swine fever virus, ASFV)、口蹄疫病毒(Foot-and-mouth disease virus, FMDV)、猪瘟病毒(Classical swine fever virus, CSFV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV)、伪狂犬病病毒(Pseudorabies virus, PRV)、猪传染性胃肠炎病毒(Transmissible Gastroenteritis Virus, TGEV)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、猪圆环病毒2型(Porcine circovirus 2,PCV-2)8种病原阴性以及猪瘟抗体阴性的健康小猪。猪瘟脾淋苗、健康家兔脾淋组织由兆丰华生物科技(福州)有限公司提供。
1.2 试剂 总RNA提取试剂盒购自兰博利德试剂有限公司;反转录试剂盒购自厦门泰京生物技术有限公司;实时荧光定量PCR试剂盒购自兰博利德试剂有限公司。
1.3 分组 将10头小猪随机分为A、B两组,每组5头,其中A组肌肉注射猪瘟脾淋苗1头份,B组肌注等量健康家兔脾淋组织。
1.4 样品采集 采集免疫后第3 d的猪前腔静脉血液样本,送至北京诺禾致源科技股份有限公司进行转录组测序。
1.5 转录组测序与数据分析 提取样品总RNA,精确检测完整性和总量后,构建合格文库,以Illumina HiSeq 2500测序。测序数据经过过滤、错误率检查、GC含量检查后,获得clean data。使用HISAT2 v2.0.5将数据与猪参考基因组进行比对,采用featureCounts进行基因表达水平定量,使用DESeq2软件进行差异表达分析,其中P<0.05,|log2FoldChange|≥0的基因为差异表达基因。以clusterProfiler软件实现差异表达基因的GO富集分析,与KEGG通路中差异表达基因的统计富集,使用本地版GSEA分析工具对样品功能注释与富集分析。
1.6 RT-qPCR验证 选择4个基因,按照Promega逆转录试剂盒说明书进行cDNA的逆转录,逆转录体系为:25mmol/L MgCl22 μL,GoScript™Reverse Transcriptase 1 μL,GoScript™5× Reaction Buffer 4 μL,Recombinant RNasin®Ribonuclease Inhibitor 0.5 μL,Oligo(dT)15 Primer 1 μL,Random Primers 1 μL,PCR Nucleotide Mix 10mmol/L 1 μL,Nuclease-Free水补足至20 μL。于42℃反应15 min,72℃反应15 min获得cDNA,cDNA进行RT-qPCR检测。β-actin:正向引物为5′-CCAGCCA TGTATGTAGCCATCCAG-3′,反向引物为5′-ACGGCCAGCCAGATCCAGAC-3′,产物大小:166 bp;CXCL10:正向引物为5′-TGCCCACATG TTGAGATCATTGCC-3′,反向引物为5′-TTGATG GCCTTCGACTCTGGATTC-3′,产物大小:80 bp;NOS3:正向引物为5′-CAGGGTGGAAGCGGTA ACAAAGG-3′,反向引物为5′-CTGCTTGGCGGC GAAGATGAG-3′,产物大小:85 bp;CD86:正向引物为5′-CTTTGTGATGGTCCTCCTGCTCTC-3′,反向引物为5′-CACGGCAGTTCTCCAGTCT CATTG-3′,产物大小:81 bp;NOD1:正向引物为5′-ACTTGCTGCACAACGACTACTTCTC-3′,反向引物为5′-ACGAAGAACTCCGACACCTCCTC-3′,产物大小为133 bp。
RT-qPCR循环条件为:95℃预变性30 s;95℃变性5 s,60℃退火30 s,72℃延伸15 s,共45个循环。以2^ΔΔCT法计算差异表达水平,重复3次。
2 结果
2.1 测序数据统计 通过测序获得的脾淋苗免疫组(A组)与脾淋组织对照组(B组)的原始数据如表1。各样本净碱基数均超过6 GB,净读数的Q20百分比>97%,Q30百分比>93%,GC比例>50%。将处理的数据比对至猪类参考基因组,总比对率>96%。
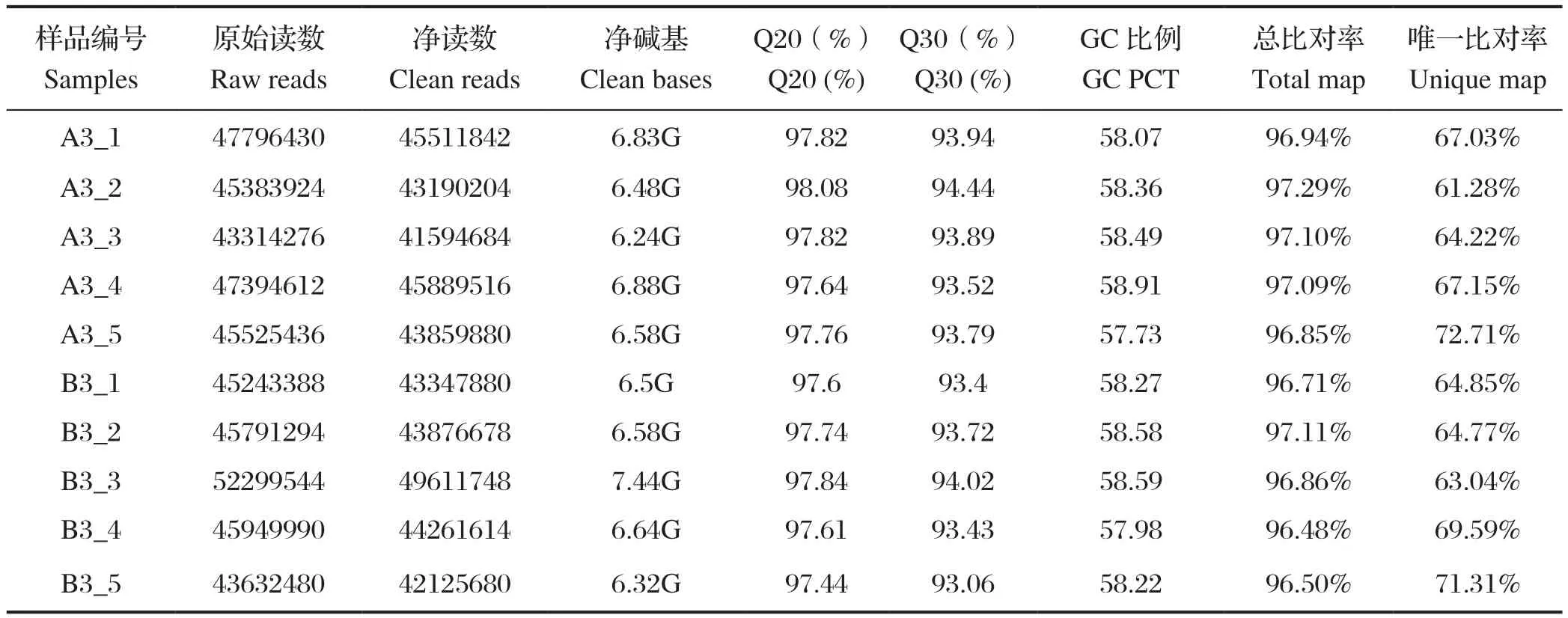
表1 测序质量以及与参考基因组比对情况Table1 Sequencing quality and comparison with reference genomes
2.2 差异基因筛选 免疫后第3 d,猪瘟脾淋苗组(A组)与脾淋组织对照组(B组)比较,差异表达基因(P<0.05)有317个,其中上调表达基因221个,下调表达基因96个(图1)。
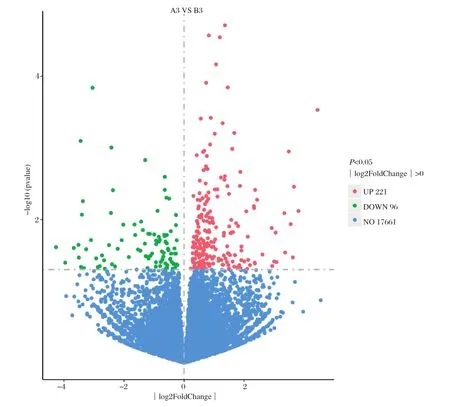
图1 差异表达基因火山图Fig.1 Volcano map of differentially expressed genes
2.3 GO功能富集分析 GO分析主要包括三个维度:生物过程(Biological Process, BP)、细胞组分(Cellular Component, CC)、分子功能(Molecular Function, MF)。通过clusterProfiler(3.4.4)软件进行差异表达基因GO富集分析,结果显示:免后3 d,与BP相关的有483个,与CC相关的有98个,与MF相关的有87个。其中猪瘟脾淋苗组(A组)相对于脾淋组织对照组(B组)组显著差异转录的mRNA主要参与BP中的对病毒的防御反应(defense response to virus)、病毒过程(viral process)、多种生物细胞过程(multiorganism cellular process)、对其他生物体的防御反应(defense response to other organism)、共生,包括通过寄生的互利共生(symbiosis, encompassing mutualism through parasitism)、物种间的相互作用(interspecies interaction between organisms)、对病毒的反应(response to virus)7个生物过程(Q<0.05)(图2)。
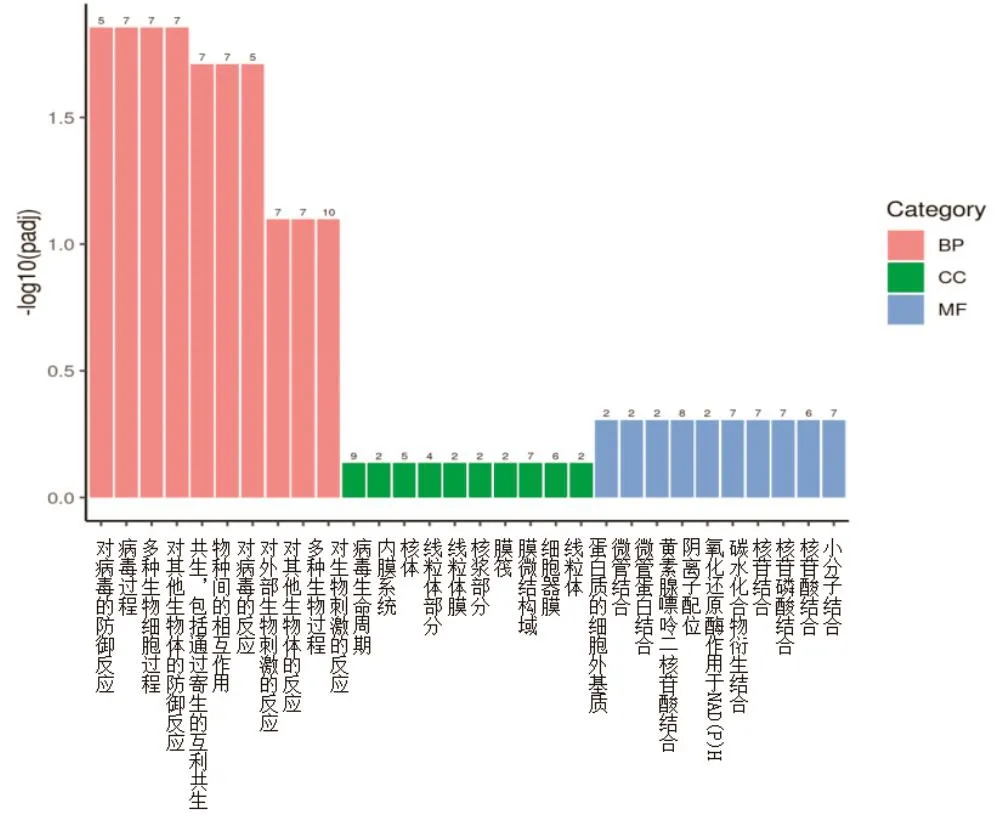
图2 GO功能富集结果Fig.2 GO function enrichment analysis results
2.4 KEGG pathway分析 通过clusterProfiler软件实现KEGG通路中差异表达基因的统计富集发现,免疫后3 d,被注释的差异基因数量为494个,涉及的pathway数量有215个,与免疫和抗炎相关的有甲型流感信号通路(Influenza A)、EB病毒感染通路(Epstein-Barr virus infection)、RIG-I样受体信号通路(RIG-I-like receptor signaling pathway)、TNF信号通路(TNF signaling pathway)和NOD-like受体信号通路(NOD-like receptor signaling pathway)等,其中CXCL10、RSAD2、OAS1、OAS2、MX1、ISG15等基因上调表达。分析结果见表2。
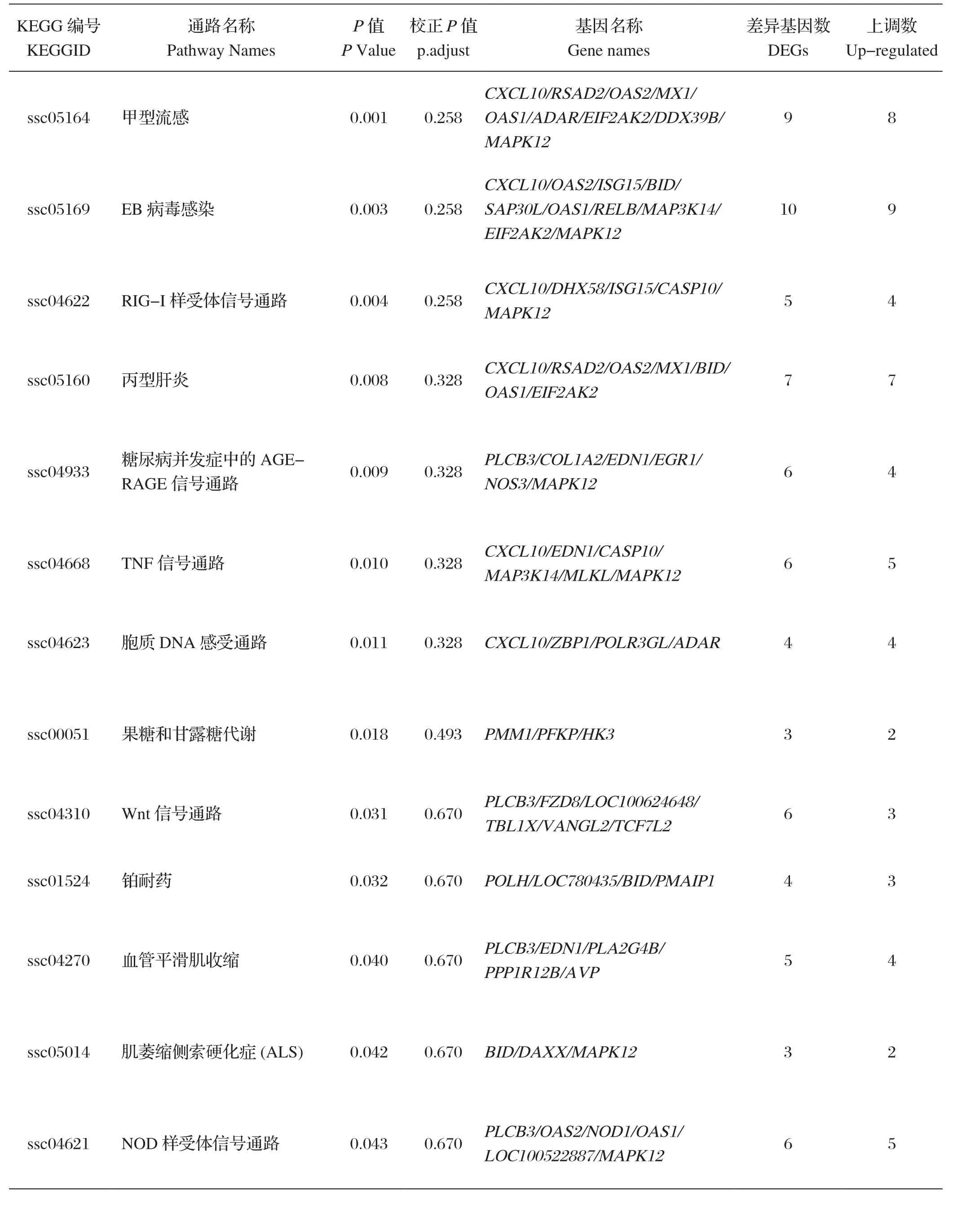
表2 差异基因KEGG通路分析结果Table2 KEGG pathway analysis results of differential genes
2.5 RT-qPCR验证结果 为了证实转录组测序结果的准确性,本试验随机筛选了CXCL10、NOS3、CD86、NOD14个差异表达基因进行RT-qPCR验证。结果显示RT-qPCR和RNA-seq测序数据之间差异表达基因趋向基本一致(图3)。
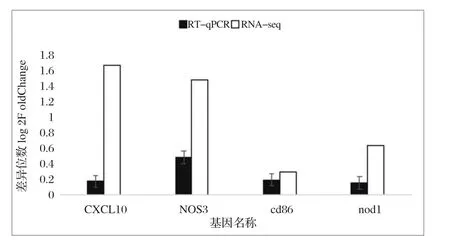
图3 RT-qPCR与RNA-seq分析差异基因倍数对比Fig.3 Comparison of differential gene multiples by RT-qPCR and RNA-seq analysis
3 讨论
猪瘟脾淋苗以猪瘟兔化弱毒C株接种健康家兔,收获产生定型热的兔脾脏、肠系膜淋巴结制备而成,其中脾淋组织具有免疫增强作用,与活疫苗搭配使用可增强免疫效果[13]。郭海勇等[14-15]采集了免疫猪繁殖与呼吸综合征弱毒疫苗的猪脾脏,制备猪脾转移因子,再与猪繁殖与呼吸综合征疫苗联合使用,发现脾转移因子可显著提升巨噬细胞的吞噬功能以及淋巴细胞的增殖活性。而C株具有良好的免疫原性,C株活疫苗在免疫猪体5 d后,即可抵御猪瘟强毒攻击,采集接种疫苗的猪扁桃体样本进行转录组分析发现一组受调控的基因,其中许多与ISG15抗病毒途径有关,表明其可能与C株疫苗接种早期提供的免疫保护有关[16]。
本文将猪瘟脾淋苗免疫断奶仔猪,采集免疫后第3 d的血液样本,进行RNA-seq测序分析,发现猪瘟脾淋苗免疫组与脾淋组织对照组对比,差异表达基因数量达317个(P<0.05),其中上调221个,下调96个;差异基因作GO功能富集分析发现,显著差异转录的mRNA主要参与对病毒的防御反应(defense response to virus)、病毒过程(viral process)等生物过程;KEGG信号通路富集分析表明,涉及的pathway数量有215个,与免疫和抗炎相关的有甲型流感信号通路、EB病毒感染通路、RIG-I样受体信号通路、TNF信号通路和NOD-like受体信号通路等。
本研究发现脾淋苗免疫组中干扰素刺激基因15(IFN-stimulated gene 15, ISG15)显著上调表达,与McCarthy等[16]研究结果相一致。同时,试验中发现,CXCL10、RSAD2、OAS1、OAS2、MX1等基因出现显著上调表达。CXCL10又叫干扰素γ诱导蛋白10,是一种趋化因子,功能是募集白细胞,其对白细胞稳态以及调节免疫、炎症反应至关重要。OAS1、OAS2属于2'-5'-寡腺苷酸合成酶(2'-5'-oligoadenylate synthetase, OAS)基因家族,可在干扰素诱导下产生抗病毒蛋白[17],活化的OAS利用ATP合成2'-5'-寡腺苷,结合并激活细胞中潜在的内源性核酸酶,参与脑心肌炎病毒、呼肠孤病毒、黄病毒科多种病毒相关的先天性免疫应答[18]。而Wang等[19]利用一种表达海肾荧光素酶标记的报告病毒,结合21种靶向CSFV ISGs的小干扰RNA(siRNA),筛选抗CSFV ISGs,结果鉴定出4种新型抗CSFV ISGs,其中两种为CXCL10和OAS1。RSAD2为S-腺苷甲硫氨酸基区域蛋白2,是Ⅰ型干扰素诱导产生的抗病毒蛋白[20],MX1是黏病毒抗性蛋白1,具有抵抗粘液病毒的作用,刘存[21]发现,牛Mx1蛋白对BVDV在MDBK细胞中的复制具有抑制作用。
本研究中发现脾淋苗组相对于脾淋组织免疫组,CXCL10、RSAD2、OAS1、OAS2、MX1、ISG15等基因显著上调表达,提示脾淋苗可能诱导机体产生干扰素,从而刺激宿主先天性免疫反应。

