橙皮苷和迷迭香酸组合对脂多糖攻毒大鼠回肠形态、菌群结构以及炎症反应的影响
李盼盼 李润林 吴佳庆 雷铭康 汪 晶* 朱伟云
(1.南京农业大学动物科技学院,南京 210095;2.国家动物消化道营养国际联合研究中心,南京 210095)
植物提取物是利用物理或化学方法从天然植物中提取出来的,由于其绿色安全且无明显毒副作用,并且具有一定的免疫调节作用[1],逐渐被应用于猪、禽、反刍动物等的养殖中,发挥抑菌、抗炎、促进肠道健康等作用[2]。由于单一植物提取物的功能及作用位点较为单一,而复合植物提取物中多种有效活性成分的叠加或协同作用可以在发挥单一植物提取物原有功能的基础上增强其作用效果、增加作用靶点,从而更加有效地解决动物生长发育过程中所面临的健康问题。
橙皮苷(hesperidin)是一种主要存在于柑橘类植物中的黄烷酮类化合物,水溶性较差。黄酮类化合物的抗氧化活性与其化学结构中的酚羟基有关[3],它主要通过2种方式来减轻动物机体的氧化反应,一是清除过多的自由基,二是通过激活细胞外信号调节激酶(ERK)/核因子2相关因子2(Nrf2)信号通路来增强细胞的防御功能[4]。研究表明橙皮苷可以提高肠道紧密连接蛋白表达,降低肠道通透性,并且通过抑制核因子-κB(NF-κB)和激活蛋白-1(AP-1)的激活,降低炎症因子水平,缓解肠道炎症[5-6]。橙皮苷还具有较强的抗菌活性,可以在一定程度上抑制大肠杆菌、金黄色葡萄球菌等有害菌的生长,其作用机制可能是通过改变细菌细胞膜通透性来影响细菌生长[7]。迷迭香酸(rosmarinic acid)是一种主要存在于唇形科、紫草科、葫芦科等植物中的水溶性酚酸类化合物,对大肠杆菌和金黄色葡萄球菌的抑制作用较强,它主要通过增加细菌细胞膜通透性、影响细菌蛋白质代谢以及DNA复制等发挥抑菌作用[8]。植物提取物中酚羟基数目越多,抗氧化能力越强[3],迷迭香酸化学结构中有4个酚羟基,橙皮苷化学结构中有2个酚羟基,表明迷迭香酸抗氧化能力强于橙皮苷。迷迭香酸发挥抗氧化作用主要通过减少活性氧的产生,调节谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)等抗氧化酶的活性来实现[9]。目前,橙皮苷或迷迭香酸大多是单独添加到大鼠结肠炎模型[6,10]、结肠癌模型[11]或炎症细胞模型[12]中探究其药理作用。但是橙皮苷的应用有一定的局限性,其分子结构以糖苷形式存在,导致水溶性较差,生物利用度低,不易被肠道上皮细胞吸收利用[13],通过酸水解对橙皮苷进行脱糖基处理,制备的橙皮素单葡萄糖苷和橙皮素的溶解度显著增加[14]。我们推测橙皮苷和迷迭香酸配合使用时,酚酸类化合物迷迭香酸不仅能发挥抗氧化、抑菌、抗炎等功能,还可能为橙皮苷提供酸水解的条件,进而提高橙皮苷的利用效率,从而有助于调节肠道菌群结构,缓解肠道炎症反应。
脂多糖(LPS)是革兰氏阴性菌细胞壁的组成成分,在细菌死亡或细胞壁破裂时释放量增加。LPS通过激活Toll样受体4(TLR4)/髓样分化因子88(MyD88)/NF-κB信号通路刺激肿瘤坏死因子-α(TNF-α)、白细胞介素-1(IL-1)、白细胞介素-6(IL-6)等促炎因子的产生,加剧炎症反应[15],常被用于构建肠道炎症模型。因此,本试验以SD大鼠作为研究对象,通过腹腔注射剂量为500 μg/kg BW的LPS构建急性肠道损伤模型,探究橙皮苷和迷迭香酸组合对LPS攻毒大鼠回肠形态、菌群结构以及炎症反应的影响,旨在为橙皮苷和迷迭香酸组合应用于畜禽养殖中提供理论依据。
1 材料与方法
1.1 试验材料
无特定病原体(SPF)级SD断奶大鼠购自南京市江宁区青龙山动物繁育场;橙皮苷和迷迭香酸均购自某科技有限公司,纯度≥98%;LPS购自索莱宝生物科技有限公司。
1.2 试验设计
试验选取体重为(54.65±1.18)g、健康状况良好的SPF级断奶SD大鼠共32只,适应7 d后,将大鼠随机分成4组:LPS组(每日灌胃2 mL无菌生理盐水)、Hes组(每日灌胃300 mg/kg BW橙皮苷)、RA组(每日灌胃20 mg/kg BW迷迭香酸)、Hes×RA组(每日灌胃150 mg/kg BW橙皮苷+10 mg/kg BW迷迭香酸)。每组4个重复,每个重复2只大鼠(公母各占1/2)。试验期间各组大鼠均饲喂标准基础饲粮,自由采食和饮水。动物房温度在25 ℃左右,相对湿度在60%左右,每天光照和黑暗均为12 h。试验正试期为14 d,在第13天,所有大鼠腹腔注射剂量为500 μg/kg BW的LPS溶液,12 h后,用乙醚将大鼠麻醉并解剖,采集大鼠回肠食糜和黏膜于液氮中保存,用于后续分析。动物试验依照南京农业大学实验动物中心管理制度执行,试验方案经该机构动物福利与伦理委员会批准。
1.3 测定指标和方法
1.3.1 回肠形态观察
剪取1 cm左右回肠组织于4%多聚甲醛中固定24 h,经乙醇梯度脱水、石蜡包埋、切片、脱蜡,最后再进行苏木精-伊红(HE)染色后封片。切片置于虚拟显微镜上进行拍照,使用Image-Pro Plus软件测量绒毛高度以及隐窝深度,并计算绒隐比(绒毛高度/隐窝深度)。
1.3.2 回肠黏膜中髓过氧化物酶(MPO)活性和细胞因子含量检测
称取0.1 g回肠黏膜样品制备成10%的匀浆液,使用酶联免疫吸附测定(ELISA)试剂盒测定髓过氧化物酶(MPO)活性和细胞因子(IL-6、TNF-α、IL-10)含量。试剂盒购自南京建成生物工程研究所,试验操作按照说明书要求进行。

表1 基础饲粮组成及营养水平(干物质基础)
1.3.3 回肠食糜微生物16S rRNA测序
按照Zoetendal等[17]的方法进行回肠食糜微生物DNA提取,并利用微量分光光度计(Thermo ND-1000,美国)检测到的260和280 nm处DNA的比值评价DNA质量。根据16S rRNA的保守区域设计引物,上游引物319F(5′-ACTCCTACGGGAGGCAGCAG-3′)和下游引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)用于聚合酶链式反应扩增16S rRNA基因的V3~V4区[18]。PCR产物基于Illumina-MiSeq PE300平台进行测序分析。
1.3.4 回肠食糜中微生物代谢产物短链脂肪酸(SCFAs)含量测定
使用GC-2014A型气相色谱仪(氢火焰离子化检测器,岛津,日本)测定回肠食糜中SCFAs的含量。根据Wang等[19]的方法,使用柱长30 m,膜厚0.25 μm,内径宽0.32 mm的毛细管柱,柱温设置为140 ℃,进样口温度为180 ℃,检测器温度为180 ℃,进样量为0.3 μL。
1.3.5 回肠黏膜中紧密连接蛋白基因和TLR4/MyD88信号通路相关基因mRNA相对表达量测定
回肠黏膜总RNA使用Trizol试剂(南京诺唯赞生物科技股份有限公司)进行提取,并使用微量分光光度计(Thermo ND-2000,美国)进行RNA质量以及浓度的检测。参照说明书将1 μg的总RNA加入到HiScript®Ⅲ All-in-one RT SuperMix Perfect for qPCR试剂盒(Vazyme,南京)的反应体系中,在DNA扩增仪(Long Gene®)上设置反应程序为50 ℃持续15 min,85 ℃持续5 s,将RNA反转录成cDNA,反转录后的cDNA置于-80 ℃保存。将cDNA加入到ChamQ SYBR qPCR试剂盒(Vazyme,南京)的反应体系中,利用荧光定量PCR仪进行荧光定量。选择β-肌动蛋白(β-actin)作为内参基因,使用2-ΔΔCt法计算ZO-1、Claudin-1、Occludin、TLR4、MyD88、IRAK1和TRAF6的mRNA相对表达量。引物由上海生工生物工程股份有限公司合成,引物序列如表2所示。

表2 紧密连接蛋白基因和TLR4/MyD88信号通路相关基因的引物序列
1.4 数据统计分析
数据首先使用Excel 2019进行整理,整理后的数据利用SPSS 26.0分析软件进行单因素方差分析(one-way ANOVA),若差异显著则使用Duncan氏法进行多重比较分析,之后用GraphPadPrism 8、Origin 2021和Excel 2019分别制作成图表。结果用“平均值±标准误”表示。P<0.05表示显著差异,0.05≤P<0.10表示差异有显著的趋势。
2 结果与分析
2.1 LPS攻毒大鼠回肠形态的变化
由图1可以看出,LPS组出现肠绒毛断裂,肠道上皮受损,Hes×RA组肠绒毛排列整齐,形态完好。由表3可知,与LPS组相比,Hes组、RA组以及Hes×RA组大鼠回肠的绒毛高度以及绒隐比显著提高(P<0.05),回肠隐窝深度没有显著变化(P>0.05)。

图1 各组大鼠回肠组织切片

表3 橙皮苷、迷迭香酸及其组合对LPS攻毒大鼠回肠形态的影响
2.2 LPS攻毒大鼠回肠食糜微生物及其代谢产物的变化
2.2.1 LPS攻毒大鼠回肠食糜微生物多样性的变化
使用ACE指数、Chao1指数、Shannon指数以及Simpson指数分析LPS攻毒大鼠食糜微生物的alpha多样性。其中,ACE指数和Chao1指数代表微生物丰富度,Shannon指数和Simpson指数代表微生物多样性。从表4可以看出,与LPS组相比,Hes组、RA组、Hes×RA组大鼠回肠食糜微生物的ACE指数、Chao1指数、Shannon指数和Simpson指数均没有显著变化(P>0.05)。大鼠回肠食糜微生物的beta多样性分析基于操作分类单元(OTU)水平采用Bray-Curtis的距离算法进行主坐标分析(PCoA)。如图2所示,LPS组、Hes组、RA组和Hes×RA组的微生物聚类分开,4组间呈现出显著差异(R=0.661 3,P=0.001 0)。
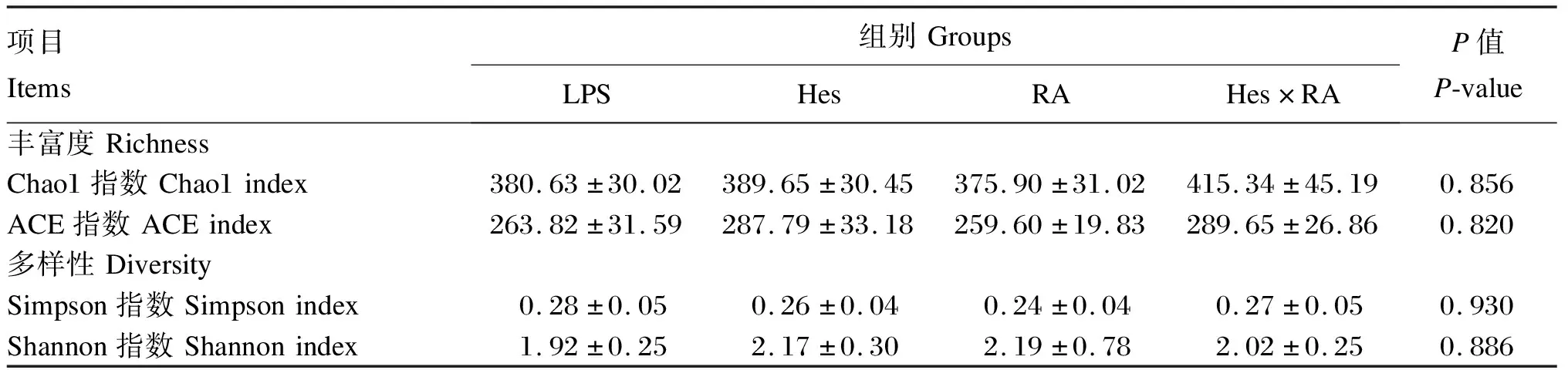
表4 橙皮苷、迷迭香酸及其组合对LPS攻毒大鼠回肠食糜微生物α多样性的影响
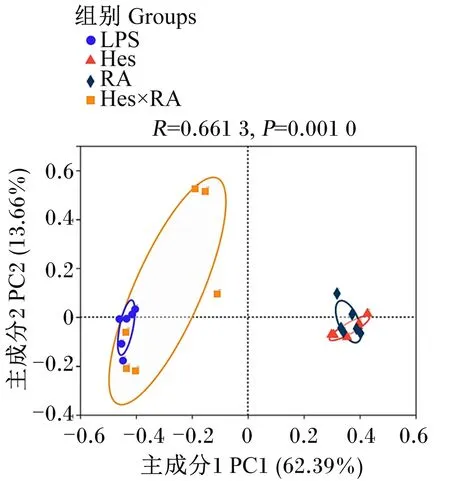
图2 橙皮苷、迷迭香酸及其组合对LPS攻毒大鼠回肠食糜微生物beta多样性的影响
2.2.2 LPS攻毒大鼠回肠食糜微生物组成的变化
如图3-A所示,在门水平,大鼠回肠食糜微生物中优势菌门主要是厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)。对门水平上相对丰度较高的3个菌门进行显著性分析,结果显示,与LPS组相比,Hes组和Hes×RA组Actinobacteria的相对丰度显著降低(P<0.05,图3-C),Hes组、RA组和Hes×RA组变形菌门(Proteobacteria)的相对丰度显著降低(P<0.05,图3-D),Hes组、RA组和Hes×RA组Firmicutes的相对丰度有所提高但差异不显著(P>0.05,图3-E)。在属水平,大鼠回肠食糜微生物中相对丰度前30的菌属如图3-B所示,LPS组的优势菌属主要是乳杆菌属(Lactobacillus)和棒状杆菌属(Corynebacterium),其他3组的优势菌属均为Lactobacillus。对属水平上的相对丰度较高的3个菌属进行显著性分析,结果显示,与LPS组相比,Hes组、RA组和Hes×RA组Lactobacillus的相对丰度显著升高(P<0.05,图3-F),Corynebacterium的相对丰度显著降低(P<0.05,图3-G);此外,Hes组和Hes×RA组链球菌属(Streptococcus)的相对丰度显著降低(P<0.05,图3-H)。
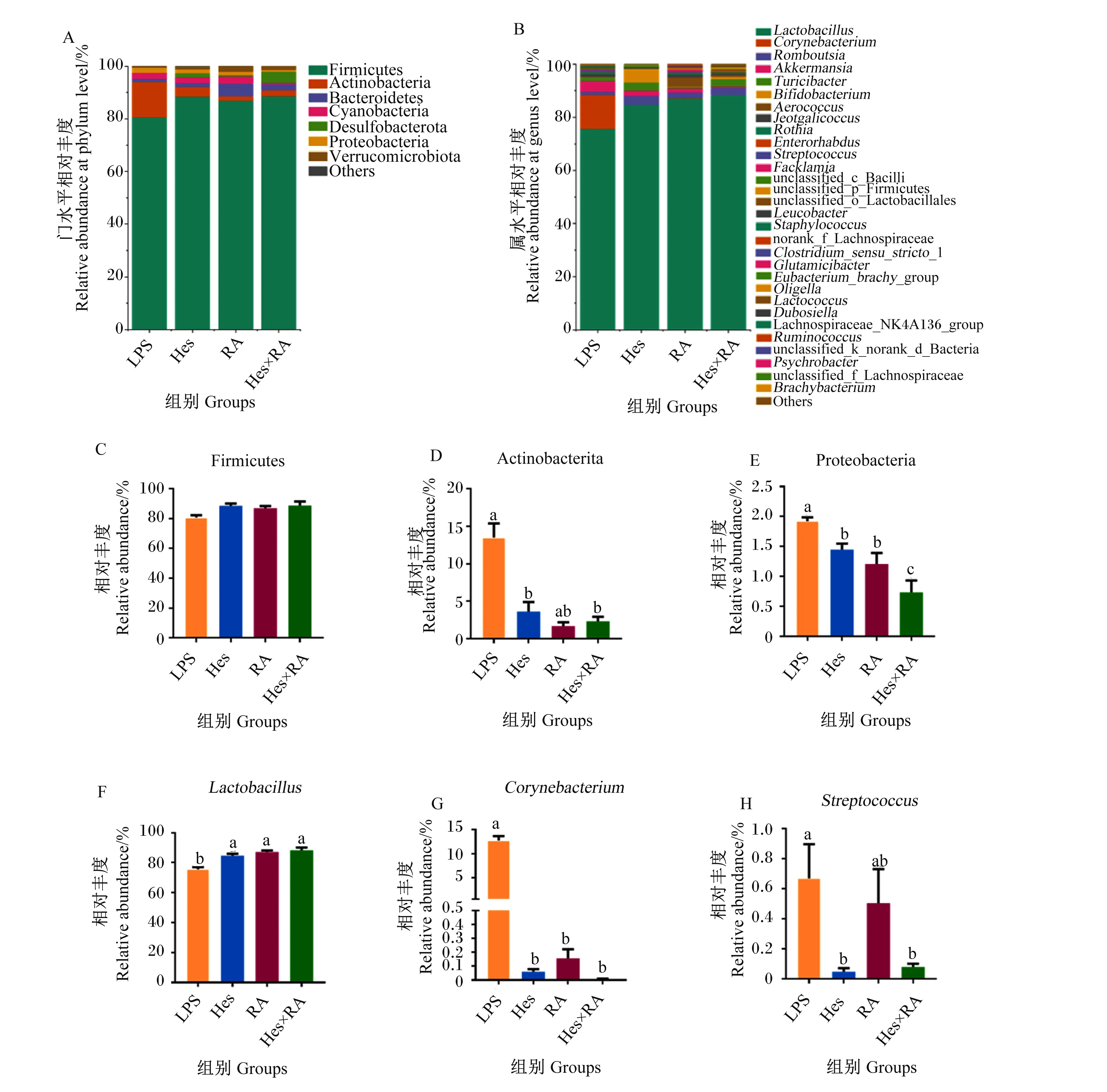
Firmicutes:厚壁菌门;Actinobacteria:放线菌门;Bacteroidetes:拟杆菌门;Cyanobacteria:蓝藻门;Desulfobacterota:脱硫杆菌门;Proteobacteria:变形菌门;Verrucomicrobiota:疣微菌门;Others:其他;Lactobacillus:乳杆菌属;Corynebacterium:棒状杆菌属;Streptococcus:链球菌属;Romboutsia:罗姆布茨菌属;Akkermansia:阿克曼氏菌属;Turicibacter:苏黎世杆菌属;Bifidobacterium:双歧杆菌属;Aerococcus:气球菌属;Jeotgalicoccus:热球菌属;Rothia:罗氏菌属;Enterorhabdus:肠杆菌属;Facklamia:费克蓝姆菌属;unclassified_c_Bacilli:未分类的杆菌纲;unclassified_p_Firmicutes:未分类的厚壁菌门;unclassified_o_Lactobacillales:未分类的乳酸杆菌目;Leucobacter:亮杆菌属;Staphylococcus:葡萄球菌属;norank_f_Lachnospiraceae:未命名的毛螺菌科;Clostridium_sensu_stricto_1:致狭窄梭状芽孢杆菌1;Glutamicibacter:谷氨酸杆菌属;Eubacterium_brachy_group:短真杆菌属;Oligella:寡源杆菌属;Lactococcus:乳球菌属;Dubosiella:杜氏乳杆菌属;Lachnospiraceae_NK4A136_group:毛螺菌科NK4A136群;Ruminococcus:瘤胃球菌属;unclassified_k_norank_d_Bacteria:未分类未命名的细菌;Psychrobacter:嗜冷杆菌属;unclassified_f_Lachnospiraceae:未分类的毛螺菌科;Brachybacterium:短杆菌属。
2.2.3 LPS攻毒大鼠回肠食糜微生物代谢产物SCFAs含量的变化
对LPS攻毒大鼠回肠食糜微生物代谢产物SCFAs含量进行检测,结果如表5所示。与LPS组相比,Hes×RA组大鼠回肠食糜中乙酸、丙酸以及总短链脂肪酸的含量显著提高(P<0.05),RA组丙酸的含量显著提高(P<0.05);此外,Hes×RA组丁酸的含量有增加的趋势(P=0.081)。

表5 橙皮苷、迷迭香酸及其组合对LPS攻毒大鼠回肠食糜代谢产物的影响
2.2.4 LPS攻毒大鼠回肠食糜微生物及其代谢产物的相关性分析
对LPS攻毒大鼠回肠食糜微生物与其代谢产物SCFAs进行了皮尔森相关性分析(Pearson’s correlation analysis),如图4所示。相关性分析显示,乙酸含量与Proteobacteria、Streptococcus相对丰度呈显著负相关(P<0.05);丙酸含量与Firmicute、Lactobacillus相对丰度呈显著正相关(P<0.05),与Actionbacteria、Proteobacteria、Corynebacterium相对丰度呈显著负相关(P<0.05);丁酸含量与Lactobacillus相对丰度呈显著正相关(P<0.05)。

红色表示正相关,蓝色表示负相关,*表示显著相关。
2.3 LPS攻毒大鼠回肠炎症反应以及紧密连接蛋白的变化
2.3.1 LPS攻毒大鼠回肠黏膜中MPO活性以及细胞因子含量的变化
如表6所示,与LPS组相比,Hes×RA组大鼠回肠黏膜中MPO活性显著降低(P<0.05),而Hes组、RA组则没有显著变化(P>0.05)。在细胞因子方面,与LPS组相比,Hes×RA组回肠黏膜中IL-6含量显著降低(P<0.05),IL-10含量显著升高(P<0.05);Hes组回肠黏膜中IL-6含量显著降低(P<0.05);Hes组、RA组和Hes×RA组回肠黏膜中TNF-α含量无显著变化(P>0.05)。

表6 橙皮苷、迷迭香酸及其组合对LPS攻毒大鼠回肠黏膜中MPO活性以及细胞因子含量的影响
2.3.2 LPS攻毒大鼠回肠黏膜中紧密连接蛋白相关基因mRNA相对表达量的变化
表7显示的是LPS攻毒大鼠回肠黏膜中3种紧密连接蛋白基因mRNA相对表达量的变化。与LPS组相比,Hes×RA组回肠黏膜中Claudin-1和Occludin的mRNA相对表达量显著提高(P<0.05),ZO-1的mRNA相对表达量有增加的趋势(P=0.064)。Hes组和RA组回肠黏膜中ZO-1、Claudin-1和Occludin的mRNA相对表达量与LPS组相比没有显著变化(P>0.05)。
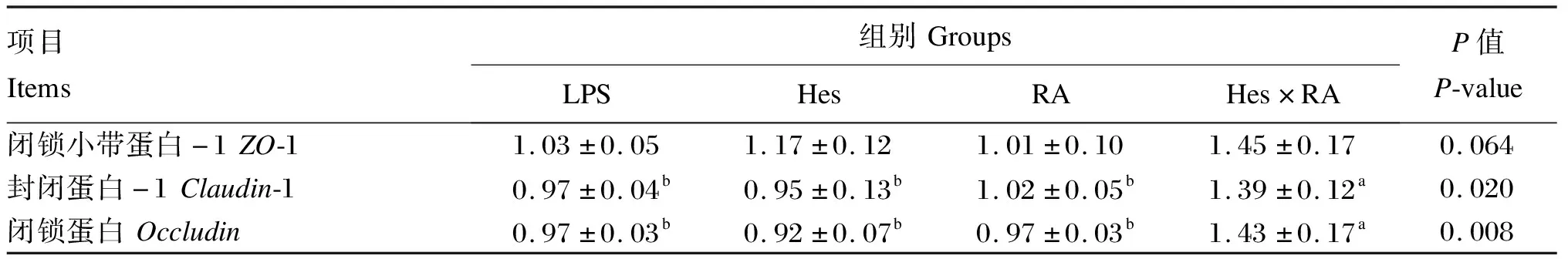
表7 橙皮苷、迷迭香酸及其组合对LPS攻毒大鼠回肠黏膜中紧密连接蛋白相关基因mRNA相对表达量的影响
2.4 LPS攻毒大鼠回肠黏膜中TLR4/MyD88信号通路相关基因mRNA相对表达量的变化
如表8所示,与LPS组相比,Hes×RA组回肠黏膜中IRAK1和TRAF6的mRNA相对表达量显著降低(P<0.05);Hes组和RA组回肠黏膜中IRAK1的mRNA相对表达量显著降低(P<0.05)。Hes组、RA组和Hes×RA组回肠黏膜中TLR4和MyD88的mRNA相对表达量与LPS组相比没有显著变化(P>0.05)。
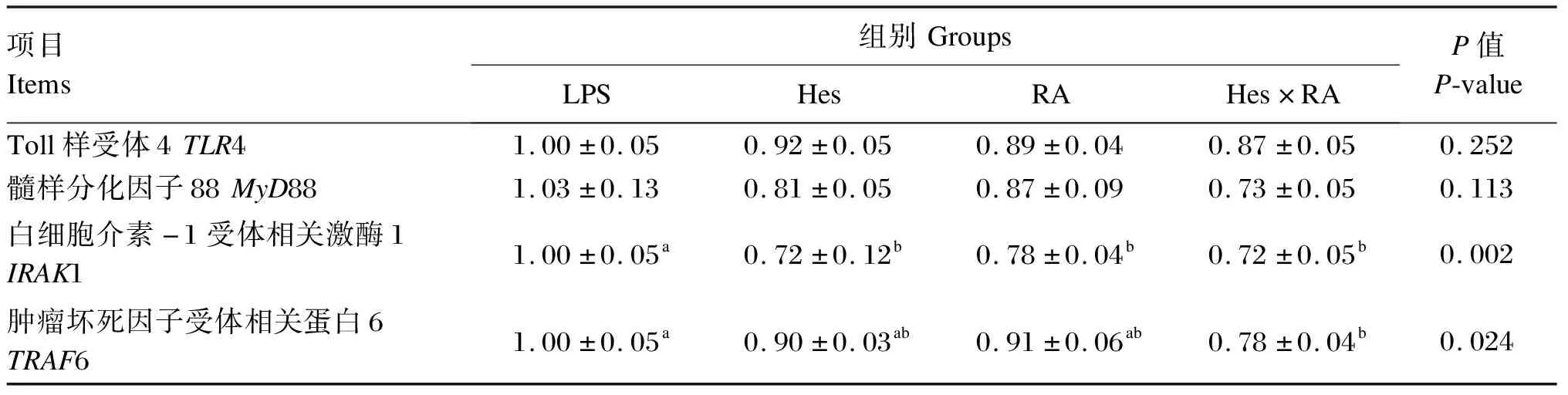
表8 橙皮苷、迷迭香酸及其组合对LPS攻毒大鼠回肠黏膜中TLR4/MyD88信号通路中相关基因mRNA相对表达量的影响
3 讨 论
3.1 橙皮苷和迷迭香酸组合改善LPS攻毒大鼠回肠形态
肠道形态通常被用作评价肠道上皮完整性,主要通过绒毛高度、隐窝深度以及绒隐比的变化来直观地反映试验处理对动物健康的影响。绒毛高度增加表明肠道与营养物质接触面积扩大,有助于提高大鼠的消化吸收效率[20]。肠道绒毛来源于隐窝,隐窝深度的降低说明细胞更新减少,细胞增殖率降低,用于细胞增殖、更新所需要的能量减少,有利于动物生长发育[21-22]。有研究表明,给小鼠口服橙皮苷可以显著改善葡聚糖硫酸钠盐(DSS)诱导的结肠组织损伤,减轻炎性细胞浸润以及充血等现象[6],而200 mg/kg的迷迭香酸显著缓解了由三硝基苯磺酸(TNBS)诱导的大鼠结肠炎症状,并缩小了结肠组织溃疡面积[10]。此外,Kamboh等[23]研究指出,LPS攻毒导致肉鸡小肠绒毛高度降低,隐窝深度增加,而染料木黄酮和橙皮苷以剂量依赖的方式显著提高了21日龄肉鸡十二指肠和回肠绒毛高度和绒隐比,并改善了免疫功能。在本研究中,LPS攻毒导致大鼠回肠组织损伤,肠绒毛出现明显断裂,肠道上皮被破坏。无论是橙皮苷、迷迭香酸还是其组合,均显著增加了LPS攻毒大鼠回肠的绒毛高度和绒隐比,并使隐窝深度有所降低。这表明橙皮苷、迷迭香酸及其组合可以改善LPS攻毒导致的大鼠肠道形态损伤,并通过提高绒毛高度、降低隐窝深度,来促进大鼠的消化吸收和生长发育。
3.2 橙皮苷和迷迭香酸组合调节LPS攻毒大鼠回肠食糜菌群结构以及微生物代谢产物
肠道微生物和肠道上皮相互作用,共同维持肠道屏障的完整性[24]。肠道上皮受损可能会导致病原微生物侵袭,打破肠道微生态的动态平衡。为进一步探究橙皮苷和迷迭香酸组合对LPS攻毒大鼠肠道微生物的影响,我们对LPS攻毒大鼠回肠食糜微生物进行了16S rRNA高通量测序分析。本研究中,与LPS组相比,Lactobacillus的相对丰度在Hes组、RA组以及Hes×RA组均显著升高。有研究表明,含有迷迭香酸的油菜花粉提取物可以通过提高Lactobacillus等有益菌的相对丰度,降低拟杆菌属(Bacteroides)等潜在致病菌的相对丰度来调整肠道菌群结构,改善DSS诱导的小鼠结肠炎[25]。相关细胞试验发现苹果提取物中的酚类物质可以增加加氏乳杆菌R(LactobacillusgasseriR)和干酪乳杆菌FMP(LactobacilluscaseiFMP)在Caco-2和HT29-MTX肠上皮细胞的黏附[26]。这些研究结果与本文结果一致。在本研究中,橙皮苷和迷迭香酸组合可能通过增加Lactobacillus的黏附,进而影响肠道中条件致病菌以及其他菌属的生长,促进Lactobacillus的增殖。此外,与LPS组相比,回肠食糜微生物中Corynebacterium的相对丰度在Hes组、RA组以及Hes×RA组显著降低,Streptococcus的相对丰度在Hes组和Hes×RA组显著降低。研究发现,Streptococcus通过激活炎症小体来刺激白细胞介素-1β(IL-1β)的产生,导致化脓性炎症[27];Corynebacterium是革兰氏阳性菌,感染后会导致免疫力下降,部分Corynebacterium细菌还可能诱发人畜共患病[28]。因为橙皮苷(黄烷酮类物质)和迷迭香酸(酚酸类物质)均属于多酚类物质[29],多酚类物质中的羟苯基结构使得其具有一定的抑菌作用[30],所以回肠食糜微生物中潜在致病菌相对丰度降低可能与橙皮苷和迷迭香酸的抑菌作用有关[8,31]。综上所述,橙皮苷和迷迭香酸组合可以通过促进有益菌定植,减少潜在致病菌的定植来调控肠道微生物区系,有助于保持肠道的微生态平衡。
SCFAs是由肠道微生物分解代谢复杂碳水化合物所产生的,一方面可以为肠道上皮细胞提供能量来源,另一方面可以通过降低部分细胞因子含量,抑制巨噬细胞和中性粒细胞的增殖,来减轻机体炎症反应[32]。在本研究中,与LPS组相比,橙皮苷和迷迭香酸组合显著提高了回肠食糜中微生物代谢产物乙酸、丙酸以及总短链脂肪酸的含量,RA组丙酸含量显著提高,Hes组SCFAs含量没有显著变化。前人研究表明,橙皮苷可以调节糖尿病模型小鼠肠道微生物群的结构,增加粪便中SCFAs的含量,特别是显著增加丁酸的含量[33]。这与本研究结果相似,本试验中Hes×RA组丁酸含量有增加的趋势,但差异不显著。乳酸菌可以促进肠上皮细胞吸收SCFAs[34],皮尔森相关性分析也发现丙酸、丁酸含量与Lactobacillus相对丰度呈显著正相关,乙酸含量与Proteobacteria、Streptococcus相对丰度呈显著负相关,丙酸含量与Actionbacteria、Proteobacteria、Corynebacterium相对丰度呈显著负相关,表明SCFAs含量增加可能与回肠食糜微生物中Lactobacillus等有益菌的相对丰度增加和Proteobacteria、Actionbacteria、Streptococcus、Corynebacterium相对丰度降低有关。有研究表明乙酸和丙酸可以通过抑制结肠癌细胞系中TNF-α介导的NF-κB信号通路的激活来减轻炎症反应[35]。我们推测橙皮苷和迷迭香酸组合促进微生物代谢产物SCFAs生成,可能有助于缓解LPS攻毒所诱导的肠道炎症。
3.3 橙皮苷和迷迭香酸组合减轻LPS攻毒大鼠回肠炎症反应
MPO是中性粒细胞浸润的标志[12]。在本研究中,Hes×RA组大鼠回肠黏膜中MPO活性显著降低,而单一植物提取物的Hes组和RA组没有显著变化,说明橙皮苷和迷迭香酸组合能显著减轻回肠组织炎性细胞浸润程度。与LPS组相比,Hes×RA组大鼠回肠黏膜中促炎因子IL-6的含量显著降低,抑炎因子IL-10的含量显著提高,Hes组IL-6的含量显著降低,RA组TNF-α、IL-10、IL-6的含量无显著变化,说明橙皮苷和迷迭香酸组合可以通过降低促炎因子含量,提高抑炎因子含量来减轻LPS攻毒大鼠的肠道炎症反应,并且效果优于单一植物提取物,这可能是因为橙皮苷的生物利用度较低,迷迭香酸与其配合为橙皮苷脱糖基提供了酸水解的条件,提高了橙皮苷的利用效率。有研究表明,在LPS诱导炎症的HepG2细胞中,橙皮苷以剂量依赖的方式降低IL-6的基因表达[36],此结果在DSS诱导的结肠炎小鼠中也得到证实,研究发现结肠炎小鼠每天灌胃40 mg/kg橙皮苷(纯度>98%)可以显著降低结肠中MPO的活性及TNF-α、IL-6的含量,显著升高IL-10的含量[6]。此外,迷迭香酸可以显著降低1,2-二甲基肼(DMH)诱导的结肠癌大鼠结肠黏膜中促炎因子TNF-α和IL-6的产生,具有一定的抗炎活性[11],这与本研究结果一致。LPS作用于细胞表面受体,激活多种细胞内信号通路,如TLR4/MyD88信号通路、NF-κB抑制物激酶(IKK)/NF-κB信号通路、丝裂原活化蛋白激酶(MAPK)信号通路等,促使炎症因子表达,引发炎症反应[37]。在本研究中,与LPS组相比,橙皮苷、迷迭香酸及其组合显著降低了LPS攻毒大鼠回肠黏膜中IRAK1的mRNA相对表达量,TLR4和MyD88的mRNA相对表达量也有所降低,并且Hes×RA组TRAF6的mRNA相对表达量显著降低。炎症因子的减少与TLR4/MyD88信号通路被抑制有关[38-39],这说明橙皮苷和迷迭香酸组合可能是通过抑制TLR4/MyD88信号通路的激活来减少炎症因子的产生,从而减轻LPS攻毒大鼠回肠炎症反应。
3.4 橙皮苷和迷迭香酸组合改善LPS攻毒大鼠回肠肠道屏障功能
LPS是革兰氏阴性菌细胞壁的重要组成成分,能够造成肠道屏障受损,破坏肠道紧密连接,导致肠道通透性增加,从而加重肠道炎症[40]。ZO-1、Claudin-1和Occludin等紧密连接蛋白在肠道上皮紧密连接中发挥重要作用,有助于维持紧密连接结构的稳定,调节肠道通透性,并且研究证实它们在炎症性肠病中的表达量会显著降低[41-42]。已有研究表明,橙皮苷可以提高Caco-2细胞中紧密连接蛋白ZO-1的mRNA相对表达量,降低肠道通透性[6];迷迭香酸可以通过提高IPEC-J2细胞的物理屏障蛋白Claudin-1和Occludin的表达、降低炎症因子IL-6和IL-8的表达来减轻霉菌毒素所诱导的氧化应激[43],也可以通过提高黏蛋白2(Muc2)以及ZO-1的表达来改善结肠炎小鼠的机械屏障[10]。在本研究中,与LPS组相比,Hes×RA组LPS攻毒大鼠回肠黏膜中紧密连接蛋白Claudin-1和Occludin的mRNA相对表达量显著提高,且ZO-1的mRNA相对表达量也有增加的趋势,单独添加橙皮苷或迷迭香酸对ZO-1、Claudin-1和Occludin的mRNA相对表达量无显著影响。这说明给LPS攻毒大鼠灌胃橙皮苷和迷迭香酸组合可以提高回肠黏膜中紧密连接蛋白的mRNA相对表达量,有助于改善肠道屏障功能,从而缓解肠道炎症。
4 结 论
橙皮苷和迷迭香酸组合有助于改善LPS攻毒引起的大鼠回肠形态损伤,调节菌群结构,减轻炎症反应,改善肠道屏障功能,从而提高大鼠肠道健康状况。

