维生素A对一氧化氮诱导损伤的奶牛乳腺上皮细胞内乳脂合成下降的缓解作用
赵艳丽 刘锦涛 李 愿 郭晓宇 闫素梅 郭咏梅 郑亚光
(内蒙古农业大学动物科学学院,内蒙古自治区高校动物营养与饲料科学重点实验室,呼和浩特 010018)
乳腺是乳合成的重要场所,乳腺的健康直接影响产奶量和乳品质。乳脂是牛奶的重要组成成分,也是衡量乳品质的重要指标。近年来,随着科学技术的快速发展与应用,奶牛的产奶性能逐步提高,随之而引起的乳腺组织氧化损伤和抗氧化机能的平衡失调现象日趋严重,严重影响了牛奶的品质和乳品加工质量,造成奶牛养殖业的经济损失。维生素A是维持动物机体正常生理代谢的必需营养素之一,能通过调控多种基因的表达影响动物机体的生长发育、免疫及抗氧化能力。因此,深入探讨维生素A缓解奶牛乳腺上皮细胞(BMECs)氧化损伤机理,进而调控乳脂合成,对缓解BMECs氧化应激,提高产奶量和乳品质有重要意义。Shi等[1]研究发现,维生素A对脂多糖诱导的BMECs氧化损伤有保护作用,对谷胱甘肽过氧化物酶(GPx)活性及其基因表达有正向影响。冬季在奶牛饲粮中添加维生素A可以显著提高产奶量和奶中非脂乳固体含量以及GPx活性,奶和血清中超氧化物歧化酶(SOD)活性也显著提高[2],可见维生素A的添加提高了GPx与SOD等抗氧化酶的活性,提高了产奶量和乳品质。然而,前人研究多偏重于研究维生素A对BMECs氧化损伤的缓解作用机理以及维生素A对奶牛产奶量及乳品质的影响,有关维生素A对氧化损伤的BMECs内乳脂合成的影响及其调控机理的研究较少。鉴于此,本研究以二乙烯三胺/一氧化氮聚合物(DETA/NO)诱导损伤的BMECs为模型,从基因水平探讨维生素A缓解DETA/NO诱导损伤的BMECs内乳脂合成下降的调控机理,并从中选出适宜的维生素A添加量,为深入研究维生素A对乳脂合成的调控机理提供理论依据。
1 材料与方法
1.1 试剂配制
将100 mg视黄酸(维生素A的主要活性代谢物质,纯度98%,Sigma)溶于4.9 mL二甲基亚砜(DMSO)溶液,配制成20.00 mg/mL的维生素A原液,0.22 μm滤器过滤,-20 ℃保存备用。
1.2 细胞培养与试验设计
采用胶原酶消化法培养BMECs,具体步骤参照Sheng等[3]的方法进行。试验采用单因素完全随机试验设计,将第3代BMECs随机分为9组,对照组(CON组)不添加DETA/NO和维生素A培养30 h;试验1组为DETA/NO损伤组(记为NO组),不添加维生素A培养24 h后添加1 000 μmol/L的DETA/NO继续培养6 h;试验2~8组为维生素A预保护+损伤组,维生素A添加量分别为0.05、0.10、0.20、0.50、1.00、2.00和4.00 μg/mL,分别记为NOA0.05、NOA0.1、NOA0.2、NOA0.5、NOA1、NOA2和NOA4组,添加相应量维生素A培养24 h后添加1 000 μmol/L的DETA/NO继续培养6 h。每组6个重复。
1.3 测定指标与方法
1.3.1 BMECs活力的测定
BMECs活力采用CCK-8法测定,使用细胞相对增殖率(RGR)表示。将传至第3代的细胞悬液接种到96孔细胞板内,按试验设计培养结束后加入20 μL的CCK-8溶液,继续培养1 h,使用全自动酶标仪(Synergy H4,Bio-Tek,美国)于450 nm波长下测定吸光度(OD450)值。试剂盒购于北京碧云天公司。
RGR(%)=(试验组OD450/对照组OD450)×100。
1.3.2 BMECs内甘油三酯(TG)含量的测定
BMECs以5×104个/mL的密度接种于24孔板中,按试验设计培养30 h后,弃培养基,利用胰蛋白酶/乙二胺四乙酸(EDTA)消化细胞,用试剂盒(北京普利莱基因技术有限公司)测定BMECs内TG含量。
1.3.3 BMECs培养液中诱导型一氧化氮合酶(iNOS)活性、一氧化氮(NO)含量及抗氧化指标的测定
BMECs以3×105个/mL的密度接种于60 mm培养皿中,按试验设计培养30 h后,收集培养液和细胞。BMECs内GPx和硫氧还蛋白还原酶(TrxR)活性采用二硫代二硝基苯甲酸法测定;BMECs培养液中活性氧(ROS)、iNOS活性和NO含量均按照酶联免疫吸附试验(ELISA)试剂盒的说明书进行操作,试剂盒购于睿信生物科技有限公司;BMECs培养液中总抗氧化能力(T-AOC)采用钼酸铵显色法测定,SOD活性采用黄嘌呤氧化酶法测定,过氧化氢酶(CAT)活性采用比色法测定,试剂盒均购于南京建成生物工程研究所。
1.3.4 BMECs内乳脂合成相关酶活性的测定
BMECs以3×105个/mL的密度接种于60 mm培养皿中,按试验设计培养30 h后,收集细胞。BMECs内脂肪酸合成酶(FASN)、乙酰辅酶A羧化酶(ACC)、脂酰辅酶A去饱和酶(SCD)、脂蛋白脂酶(LPL)活性均按照ELISA试剂盒的说明书进行操作,试剂盒购于睿信生物科技有限公司。
1.3.5 BMECs内抗氧化和乳脂合成相关基因表达的测定
BMECs以2×105个/mL的密度接种于6孔板中,按试验设计培养30 h后,弃培养基,采用Trizol法[4]提取细胞总RNA,RNA反转录使用PrimeScript RT Reagent Kit(TaKaRa)试剂盒并按说明书进行操作。依据SYBY Premix Ex TaqTMⅡ(TaKaRa)试剂盒说明书,采用实时荧光定量PCR仪(LightCycler480-Ⅱ)进行基因表达的测定,各基因引物序列见表1。以磷酸甘油醛脱氢酶(GAPDH)为内参基因,采用2-△△Ct法计算目的基因的mRNA表达量。
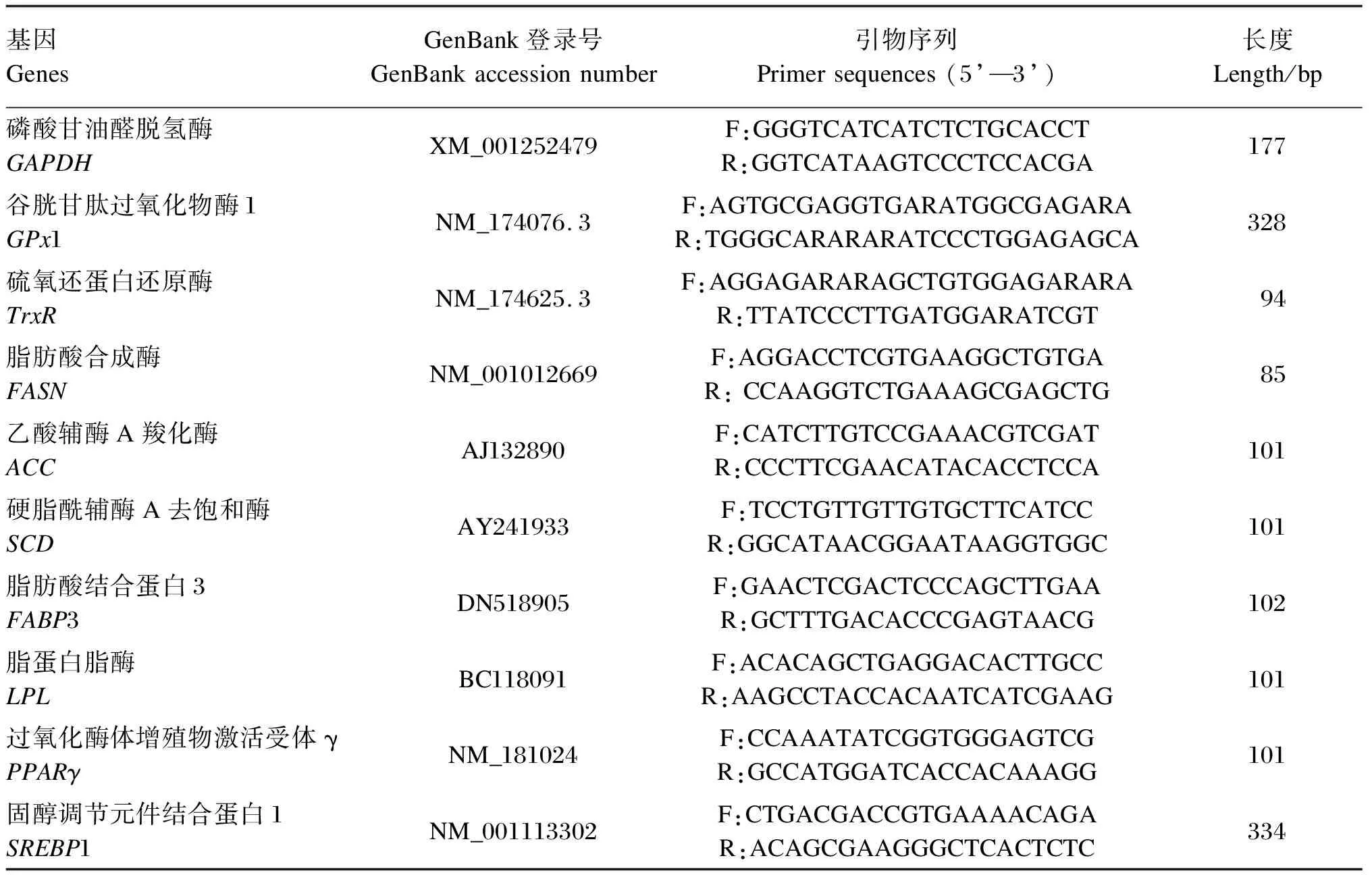
表1 引物序列
1.4 数据处理与分析
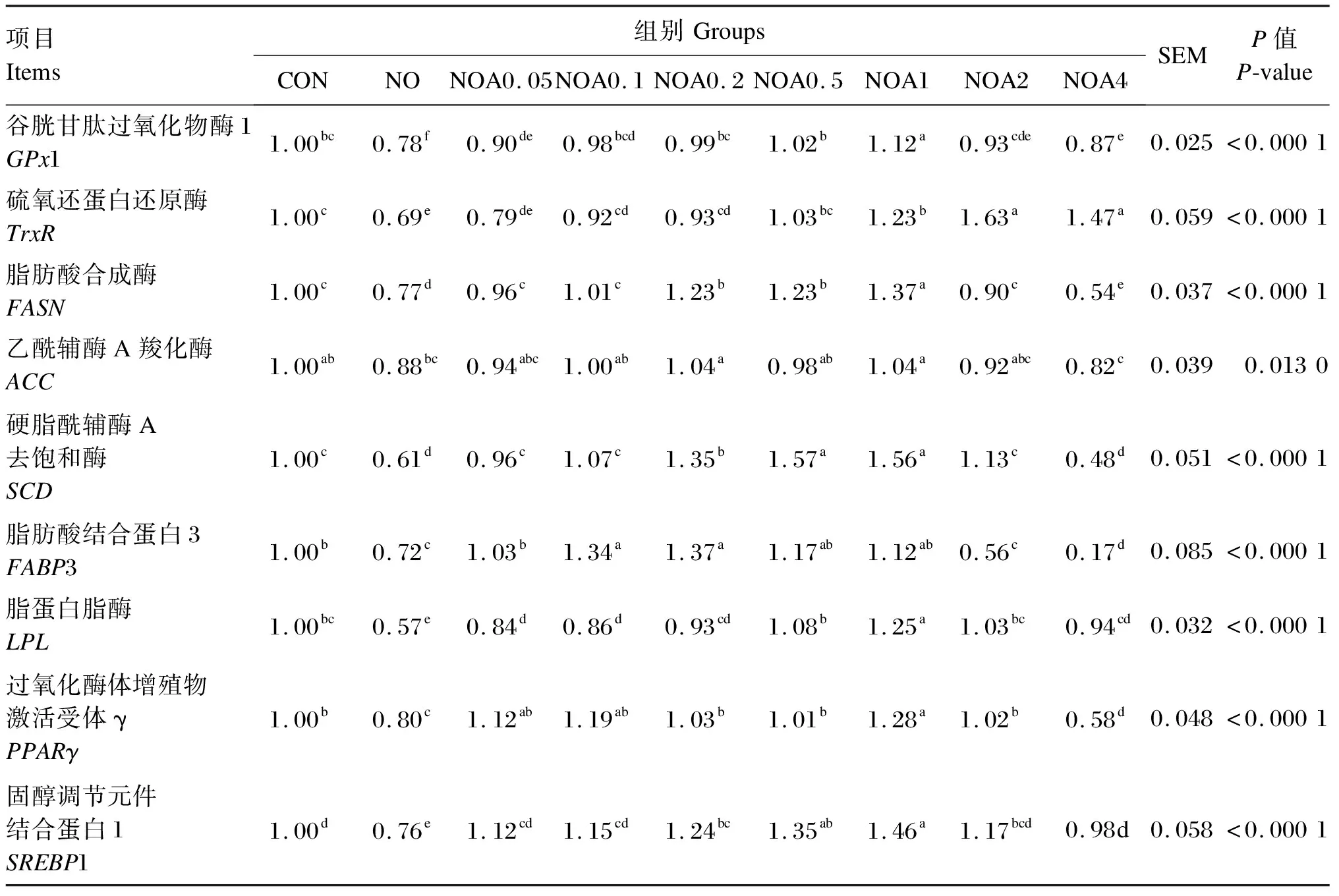
试验数据使用Excel 2019进行整理和计算,采用SAS 9.0软件的ANOVA程序进行显著性检验。P<0.05表示差异显著,0.05 由图1可知,NO组RGR显著低于CON组(P<0.05);与NO组相比,NOA0.1~NOA4组RGR显著增加(P<0.05),尤以NOA1组最高,并显著高于NOA0.1、NOA0.2、NOA0.5、NOA2和NOA4组(P<0.05)。 数据柱标注不同字母表示差异显著(P<0.05)。下图同。 由图2可知,与CON组相比,NO组TG含量显著下降(P<0.05)。与NO组相比,NOA0.2~NOA4组TG含量显著上升(P<0.05),尤以NOA1组最高,并显著高于NOA0.1、NOA0.2、NOA0.5、NOA2和NOA4组(P<0.05),NOA0.5、NOA2和NOA4组间差异不显著(P>0.05)。 图2 维生素A对NO诱导损伤的奶牛乳腺上皮细胞内甘油三酯含量的影响 由表2可知,与CON组相比,NO组iNOS、ROS活性与NO含量显著增加(P>0.05),其他抗氧化指标均显著下降(P<0.05)。与NO组相比,NOA0.2~NOA4组TrxR、CAT和GPx活性显著增加(P<0.05),但iNOS和ROS活性显著下降(P<0.05);NOA0.1~NOA4组T-AOC显著增加(P<0.05),NOA0.05~NOA1组NO含量显著下降(P<0.05)。 表2 维生素A对NO诱导损伤的BMECs培养液中iNOS活性、NO含量及抗氧化指标的影响 由表3可知,与CON组相比,NO组乳脂合成相关酶的活性均显著下降(P<0.05)。NO组FASN、ACC和LPL活性显著低于NOA0.05~NOA4A组(P<0.05),SCD活性显著低于NOA0.05~NOA2组(P<0.05),FASN活性以NOA1组最高,SCD和LPL活性以NOA0.2~NOA1组较高。 表3 维生素A对NO诱导损伤的BMECs内乳脂合成相关酶活性的影响 由表4可知,NO组乳脂合成相关基因的mRNA相对表达量均显著低于CON组(P<0.05)。与NO组相比,NOA0.05~NOA4组GPx1、FASN、LPL和SREBP1的mRNA相对表达量显著上调(P<0.05),且均以NOA1组最高;NOA0.1~NOA4组TrxR的mRNA相对表达量显著上调(P<0.05),以NOA0.2~NOA4组较高。NOA0.05~NOA2组SCD和PPARG的mRNA相对表达量显著高于NO组(P<0.05),其中SCD的mRNA相对表达量以NOA0.5~NOA1组较高,PPARG的mRNA相对表达量以NOA1组最高。NOA0.05~NOA1组FABP3的mRNA相对表达量显著高于NO组(P<0.05),NOA0.2和NOA1组ACC的mRNA相对表达量显著高于NO组(P<0.05)。 表4 维生素A对NO诱导损伤的BMECs内抗氧化和乳脂合成相关基因表达的影响 在泌乳期高产奶牛BMECs代谢率高,产生大量氧自由基,易导致氧化应激发生。正常情况下可以将代谢产生的自由基及时清除,但当机体由于应激产生过量的自由基时,机体自身已经无法将其清除,就会对细胞活力、蛋白质、氨基酸和DNA等生物大分子造成破坏,影响细胞正常的生理功能[5]。GPx、TrxR、CAT、SOD等抗氧化酶活性是反映机体抗氧化功能的重要指标之一。当机体发生氧化应激后,这些抗氧化酶的活性和BMECs活力都会显著降低,而NO含量和iNOS活性会显著提高[6-8]。有研究表明添加视黄酸会显著提高BMECs中GPx和TrxRmRNA相对表达量,同时细胞RGR也有显著提高[9]。本课题组前期试验也表明饲粮中添加适量的维生素A可以显著上调奶牛血清中或BMECs内GPx和TrxR的mRNA相对表达量,TrxR的蛋白相对表达量也有上调的趋势,缓解氧化应激[7-8]。本研究进一步证明,在NO损伤BMECs后,细胞RGR及GPx、TrxR等抗氧化酶活性显著降低,而ROS、iNOS活性与NO含量显著提高,添加维生素A进行预保护则使细胞RGR及抗氧化酶活性显著提高,且维生素A添加量以0.2~4.0 μg/mL较好,这与前人研究结果相一致,表明维生素A预保护可以缓解NO诱导的BMECs氧化损伤。 乳脂是牛奶中重要的营养成分,主要由TG组成,其含量约占所有乳脂成分的98%。TG主要成分是脂肪酸,乳中脂肪酸有2个来源途径,一是由中短链脂肪酸从头合成,二是从血液中吸收长链脂肪酸(LCFA)[10]。ACC和FASN是脂肪酸从头合成的关键酶,FABP3和LPL参与哺乳动物多种组织中长链脂肪酸摄取与细胞内转运[11-12],SCD是催化饱和脂肪酸形成单不饱和脂肪酸的关键限速酶,具有脱氢去饱和作用,SCD的催化产物是TG合成的重要组成部分[13-14]。研究发现,诱导剂损伤的BMECs内抗氧化酶活性下降,同时细胞活力和TG合成、乳脂合成相关酶ACC、LPL、FASN、SCD等的活性和其基因相对表达量显著下降[15-16]。本研究使用维生素A预保护后发现其可以缓解NO诱导损伤的BMECs内FABP3、LPL、FASN、ACC、SCDmRNA相对表达量与TG合成的下降,说明维生素A可能通过缓解脂肪酸的从头合成和长链脂肪酸摄取的下降,进而缓解了TG合成的下降。 PPARγ和SREBP1分别是核转录因子家族和核激素受体家族中的配体激活受体,是脂肪合成基因网络中重要的转录调控因子;同时,PPARγ可抑制多种疾病引起的炎症反应和缓解氧化应激[17],当GPx沉默后PPARγ表达下降,硒不能发挥促进BMECs抗氧化功能的作用[18],说明GPx-PPARγ被激活后提高了细胞的抗氧化功能。PPARγ和SREBP1正向调控ACC、FASN、SCD、LPL等靶基因,进而调节脂肪酸的转运、合成及去饱和过程[19-21]。本课题组前期的研究发现,添加维生素A显著上调了被氧化损伤的BMECs内ACC、FASN、PPARγ和SREBP1的基因表达[22]。本试验发现,被NO损伤后BMECs内GPx1、ACC、FASN、FABP3、SCD、PPARG和SREBP1的mRNA相对表达量显著下降,维生素A预保护可以缓解GPx1、PPARG和SREBP1以及TG合成相关基因表达的下降,表明维生素A可通过激活GPx1的表达上调PPARγ缓解NO诱导损伤BMECs的氧化应激,进而减缓乳脂合成的下降,但具体的调节机理需要进一步研究探讨。 NO诱导损伤的BMECs活力下降,GPx、TrxR、CAT、SOD、ROS、FASN、ACC、SCD、LPL活性和T-AOC以及GPx1、TrxR、PPARγ、SREBP1基因表达下降,iNOS活性和NO含量增加;维生素A预保护上调了抗氧化酶活性及其基因表达,抑制了iNOS和ROS活性及NO合成,缓解了乳脂合成相关酶活性及其基因表达的下降,以0.20~2.00 μg/mL的效果较好,尤以1.00 μg/mL的效果最好。2 结 果
2.1 BMECs活力

2.2 BMECs内TG含量

2.3 BMECs培养液中iNOS活性、NO含量及抗氧化指标
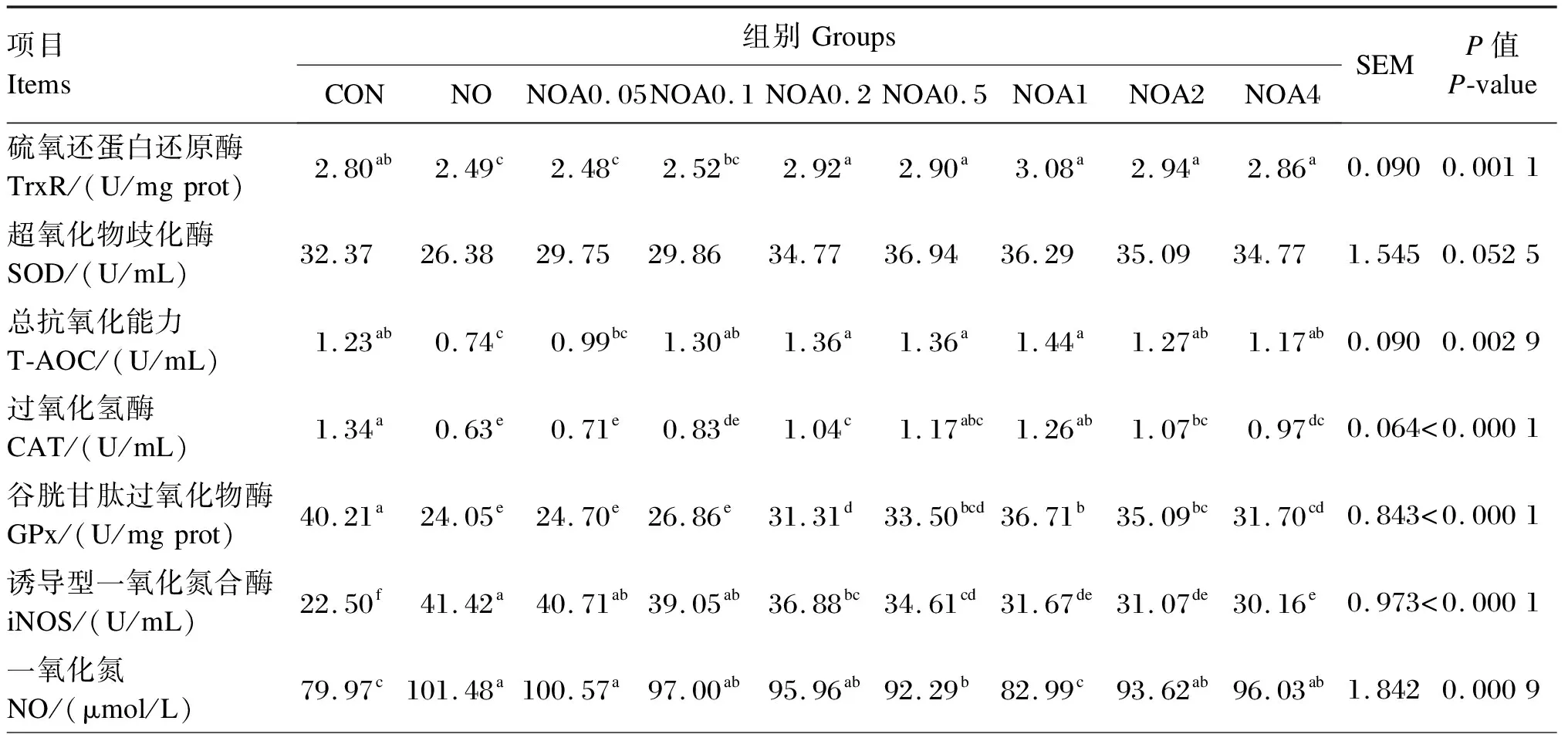
2.4 BMECs内乳脂合成相关酶活性

2.5 BMECs内抗氧化和乳脂合成相关基因表达
3 讨 论
3.1 维生素A对NO诱导损伤的BMECs活力及抗氧化酶活性的影响
3.2 维生素A对NO诱导损伤的BMECs内乳脂合成下降的缓解作用
4 结 论

