木通皂苷D 对LPS 诱导的人脑微血管内皮细胞凋亡和氧化应激的影响及作用机制研究
郗 欧,刘禹岐,马 进,焦富英,阮 林
(1.辽宁中医药大学附属第二医院 脑病一科,辽宁 沈阳 110034;2.辽宁中医药大学附属第二医院心内二科,辽宁 沈阳 110034)
血管内皮细胞覆盖于血管表面,是血液和血管组织之间的天然屏障。脑微血管内皮细胞是血脑屏障的重要组成部分,其损伤是脑血管疾病发生的最直接原因[1]。因此,保护脑微血管内皮细胞损伤对脑血管疾病的治疗尤为重要。木通皂苷D 是中药续断的主要活性成分之一,具有多种药理作用。研究显示,木通皂苷D 可减轻H2O2诱导的血管内皮细胞损伤,提高内皮细胞纤溶功能并抑制血小板的聚集,具有治疗心脑血管疾病的潜在价值[2];木通皂苷D 通过提高肝组织中GSH 和SOD 活性及降低MDA 含量减轻CCl4引起的小鼠急性肝损伤[3]。circ_TTC3 是一种环状RNA(circRNA),参与调控细胞增殖、凋亡、炎症反应和氧化应激等生理或病理过程,其异常表达可影响多种疾病的发展进程。研究显示,circ_TTC3在大脑中动脉闭塞/再灌注(MCAO/R)小鼠模型及葡萄糖剥夺(OGD)诱导的星形胶质细胞中表达升高,敲减circ_TTC3 可降低MCAO/R 小鼠脑梗死面积及脑组织含水量,同时减少OGD 诱导的星形胶质细胞凋亡,其作用机制与靶向调控miR-372-3p/Toll 样受体4(TLR4)轴有关,circ_TTC3 有可能成为中风引起的脑缺血再灌注损伤治疗的分子靶点[4]。本研究建立脂多糖(LPS)诱导的人脑微血管内皮细胞(HBMEC)损伤模型,观察木通皂苷D 对LPS 诱导的HBMEC 凋亡和氧化应激的影响及其能否通过调控circ_TTC3 发挥作用,以期为其用于脑血管疾病的治疗提供一定的实验依据。
1 材料与方法
1.1 实验细胞、试剂和仪器
人脑微血管内皮细胞(上海中乔新舟生物科技有限公司);木通皂苷D(纯度≥98%,上海纯优生物科技有限公司);LPS(美国Sigma 公司);CCK-8 试剂盒、Annexin V-FITC/PI 试剂盒和DMEM 培养液(北京索莱宝科技有限公司);胎牛血清(浙江天杭生物科技有限公司);LipofectamineTM2000 试剂盒(美国Invitrogen 公司);引物序列、circ_TTC3siRNA (si-circ_TTC)和过表达载体(pcDNA-circ_TTC3)、siRNA阴性序列(si-NC)和空载体(pcDNA)(上海生工生物工程股份有限公司);SOD 和MDA 试剂盒(南京建成生物工程研究所)。371 型CO2培养箱(美国ThermoForma 公司);Fax-2100 型酶标仪(美国Awareness 公司);FACSCalibur 分析型流式细胞仪(美国BD 公司);T100 型PCR 仪(美国Bio-Rad 公司)。
1.2 方法
1.2.1 细胞培养和分组处理 复苏HBMEC,加含10% 胎牛血清的DMEM 培养液(基础培养液)置于CO2培养箱中培养。将HBMEC 分为对照组、LPS 组、LPS+木通皂苷D 低、中、高剂量组。对照组细胞用DMEM 培养液培养24 h,LPS 组细胞用含1.0 mg/L[5]LPS的DMEM培养液培养24 h,LPS+木通皂苷D低、中、高剂量组细胞分别用含12.5、25、50 μmol/L[2]木通皂苷D 和1.0 mg/L LPS 的DMEM 培养液共同培养24 h。
1.2.2 CCK-8 法检测细胞增殖抑制率 将对数期HBMEC(2.5 × 104个/mL)接种至96 孔板中,每孔0.2 mL,培养4 h 后,弃培养液,分组处理。处理后,每孔加10 μL CCK-8。孵育2 h,用酶标仪(450 nm)测吸光度(A)值。增殖抑制率(%) = (A对照组-A实验组)/A对照组×100%。
1.2.3 流式细胞术检测细胞凋亡 将对数期HBMEC(2.5 × 104个/mL)接种至6 孔板中,每孔2.5 mL。培养4 h 后,弃培养液,分组处理。处理后,收集各组细胞,用PBS 清洗2 次,并调整密度为1.0 ×106个/mL。取1.0 mL 细 胞 悬 液,1 000 r/min 离 心5 min 后,弃上清,加500 μL 结合缓冲液,重悬细胞。加10 μL Annexin V-FITC,避 光 孵 育10 min。再 加5 μL PI,避光孵育5 min后,用流式细胞仪检测细胞凋亡。
1.2.4 比色法检测细胞中SOD 活性和MDA 含量细胞接种和分组处理同“1.2.3”。处理后,收集各组细胞,PBS 清洗2 次,加细胞裂解液裂解20 min。将裂解液3 500 r/min 离心10 min,取上清液,分别利用SOD 和MDA 试剂盒,采用比色法检测SOD 活性及MDA 含量。
1.2.5 qRT-PCR 检测circ_TTC3 表达 细胞接种和分组处理同“1.2.3”。处理后,收集各组细胞,PBS清洗2 次。用RNA 抽屉试剂盒提取各组细胞中总RNA,逆转录为cDNA 后,进行PCR 反应。引物序列:circ_TTC3 上游5´-CCTGTGTAGAAGCCATCC GT-3´,下 游5´-ATCATCAGTG GTAAAGTCAGGA GTA-3´;GADPH 上 游5´-CCAAGGTCATCCATGA CAAC-3´,下游5´-GCTTCACCACCTTCTTGATG-3´。2-△△Ct法计算circ_TTC3 相对GADPH 的表达量。
1.2.6 细胞转染和处理 将对数期HBMEC(2.5 ×104个/mL)接种至6 孔板中,每孔2.5 mL。培养24 h 后,弃培养液,用LipofectamineTM2000 脂质体法分别转染si-circ_TTC3、si-NC、pcDNA-circ_TTC3、pcDNA。转染12 h 后,更换为完全培养液。再培养24 h 后,弃培养液,qRT-PCR 法检测细胞中circ_TTC3 表达验证转染效果。转染si-NC、si-circ_TTC3 的HBMEC 均用含1.0 mg/L LPS 的培养液培养24 h,分别记为LPS + si-NC 组、LPS + si-circ_TTC3组。转染pcDNA、pcDNA-circ_TTC3 的HBMEC 均用含50 μmol/L 木通皂苷D 与1.0 mg/L LPS 的培养液共同培养24 h,分别记为LPS +木通皂苷D + pcDNA组、LPS +木通皂苷D + pcDNA-circ_TTC3 组。分别按照“1.2.2”“1.2.3”“1.2.4”项下方法检测细胞增殖抑制率、凋亡率及细胞中MDA 含量和SOD 活性。1.2.7 统计学方法用SPSS 22.0 软件进行数据分析,计量资料用均数 ± 标准差(±s)表示,两组间比较采用t检验,多组间比较采用方差分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 木通皂苷D 对LPS 诱导的HBMEC 凋亡和氧化应激的影响
LPS 组HBMEC 增殖抑制率、凋亡率及细胞中MDA 含量均高于对照组(P< 0.05),细胞中SOD 活性低于对照组(P< 0.05)。LPS +木通皂苷D 低、中、高剂量组HBMEC 增殖抑制率、凋亡率及细胞中MDA 含量均低于LPS 组(P< 0.05),细胞中SOD活性高于LPS 组(P< 0.05),且LPS +木通皂苷D 低、中、高剂量组各检测指标两两组间比较差异均具有统计学意义(P< 0.05),见图1、表1。
表1 木通皂苷D 对LPS 诱导的HBMEC 凋亡和氧化应激的影响(±s,n = 3)Tab. 1 The effect of Akebia saponin D on LPS-induced HBMEC apoptosis and oxidative stress (±s,n = 3)
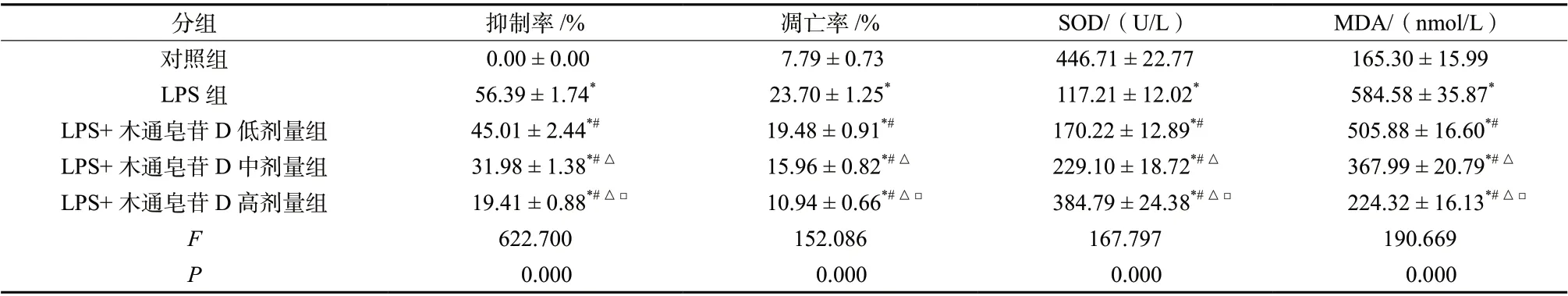
表1 木通皂苷D 对LPS 诱导的HBMEC 凋亡和氧化应激的影响(±s,n = 3)Tab. 1 The effect of Akebia saponin D on LPS-induced HBMEC apoptosis and oxidative stress (±s,n = 3)
注:与对照组相比,*P < 0.05;与LPS 组相比,#P < 0.05;与LPS+木通皂苷D 低剂量组相比,△P < 0.05;与LPS+木通皂苷D 中剂量组相比,□P < 0.05。
分组 抑制率/% 凋亡率/% SOD/(U/L) MDA/(nmol/L)对照组 0.00 ± 0.00 7.79 ± 0.73 446.71 ± 22.77 165.30 ± 15.99 LPS 组 56.39 ± 1.74* 23.70 ± 1.25* 117.21 ± 12.02* 584.58 ± 35.87*LPS+木通皂苷D 低剂量组 45.01 ± 2.44*# 19.48 ± 0.91*# 170.22 ± 12.89*# 505.88 ± 16.60*#LPS+木通皂苷D 中剂量组 31.98 ± 1.38*#△ 15.96 ± 0.82*#△ 229.10 ± 18.72*#△ 367.99 ± 20.79*#△LPS+木通皂苷D 高剂量组 19.41 ± 0.88*#△□ 10.94 ± 0.66*#△□ 384.79 ± 24.38*#△□ 224.32 ± 16.13*#△□F 622.700 152.086 167.797 190.669 P 0.000 0.000 0.000 0.000
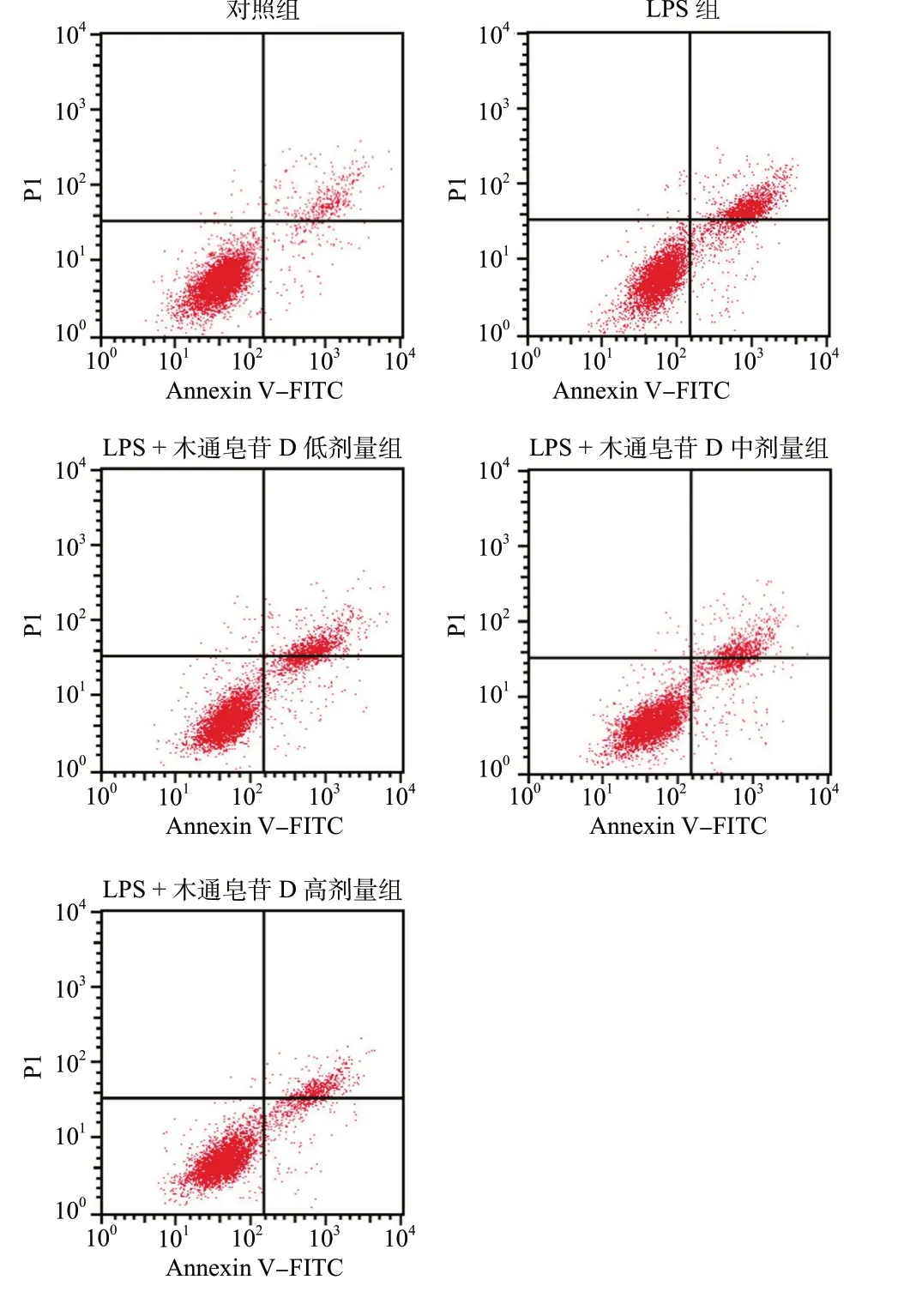
图1 木通皂苷D 抑制LPS 诱导的HBMEC 凋亡Fig. 1 Akebia saponin D inhibits LPS-induced HBMEC apoptosis
2.2 木通皂苷D 对LPS 诱导的HBMEC 中circ_TTC3表达的影响
LPS 组HBMEC 中circ_TTC3 表 达 量 高 于 对 照组(P< 0.05)。LPS+木通皂苷D 低、中、高剂量组HBMEC 中circ_TTC3 表达量均低于LPS 组(P<0.05),且LPS+木通皂苷D 低、中、高剂量组circ_TTC3 表达量两两组间比较差异均具有统计学意义(P< 0.05),见表2。
表2 木通皂苷D 对LPS 诱导的HBMEC 中circ_TTC3 表达的影响(±s,n = 3)Tab. 2 The effect of Akebia saponin D on the expression of circ_TTC3 in HBMEC induced by LPS (±s,n = 3)

表2 木通皂苷D 对LPS 诱导的HBMEC 中circ_TTC3 表达的影响(±s,n = 3)Tab. 2 The effect of Akebia saponin D on the expression of circ_TTC3 in HBMEC induced by LPS (±s,n = 3)
注:与对照组相比,*P < 0.05;与LPS 组相比,#P < 0.05;与LPS+木通皂苷D 低剂量组相比,△P < 0.05;与LPS+木通皂苷D 中剂量组相比,□P < 0.05。
分组 circ_TTC3对照组 1.00 ± 0.00 LPS 组 4.27 ± 0.12*LPS+木通皂苷D 低剂量组 3.44 ± 0.09*#LPS+木通皂苷D 中剂量组 2.88 ± 0.10*#△LPS+木通皂苷D 高剂量组 1.73 ± 0.13*#△□F 521.446 P 0.000
2.3 沉默或过表达circ_TTC3 的转染效果验证
si-circ_TTC3 组HBMEC 中circ_TTC3 表 达 量 为0.41 ± 0.03,明显低于si-NC 组circ_TTC3 表达量1.00 ±0.00(t= 34.064,P< 0.05), 说 明 si-circ_TTC3 组HBMEC 中circ_TTC3 表达较si-NC 组沉默。pcDNAcirc_TTC3 组HBMEC 中circ_TTC3 表达 量 为1.96 ±0.06,明显高于pcDNA组circ_TTC3表达量1.00 ± 0.00(t= 26.847,P< 0.05),说明pcDNA-circ_TTC3 组HBMEC 中circ_TTC3 表达较pcDNA 组过表达。
2.4 沉默circ_TTC3 对LPS 诱导的HBMEC 凋亡和氧化应激的影响
LPS + si-circ_TTC3 组HBMEC 增殖抑制率、凋亡率及细胞中MDA 含量均低于LPS + si-NC 组(P<0.05),细胞中SOD 活性高于LPS + si-NC 组(P<0.05),见图2、表3。
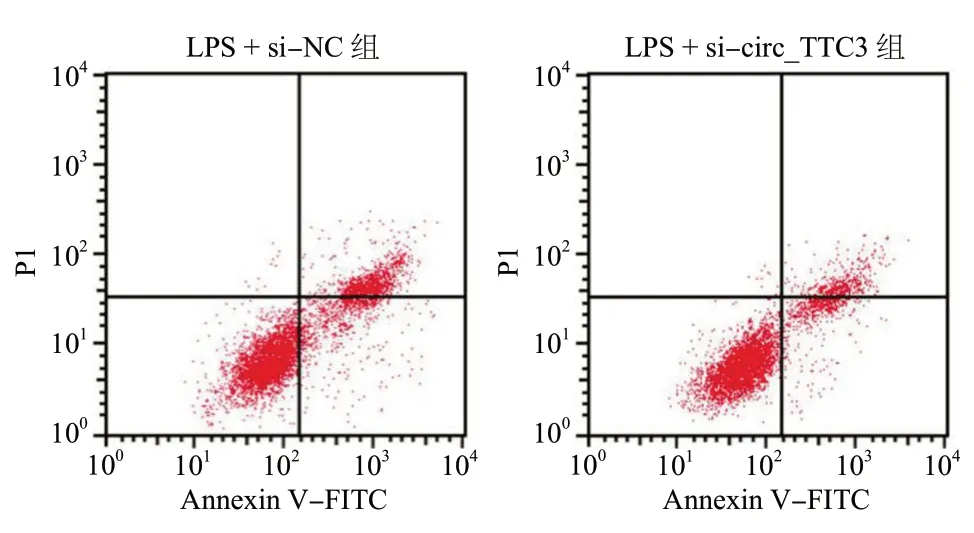
图2 沉默circ_TTC3 抑制LPS 诱导的HBMEC 凋亡Fig. 2 Silencing circ_TTC3 inhibits LPS-induced HBMEC apoptosis
表3 沉默circ_TTC3 对LPS 诱导的HBMEC 凋亡和氧化应激的影响(±s,n = 3)Tab. 3 The effect of silencing circ_TTC3 on LPS-induced HBMEC apoptosis and oxidative stress(±s,n = 3)
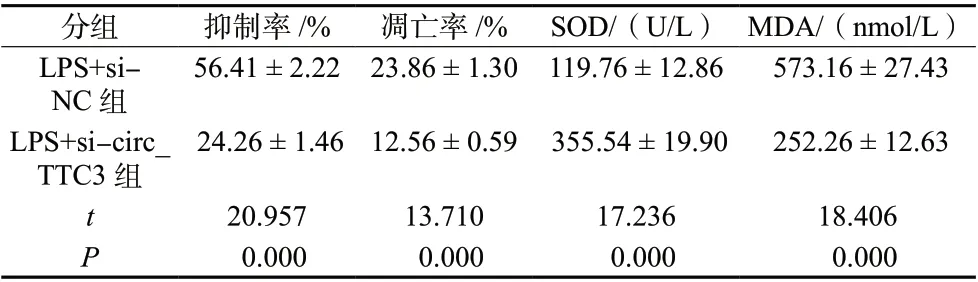
表3 沉默circ_TTC3 对LPS 诱导的HBMEC 凋亡和氧化应激的影响(±s,n = 3)Tab. 3 The effect of silencing circ_TTC3 on LPS-induced HBMEC apoptosis and oxidative stress(±s,n = 3)
分组 抑制率/% 凋亡率/% SOD/(U/L) MDA/(nmol/L)LPS+si-NC 组56.41 ± 2.22 23.86 ± 1.30 119.76 ± 12.86 573.16 ± 27.43 LPS+si-circ_TTC3 组24.26 ± 1.46 12.56 ± 0.59 355.54 ± 19.90 252.26 ± 12.63 t 20.957 13.710 17.236 18.406 P 0.000 0.000 0.000 0.000
2.5 过表达circ_TTC3 逆转木通皂苷D 对LPS 诱导的HBMEC 凋亡和氧化应激的影响
LPS +木通皂苷D+pcDNA-circ_TTC3组HBMEC增殖抑制率、凋亡率及细胞中MDA 含量均高于LPS +木通皂苷D + pcDNA 组(P< 0.05),细胞中SOD 活性低于LPS +木通皂苷D + pcDNA 组(P< 0.05),见图3、表4。
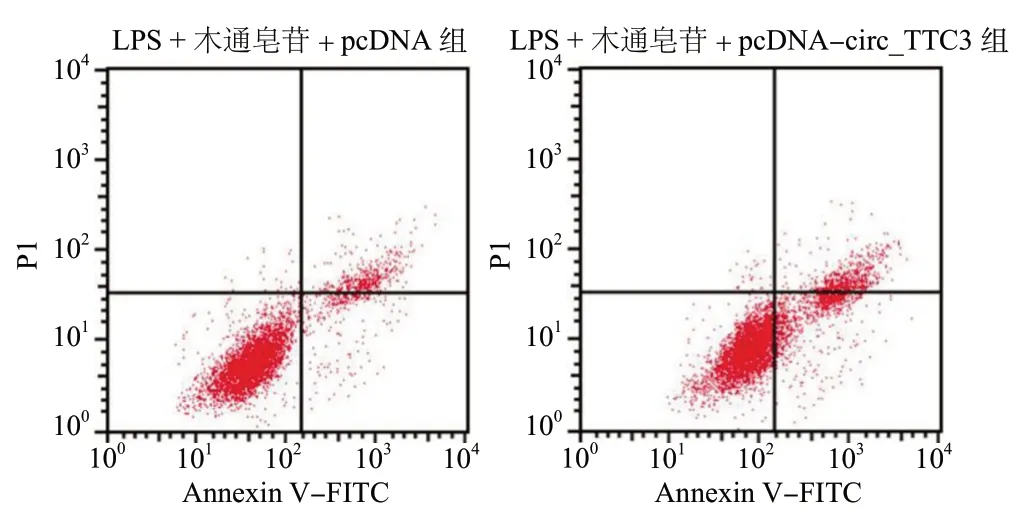
图3 过表达circ_TTC3 逆转木通皂苷D 对LPS 诱导的HBMEC 凋亡的抑制作用Fig. 3 Overexpression of circ_TTC3 reverses the inhibitory effect of Akebia saponins D on LPS-induced HBMEC apoptosis
表4 过表达circ_TTC3 逆转木通皂苷D 对LPS 诱导的HBMEC 凋亡和氧化应激的作用(±s,n = 3)Tab. 4 Overexpression of circ_TTC3 reverses the effect of Akebia saponin D on LPS-induced HBMEC apoptosis and oxidative stress(±s,n = 3)
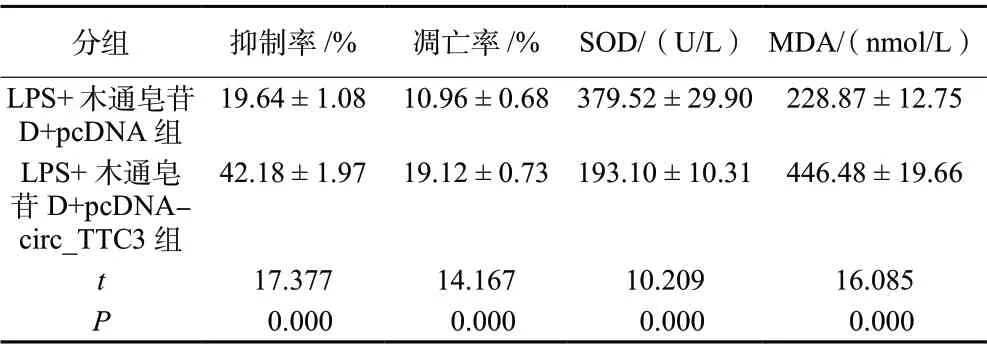
表4 过表达circ_TTC3 逆转木通皂苷D 对LPS 诱导的HBMEC 凋亡和氧化应激的作用(±s,n = 3)Tab. 4 Overexpression of circ_TTC3 reverses the effect of Akebia saponin D on LPS-induced HBMEC apoptosis and oxidative stress(±s,n = 3)
分组 抑制率/% 凋亡率/% SOD/(U/L) MDA/(nmol/L)LPS+木通皂苷D+pcDNA 组19.64 ± 1.08 10.96 ± 0.68 379.52 ± 29.90 228.87 ± 12.75 LPS+木通皂苷D+pcDNAcirc_TTC3 组42.18 ± 1.97 19.12 ± 0.73 193.10 ± 10.31 446.48 ± 19.66 17.377 14.167 10.209 16.085 P 0.000 0.000 0.000 0.000 t
3 讨论
人脑微血管内皮细胞(HBMEC)是脑内微环境的主要结构,HBMEC 的损伤是常见脑微血管疾病的使动环节。脑组织损伤后,脑微血管挛缩、内皮细胞体积变小、细胞间的间隙增加,逐步形成血栓,加重脑损伤[6]。LPS 是革兰氏阴性菌细胞壁的主要成分,其可激活细胞内的氧化应激反应和凋亡途径,诱导细胞损伤[7]。LPS 诱导的HBMEC 损伤模型常被用于体外模拟脑损伤。在LPS 的作用下,内皮细胞内的多种氧化酶产生大量活性氧(ROS),过量的ROS可引起细胞内氧化应激反应,造成细胞氧化损伤[8]。MDA 是脂质过氧化产物之一,其水平高低可间接反应细胞内氧化应激水平[9]。SOD 是一种抗氧化酶,其可清除氧自由基,减轻细胞氧化损伤[10]。细胞内MDA 含量的增加及SOD 活性的降低可说明细胞氧化受损。
续断是川续断科多年生草本植物川续断DipsacusasperWall.ex Henry 的干燥根,具有补肝、强筋骨等功效。木通皂苷D 是续断的主要活性成分,具有神经保护、心肌保护、抗骨质疏松、保肝降脂等药理作用[11]。已有研究表明,木通皂苷D 可抑制神经酰胺诱导的肺上皮细胞凋亡,具有治疗缓解神经酰胺诱导的急性肺损伤的潜在价值[12];木通皂苷D 可通过下调ECE2 和A2M 基因表达保护PC12 细胞免受Aβ25-35损伤[13]。然而,还未见木通皂苷D 影响人脑微血管内皮细胞损伤的相关报道。本研究结果显示,木通皂苷D 抑制LPS 引起的HBMEC 凋亡及氧化应激损伤。
circRNA 是一类非编码RNA,呈闭合环状,结构稳定且高度保守。近年来,随着对circRNA研究的深入,发现其在细胞增殖、凋亡、氧化应激等过程中起重要调控作用[14-16]。研究已表明,circ_0003423[17]、circ_ANRIL[18]等circRNA 参 与 调控HBMEC 损伤,可作为减轻HBMEC 损伤的分子靶点。作为一种circRNA,circ_TTC3 也参与调控细胞凋亡、炎症反应及氧化应激等过程[19-20]。本研究结果显示,circ_TTC3 也可能成为减轻HBMEC 损伤的分子靶点,且木通皂苷D 可能通过下调circ_TTC3来抑制LPS 诱导的HBMEC 凋亡和氧化应激反应。
4 结论
木通皂苷D 可能通过下调circ_TTC3 表达在LPS诱导的HBMEC 损伤模型中发挥保护作用,其具有治疗脑血管疾病的潜在药用价值。但本实验仅利用体外细胞实验进行了研究,后续将进一步在体内验证木通皂苷D 对HBMEC 损伤的保护作用,同时进一步探究circ_TTC3 调控的下游基因和信号通路。

