Angiopep-2 修饰红景天苷/淫羊藿苷脂质体的处方优化及对N2a 细胞主动靶向性的考察
张新悦,严德康,耿宏侠,王宇佳,李学涛
(辽宁中医药大学 药学院,辽宁 大连 116600)
阿尔茨海默病(Alzheimer’s disease,AD)作为危害老年人健康的第四大“杀手”,对老年人健康和生活质量造成巨大威胁[1]。中医药所提出的“补肾填髓”[2]理论,认为“肾主骨生髓,脑为髓之海”,通过滋养补肾可以起到改善脑部机能的作用。补肾药淫羊藿具有补肾强筋、保护中枢神经元的作用[3];红景天作为抗氧化藏药[4],可以有效抑制脑内过氧化物的生成。两药联用可协同增加药效。
但淫羊藿苷在水中的溶解性差,生物利用度低[5],绝大部分药物不能进入脑组织中;红景天苷主要通过肝肾代谢,代谢速度快,脑中的含量更是微乎甚微[6]。脂质体作为一种新型纳米给药载体[7],可同时包载亲水性和疏水性药物,解决药物溶解性差等问题,但同时脂质体的被动靶向效率较低,本实验通过将脑靶向短肽Angiopep-2(TFFYGGSRGKRNNFKTEEY)[8]修饰在脂质体表面,来增强脑部细胞对药物的摄取。
本研究通过制备Angiopep-2 修饰的红景天苷和淫羊藿苷脂质体,采用Box-Behnken 响应面法优选出最佳处方,并选用小鼠神经瘤母细胞[9]来考察Angiopep-2 的主动靶向能力,为该制剂后续在体内外进一步研究提供了基础。
1 材料
1.1 主要仪器
2010AHT 型高效液相色谱仪(日本岛津公司);DZKW-S-4 型电热恒温水浴锅(北京市永光明医疗仪器有限公司);RE52C 型旋转蒸发器(上海亚荣生化仪器厂);JY92-2D 型超声波细胞破碎机(宁波新芝生物科技股份有限公司);葡聚糖凝胶(Sepha-dex)G50柱(上海华蓝化学科技有限公司);YA1072 型透析袋MD34(8000 ~14000D)(北京索莱宝科技有限公司)。
1.2 药品与试剂
淫羊藿苷(Ica,批号:J0703A,纯度≥98%)、红景天苷(Sal,批号:A0902AS,纯度≥98%)、柔红霉素(DNR,批号:28008-55-1,纯度≥98%)、胆固醇(Chol,批号:F0119A)、pH7.4 磷酸缓冲盐溶液(批号:1022Q021)均购于大连美仑生物技术有限公司;Angiopep-2(上海楚肽生物科技有限公司);蛋黄卵磷脂(EPC,批号:120015)、DSPEPEG2000、DSPE-PEG2000-NH2均购于日本NOF 公司;DMEM 培养基、青链霉素双抗、胎牛血清、胰蛋白酶均购自美国Gibco 公司;甲醇、乙腈均为色谱纯。
1.3 细胞
小鼠神经瘤母细胞(N2a)购于中国医学科学院基础医学研究所。
2 方法与结果
2.1 脂质体的制备
采用薄膜分散法-硫酸铵水化法制备。精密称取 适 量 的DSPE-PEG2000、DSPE-PEG2000-NH2、蛋黄卵磷脂、胆固醇、淫羊藿苷、甲醇于圆底烧瓶中,减压旋蒸,直至生成薄膜。加入浓度为250 mm硫酸铵水溶液5 mL 将薄膜溶解,于超声波细胞捣碎机中处理10 min 后,过0.22 μm 微孔滤膜。再将脂质体装入透析袋中,放入盛有PBS 溶液的烧杯中避光透析24 h,每8 h 更换1 次PBS。24 h 后,称取适量红景天苷置于圆底烧瓶中,加入甲醇旋蒸成膜,将透析好的脂质体倒入装有红景天苷的圆底烧瓶中,于40℃水浴条件下振摇20 min,即得红景天苷/淫羊藿苷脂质体。精密称取2 mg Angiopep-2,溶解于红景天苷/淫羊藿苷脂质体中,室温搅拌4 h,即得Angiopep-2 修饰的红景天苷/淫羊藿苷脂质体。按上述制备方法,除不加入红景天苷、淫羊藿苷外,同法制得空白脂质体。
2.2 包封率测定方法的建立
2.2.1 溶液的制备 (1)空白溶液:取1 mL 空白脂质体与4 mL 甲醇混匀,超声破乳,即得。(2)供试品溶液:取1 mL Angiopep-2 修饰的红景天苷/淫羊藿苷脂质体与4 mL 甲醇混匀,破乳即得。(3)红景天苷对照品溶液:精密称定红景天苷10 mg,加甲醇制成1 mg/mL 母液,加适量甲醇稀释成0.5 mg/mL红景天苷对照品溶液。(4)淫羊藿苷对照品溶液:精密称定淫羊藿苷 10 mg,加甲醇制成1 mg/mL 母液,加适量甲醇稀释成0.4 mg/mL 淫羊藿苷对照品溶液。
2.2.2 红景天苷的色谱条件 色谱柱:Agilent C18色谱柱(4.6 mm × 250 mm,5 μm);流动相:甲醇-水(20 ∶80,V/V);柱温:30℃;检测波长:275 nm;流速:1.0 mL/min;进样量:20 μL。
2.2.3 淫羊藿苷的色谱条件 色谱柱:Agilent C18色谱柱(4.6 mm × 250 mm,5 μm);流动相:乙腈-水(25 ∶75,V/V);柱温:30℃;检测波长:275 nm;流速:1.0 mL/min;进样量:20 μL。
2.2.4 标准曲线的建立 取“2.2.1”项下红景天苷母液,加甲醇稀释成720、600、480、360、180、90 μg/mL,淫羊藿苷母液稀释成480、400、320、200、120、60 μg/mL,按相应的色谱条件进行测定,以药物浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线,得红景天苷回归方程为Y= 2 122.2X+110 321(R2= 0.999 5),淫 羊 藿 苷 为Y=19 344X+288 198 (R2= 0.999 7),表明红景天苷在90 ~ 720 μg/mL、淫羊藿苷在60 ~ 480 μg/mL浓度范围内线性关系良好。
2.2.5 专属性试验 取“2.2.1”项下空白溶液、供试品溶液、红景天苷对照品溶液、淫羊藿苷对照品溶液各适量进行测定,结果待测成分峰与相邻峰间的分离度均大于1.5,辅料对其无干扰,表明该方法专属性好。
2.2.6 精密度试验 取“2.2.1”项下对照品溶液,测定6 次。结果,红景天苷与淫羊藿苷峰面积的RSD分别为0.32%、0.24%(n=6),表明仪器精密度良好。
2.2.7 重复性试验 取Angiopep-2 修饰的红景天苷/淫羊藿苷脂质体,按“2.2.1”项制备供试品溶液。结果红景天苷与淫羊藿苷峰面积的RSD 分别为0.96%、0.94%(n=6),表明该方法重复性良好。
2.2.8 稳定性试验 取“2.2.1”项下供试品溶液,在 0、2、4、8、12、24 h 分别测定。结果红景天苷与淫羊藿苷峰面积的RSD 分别为0.62%、1.17%(n=6),表明溶液在24 h 之内稳定性良好。
2.2.9 加样回收率试验 按“2.1”项下方法制备Angiopep-2 修饰的红景天苷/淫羊藿苷脂质体,平行制备6 份,加入等体积甲醇,即得破乳液。将已知成分含量的破乳液与相应对照品溶液按 1 ∶1(m/m)混匀,进行测定,计算药物含量。结果红景天苷与淫羊藿苷的平均加样回收率为102.5%、101.56%,RSD为1.7%、0.78%(n=6),表明该方法准确度良好。
2.3 包封率的测定
取适量的Sephadex G50 凝胶柱用PBS 浸泡至溶胀后备用,将Angiopep-2 修饰的红景天苷/淫羊藿苷脂质体1 mL 以1 mL/min 的流速进行洗脱,目的是使未包裹进去的水溶性药物与脂质体溶液分离,观察直至流出溶液为乳光,开始收集,加PBS 定容至5 mL,取等体积甲醇破乳后,另取Angiopep-2 修饰的红景天苷/淫羊藿苷脂质体1 mL,PBS 定容即得,均过0.45 μm 微孔滤膜。
按照“2.2.2”和“2.2.3”项下条件进行测定,依据标准曲线计算红景天苷和淫羊藿苷的含量,通过含量分别计算红景天苷和淫羊藿苷的包封率:包封率(%)=Wa/Wb,Wa代表红景天苷(或淫羊藿苷)过柱后的含量,Wb代表过柱前的含量。
2.4 处方优化
采用Box-Behnken 响应面法优选出Angiopep-2修饰红景天苷/淫羊藿苷脂质体的最佳处方。根据实验室以往经验[10]及文献调研[11],筛选出胆固醇用量(A)、红景天苷用量(B)、超声温度(C)三个因素,考察其对包封率的影响。以包封率加权值(Y)为考察指标,Y=50% ×(Y1+Y2),其中,Y1表示红景天苷的包封率,Y2表示淫羊藿苷的包封率。固定EPC 的用量为33 mg,处方量为5 mL,红景天苷与淫羊藿苷的质量比为1 ∶1 的条件下确定各因素的范围区间(A:2 ~10 mg;B:0.5 ~1.5 mg;C:40 ~60℃),每因素平均筛选出三水平。因素与水平见表1,Box-Behnken 试验设计与结果见表2。
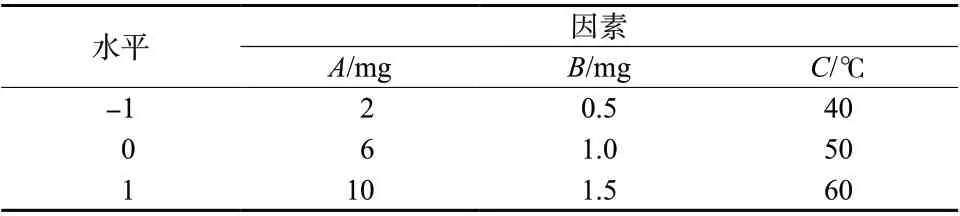
表1 因素与水平Tab. 1 Factors and levels
根据表2 结果,通过Design Expert 8.0.6 软件得到了Y的拟合方程:Y=89.92 + 9.79A- 1.97B+ 0.49C+4.71AB+ 6.02AC- 6.66BC- 11.96A2- 7.27B2- 0.99C2(R2=0.928 9,P<0.05)。由此表明,该拟合模型可较好地反映响应值Y的变化,可用于筛选Angiopep-2修饰的红景天苷/淫羊藿苷脂质体的最佳处方。对模型进行方差分析,结果见表3。可知A、AC、BC、A2、B2项对Y有显著影响(P<0.05),而B、C、AB、C2项影响不显著(P>0.05)。保持其中任一因素水平不变,即可看出其余因素对包封率的影响,见图1。曲线越陡,对包封率影响越大,由图1 可见,A、B两因素对响应值Y的影响较大,C对其影响较小。

图1 各因素对包封率影响的等高线和响应面图Fig. 1 Contour and response surface graph of the effects of each factor on encapsulation efficiency
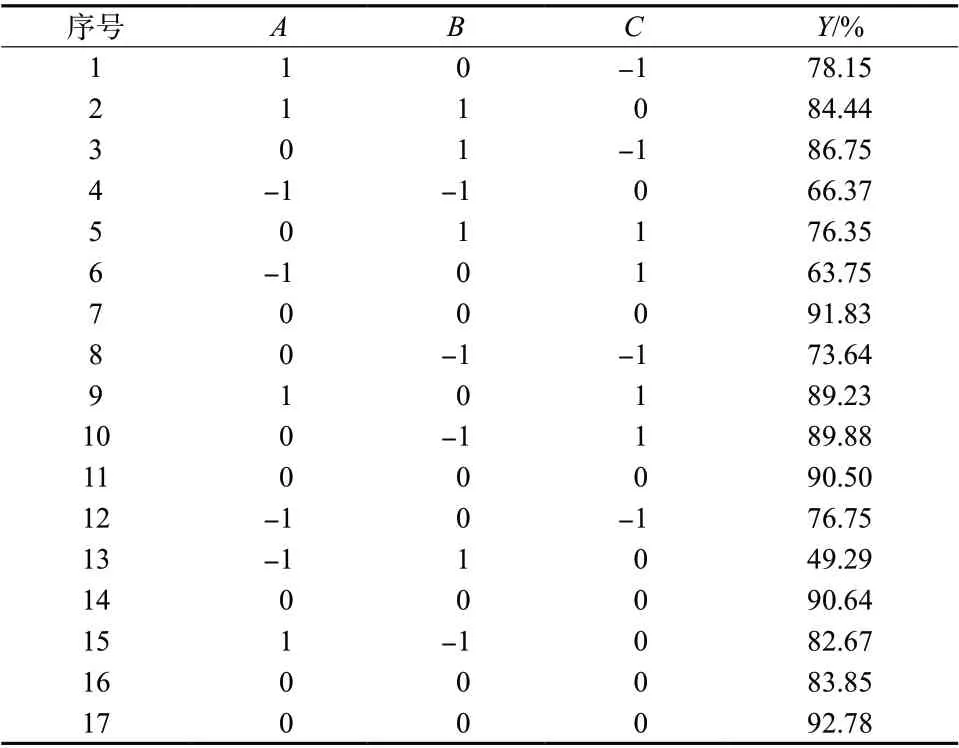
表2 Box-Behnken 试验设计与结果Tab. 2 Design and results of Box-Behnken
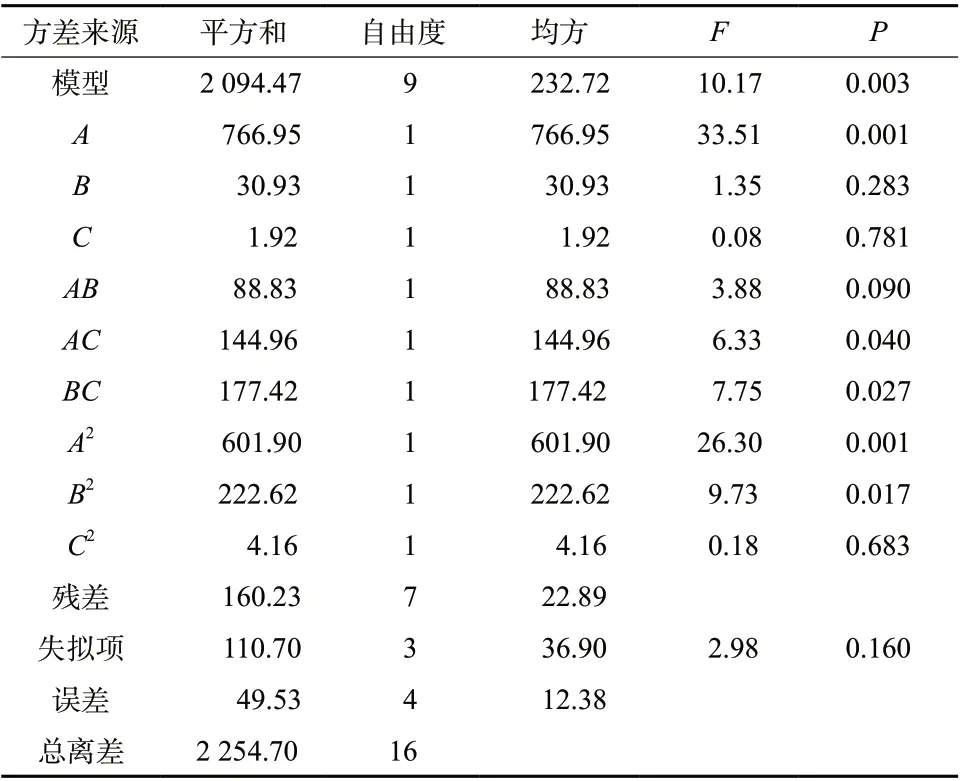
表3 方差分析结果Tab. 3 Analysis results of variance
根据本课题组前期研究经验及处方优选结果,确定Angiopep-2 修饰的红景天苷/淫羊藿苷脂质体的最佳处方为蛋黄卵磷脂33 mg,胆固醇6 mg,红景天苷1.0 mg,淫羊藿苷1.0 mg,超声温度为60 ℃,超声功率为500 W,处方量为5 mL,预测平均包封率为95.76%。按照该处方量制备3 批脂质体,测定其包封率,进行处方验证,得到红景天苷的包封率为(90.85 ± 1.83)%,淫羊藿苷的包封率为(92.59 ±1.20)%,表明该处方合理、方法可行。
2.5 对N2a 细胞主动靶向性考察
2.5.1 荧光脂质体的制备 采用薄膜分散法-硫酸铵水化法制备。精密称取适量的DSPE-PEG2000、DSPE-PEG2000-NH2、蛋黄卵磷脂、胆固醇、甲醇于圆底烧瓶中,减压旋蒸,直至生成薄膜。加入浓度为250 mM 的硫酸铵水溶液5 mL 将薄膜溶解,超声处理10 min 后,装入透析袋中避光透析24 h,每8 h更换1 次PBS。24 h 后,称取适量的荧光探针柔红霉素置于圆底烧瓶中,加入甲醇旋蒸成膜,将透析好的脂质体倒入装有柔红霉素的圆底烧瓶中,于40 ℃水浴条件下振摇20 min,即得柔红霉素脂质体(DNRLip)。精密称取2 mg Angiopep-2,溶解于柔红霉素脂质体中,室温搅拌4 h,即得Angiopep-2 修饰的柔红霉素脂质体(Ang-DNR-Lip)。按上述制备方法,除不加入柔红霉素外,即得空白脂质体(Blank-Lip)。称取适量柔红霉素溶解于水中,即得游离柔红霉素溶液(Free DNR)。
2.5.2 细胞培养 使N2a 细胞贴壁生长在培养瓶中,加入适量DMEM 培养液(10%胎牛血清和1%青链霉素双抗),置于培养箱(37℃,5%CO2)。待细胞融合度长到95%以上时,胰蛋白酶消化,加培养液终止消化,离心,吸取上清液,加适量培养基重悬,继续传代培养。
2.5.3 荧光显微镜考察脂质体的主动靶向性 由于红景天苷和淫羊藿苷都不具有荧光性,所以选用具有荧光性的柔红霉素作为荧光探针,给药浓度为20 μm。将N2a 细胞以5×103个/孔的数量接种到48孔培养板中,继续孵育使其贴壁。给药时间为1、2、4 h,分别加入Blank-Lip、DNR-Lip、Ang-DNR-Lip及Free DNR,继续孵育3 h 后,用PBS 缓冲液冲洗,每孔用500 μL 4%的多聚甲醛固定10 min,冲洗掉多余溶液,加入500 μL DAPI 染色液避光15 min,将细胞于荧光显微镜下观察各孔细胞的荧光强度,并拍照记录。
空白脂质体组未见红色荧光。由于柔红霉素会进入到细胞核中,所以游离柔红霉素的红色荧光强度最强。使用Image J 软件对图片进行荧光强度统计,数据采用柱状图表示,见图2。多组间比较采用方差分析,以P< 0.05 为差异具有统计学意义。与DNR-Lip组相比,Ang-DNR-Lip 组荧光强度增强(P< 0.05),表明该脂质体经过 Angiopep-2 修饰后,对N2a 细胞的主动靶向性增强。通过对1、2、4 h 荧光强度进行比较,可知随着摄取时间的增加,Ang-DNR-Lip 组的荧光强度依次增强。
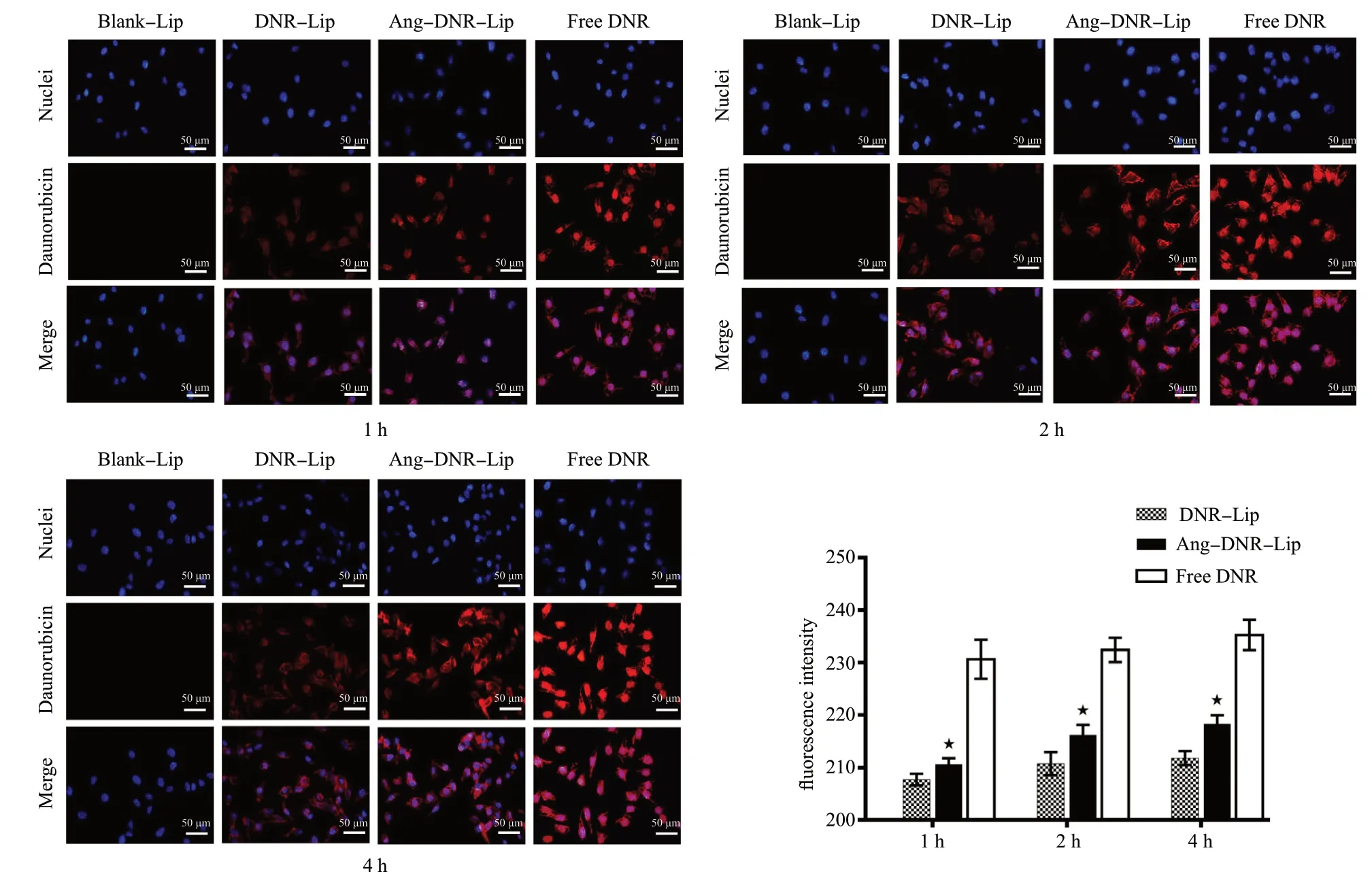
图2 荧光显微镜下观察不同时间段不同脂质体组对N2a 细胞的荧光强度 (n = 3)Fig. 2 Fluorescence intensity of different liposome groups on N2a cells at different time periods observed under fluorescence microscope(n = 3)
3 讨论
本实验主要考察了胆固醇用量、红景天苷用量、超声温度对脂质体包封率的影响。主要膜材成分胆固醇的加入可以使磷脂双分子层的膜固化,但超过一定限度,会导致脂质体成膜不牢固,药物渗漏率增加。由于脂质体独特的双分子层结构,脂溶性药物比水溶性药物更容易包封,所以主要考察水溶性药物红景天苷的用量对包封率的影响,实验表明,当红景天苷用量为1.0 mg 时,包封率较高;红景天苷用量为1.5 mg时,反而下降,因为当水溶性药物超过脂质膜饱和限度时[13],阻碍了药物进入脂质双分子层中,所以并非药物用量越高,包封率越好。超声温度在60 ℃时包封率较高,温度过低会造成成膜时间过长且不均匀。
优化后得到的Angiopep-2 修饰的红景天苷/淫羊藿苷脂质体的最佳处方包封率较高,都在90%以上,结果符合2020 年版《中国药典》规定[13],说明该实验设计科学合理。
在细胞摄取实验中,经Angiopep-2 修饰后脂质体组对N2a 细胞的摄取能力明显高于脂质体组,表明药物成功与受体特异性识别和结合。Angiopep-2作为一种新型的脑靶向短肽,是以受体介导的转运机制与血脑屏障上的低密度脂蛋白受体相关蛋白-1(LRP-1)特异性结合,将药物以内吞的方式,输送至脑组织,提高了脂质体的主动靶向性。Angiopep-2通过与DSPE-PEG2000 交联,不但可以使药物精准作用于病变部位,还延长了药物作用的时间,维持病变部位药物浓度稳定。肽键的不稳定性也是影响Angiopep-2 靶向递药的关键,目前,对Angiopep-2的修饰通常以PEG 修饰,减小药物在体内的首过效应,延长药物的作用时间,从而达到治疗的效果。
4 结论
本研究制备了Angiopep-2 修饰的红景天苷/淫羊藿苷脂质体,并通过星点设计-响应面法确定了最优处方,经验证脂质体包封率较高,改善了两种药物共载包封率较低的问题。将靶向材料Angiopep-2修饰在脂质体上明显提高了脑部细胞对两种药物的摄取能力,改善了药物不能有效达到病变区域的问题,为后续的中枢神经系统疾病或其它脑部疾病的治疗与研究奠定了基础。

