以菌斑控制为导向的糖尿病患者牙周基础治疗效果1 例报告及文献复习
张佩佩, 高东辉, 田 悦, 李红艳
(吉林大学口腔医院牙周科,吉林 长春 130021)
牙周病是一种慢性感染性疾病,是牙齿缺失的主要原因。目前已经公认牙周病是多因素致病疾病,其中牙菌斑生物膜是最主要的致病因素[1]。菌斑微生物及其产物是牙周病发生发展的始动因子,因此须彻底清除菌斑,才能有效预防牙周病的发生和复发。国际上早已明确提出了以菌斑控制为导向的牙周治疗(guided biofilm therapy,GBT)理念。GBT 主要是通过菌斑显色的方法,结合喷砂去除龈上、龈下菌斑,同时延缓菌斑的再沉积[2]。GBT 遵循口腔卫生护理标准,并有助于清除全口菌斑生物膜。相比手术治疗方案,GBT 方法更舒适、更安全。糖尿病(diabetes mellitus, DM)是一种慢性代谢性疾病,在发达国家和发展中国家都是一种流行性疾病。DM 在牙周炎的发生发展过程中起着重要作用,是牙周病的主要危险因素。牙周病是DM 的第六大并发症,其不仅对DM 控制有不利影响,并且可增加DM 并发症的严重程度。因此DM 与牙周病之间存在着“双向关系”,治疗其中一方,对另一方均有积极影响[3]。目前临床上对伴有DM 的牙周炎患者多采用局部清创或抗菌药物的局部使用等治疗方式,虽然可以暂时缓解症状,但治疗效果尚不理想。GBT 针对牙周致病因素,彻底去除菌斑微生物,阻止疾病进展。国内外尚无对伴有DM 的牙周炎患者进行GBT 治疗并长期随访检测血糖水平的相关报道。本文作者报道1 例伴有2 型糖尿病(type 2 diabetes mellitus,T2DM) 的牙周炎患者进行GBT 的临床资料,比较治疗前后患者牙周临床指标和血糖水平,并进行相关的文献回顾,为DM 患者的牙周病治疗提供临床参考。
1 临床资料
1.1 病例资料患者,男性,46 岁。2017年9月19日就诊于本院牙周科。主诉:牙龈出血半年。现病史:半年前患者刷牙时发现牙龈少量出血,漱口后可缓解,近期牙龈偶有自发性出血,影响进食,伴口臭,曾于其他医院口腔门诊行“洗牙”治疗,治疗后症状未见明显改善,来诊。患者口腔卫生习惯:每天刷牙2 次,每次1~2 min,不使用牙线和牙间隙刷等辅助口腔清洁工具。既往史:否认传染病史和吸烟史,无过敏史;DM 6年,使用胰岛素3年,血糖控制不良,当日检测空腹血糖:7.8 mmol·L-1, 糖 化 血 红 蛋 白 (glycated hemoglobin,HbA1c):8.2%。
1.2 专科检查患者口腔卫生状况差,简化口腔卫生指数(simplified oral hygiene index,OHI-S)为1-2。全口牙龈暗红、水肿,边缘肥厚,与牙面分离,龈乳头圆钝。质地松软,上下前牙区13、22 和42 牙位龈缘可见红色糜烂面。全口探诊深度(probing depth, PD) 为4~6 mm, 附 着 丧 失(attachment loss, AL) 为2~3 mm, 探 诊 出 血(bleeding on probing, BOP) 阳 性, 出 血 指 数(bleeding index,BI)为3~5,上下前牙区13、22、23、42 和43 探诊溢脓。可探及大量龈下牙石。前牙深覆,深覆盖。影像学检查:曲面体层片显示下前牙区32~42 牙位牙槽骨Ⅱ°水平吸收,其余牙位牙槽骨Ⅰ°水平吸收(图1)。Florida 电子牙周探针检查, 记录牙周临床指标(BOP 和PD)(图2A),其菌斑阳性率为92%(图2B),风险预测为高风险(图2C)。
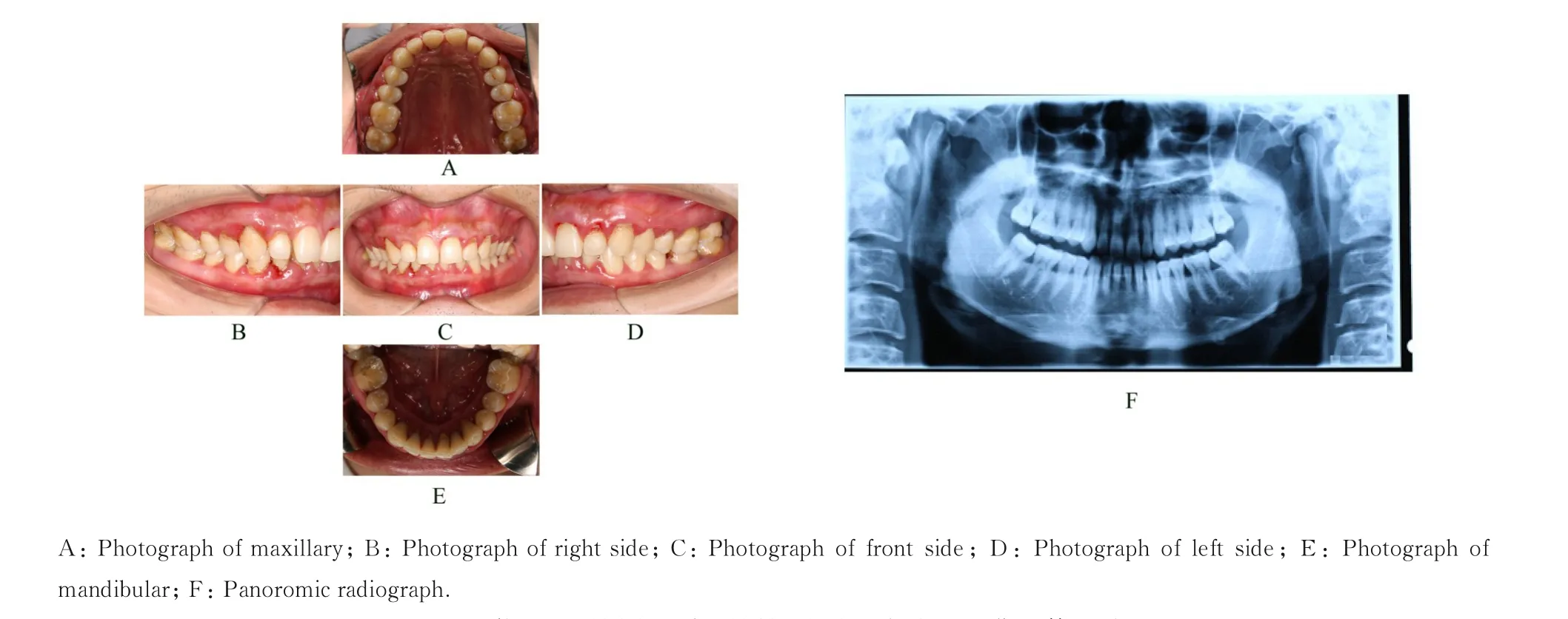
图1 伴DM 牙周炎患者牙周初诊时口内彩照和曲面体层片Fig.1 Intraoral photographs and panoromic radiograph of periodontitis patient with T2DM for first visit

图2 伴T2DM 牙周炎患者牙周初诊时Florida 检查结果、菌斑指数和风险分析Fig.2 Florida examination, plaque index,and risk analysis of periodontitis patient with T2DM for first visit
1.3 诊 断慢性牙周炎(Ⅱ期 广泛型C 级)[4]。
1.4 治疗程序①指导患者实施自我控制菌斑的方法;②施行龈上洁治术、喷砂术、龈下刮治术和根面平整术等消除龈上和龈下的菌斑及牙石;③牙周支持治疗,定期复查、复治。
1.5 治疗过程①口腔卫生指导及治疗:帮助患者理解并掌握自我控制菌斑的方法,如建立正确的刷牙方法,使用牙线和间隙刷等辅助的控制菌斑工具。应用菌斑染色指示剂,检查全口各牙面菌斑附着状况,根据Quigley 和Hein 的菌斑指数及计分方法进行计分,并通过Florida 电子牙周探针快速绘制菌斑分布图,以直观的方式呈现给患者,增强患者自我控制菌斑的意识。行全口超声龈上洁治术和喷砂术。②1 周后,再次菌斑染色,菌斑阳性率为76%,局部麻醉下分次行全口超声龈下刮治和根面平整术。根据菌斑染色结果,进行个性化的口腔卫生指导。③牙周袋内置派丽奥缓释剂,每周1 次,连续4 周。④基础治疗后1 个月复查。牙龈无明显炎症:色淡红,龈缘稍钝,质地较韧。口腔卫生状况欠佳:菌斑阳性率为54%,牙齿表面附着有少量色素和软垢。根据菌斑染色的结果,强化指导患者自我控制菌斑的方法,喷砂去除菌斑、色素及软垢。⑤牙周支持治疗贯穿始终。牙周基础治疗后3 个月复查,风险评估为低风险,但菌斑阳性率为48%,患者自我控制菌斑的能力较差,因此将此患者的复诊间隔定为3 个月。分别于初诊、治疗后1 个月、3 个月、6 个月、1年和2年检查并记录全口牙位的BOP 阳性率、PD、AL 和>5 mm 深牙周袋的数量,以及患者的空腹血糖和HbA1c 水平。
1.6 治疗结果GBT 治疗后1 个月、3 个月、6 个月、1年和2年患者牙周复查结果见图3、图4 和表1。空腹血糖和HbA1c 见表2。2年复查结果显示:全口牙龈无明显炎症,色、形和质地正常(图3),BOP 阳性率为5.95%,PD 平均值为2.18 mm,无>5 mm 深牙周袋,AL 减少至0.98 mm(均值)(表1)。表明治疗后患者牙周临床指数明显改善(图4A),自我菌斑控制良好(图4B);风险因素评估为低风险(图4C)。空腹血糖和HbA1c 水平在牙周基础治疗后1 个月有所降低,2年内控制基本稳定(表2)。
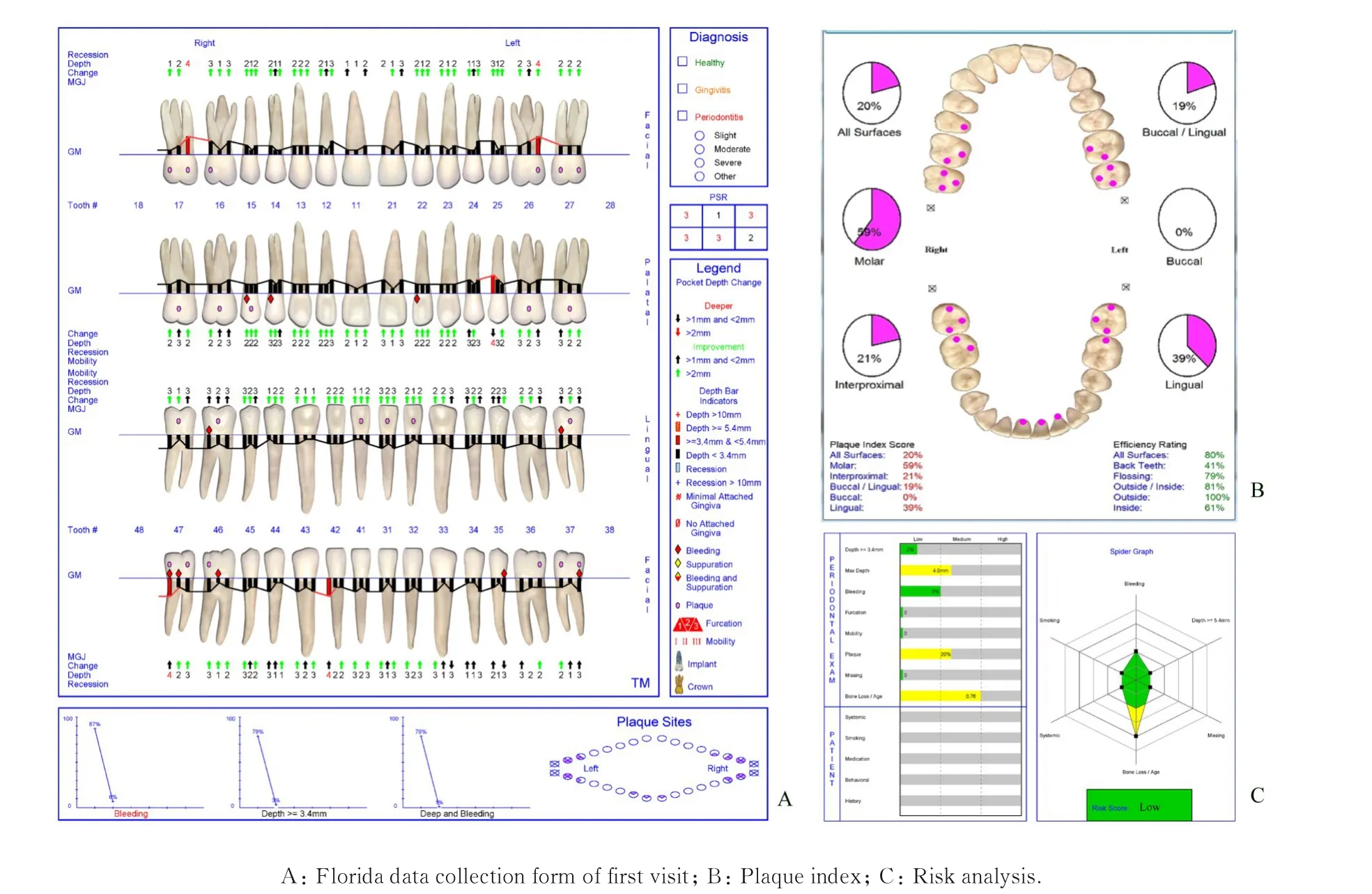
图4 伴T2DM 牙周炎患者GBT 治疗后2年Florida 检查结果、菌斑指数和风险分析Fig.4 Florida examination, plaque index and risk analysis of periodontitis patient with T2DM 2 years after GBT

表1 伴T2DM 牙周炎患者GBT 治疗前后牙周临床参数Tab.1 Periodontal clinical parameters of periodontitis patient with T2DM before and after treatment (n=168)

表2 伴T2DM 牙周炎患者GBT 治疗前后空腹血糖和HbA1c 水平Tab.2 Levels of fasting blood glucose and HbA1c of periodontitis with T2DM before and after treatment

图3 伴T2DM 牙周炎患者GBT 治疗后2年口内照Fig. 3 Intraoral photographs of periodontitis patient with T2DM 2 years after GBT
2 讨论
牙菌斑是以菌斑生物膜形式存在的口腔内致病菌团块,牙菌斑生物膜的形成和堆积是牙周疾病的直接原因[5]。控制菌斑的方法有机械性方法和化学性方法,机械性方法包括刷牙、使用牙线、牙间隙刷、冲牙器[6]、洁治、刮治和喷砂等。漱口水和凝胶等化学性控制菌斑的方法只是辅助性措施,需在机械性清除菌斑的基础上使用[7]。GBT 即通过菌斑显色的方法,使患者直观地观察到菌斑数量、位置和分布,个性化地指导患者自我控制菌斑,保持口腔卫生[8];同时在临床上采用洁治、刮治和喷砂等方法去除龈上和龈下菌斑[9],医患协作延缓菌斑的再沉积,以达到治疗和预防牙周炎的目的。本例患者初诊时经Florida 电子牙周探针检查,结果显示:92%的检查位点存在菌斑附着,未掌握正确的控制口腔卫生的方法。经过多次针对性的口腔卫生指导及GBT,患者末次复诊时20% 检查位点附着菌斑,菌斑控制良好,且牙周临床指标改善明显。
除菌斑是牙周炎的始动因子外,牙周炎的危险因素还包括牙石、牙齿解剖结构和咬合创伤等局部促进因素及年龄、性别和全身系统疾病等全身促进因素。其中DM 与牙周炎密切相关,相互影响[10]。流行病学研究[11-13]发现:DM 患者患牙周炎的风险是非DM 患者的3~4 倍,且症状较非DM 患者严重,对牙周治疗的反应性差。
牙周病的进展与血糖控制情况密切相关[14]。HbA1c 水平升高加快T2DM 患者的牙周炎进展[15]。T2DM 患者的牙周组织中促炎因子:白细胞介素1β (interleukin-1beta, IL-1β)、 白 细 胞 介 素6(interleukin-6,IL-6)、干扰素γ(interferon-gamma,INF-γ)、白细胞介素8(interleukin-8,IL-8)、肿瘤坏 死 因 子α (tumor necrosis factor-alpha,TNF-α)和白细胞介素17 (interleukin-17,IL-17) 的表达水平明显高于非DM 患者[16-17];抗炎因子白细胞介素4 (interleukin-4, IL-4) 和 白 细 胞 介 素10(interleukin-10,IL-10)表达水平则明显降低[18-19]。高水平的血糖可导致晚期糖基化终产物的产生。促炎细胞因子(IL-1β、IL-6 和TNF-α) 和糖基化终产物的积累,诱导氧化应激水平升高,加重牙周软组织和骨组织的破坏,增加AL[20-21]。
牙周炎的发生也影响DM 的控制和稳定。DM患者若伴有牙周炎,其并发症和死亡率较非牙周炎患者高3 倍[22-23]。牙周炎刺激宿主免疫炎症反应,释放一系列促炎因子[IL-1β、IL-6、前列腺素2(prostaglandin 2,PGE-2)、TNF-α、核因子κB 受体活化子配体(receptor activator of nuclear factorκB,RANKL)、基质金属蛋白酶和趋化因子等],同时抑制抗炎因子的产生和释放[24]。这些促炎因子作用于胰岛β 细胞,改变胰岛素信号反应途径,恶化血糖水平,产生胰岛素抵抗,增加DM 并发症的风险[25]。同时,患有牙周炎的T2DM 患者的龈下菌群也发生明显变化[26]。类杆菌、普氏菌、消化球菌、纤毛因子和脱硫菌的检出率明显升高,上述菌群不仅与牙周病的发生发展密切相关,还与HbA1c 水平有关[27]。上述口腔微生物可能通过间歇性菌血症诱发全身炎症,进而增强胰岛素抵抗,促进血糖水平的升高[28]。
牙周治疗使局部致病菌减少,炎症得到控制,血糖水平降低,HbA1c 水平下降,有助于减轻DM患者的胰岛素抵抗,减少降糖药的用量,减少血管并发症[1]。GTB 目的在于去除和控制菌斑,改变宿主菌群的分布和平衡,提高机体的免疫状态,减轻致病菌对牙周组织的炎症性破坏,减少促炎因子的释放,这不仅改善了牙周临床指标,而且对血糖的控制也产生了积极的作用。本例患者GBT 治疗后,牙周状况明显改善,血糖和HbA1c 水平得到有效控制,并在治疗后2年内保持稳定。证明GBT治疗对T2DM 的控制有一定作用[29],积极的牙周治疗对DM 患者有重要意义。
综上所述,GBT 不仅能减轻患者的牙周炎症,而且有助于控制T2DM 患者血糖水平。对于伴有T2DM 的牙周炎患者,要做到控制牙菌斑,进行必要的GBT 和预防,控制口腔感染;而对于某些牙周病患者,建议筛查血糖和HbA1c,以便于DM 的早期发现和治疗。

