芦丁对人结肠癌SW480 细胞凋亡的促进作用及其作用机制
陈素贤, 谷泽慧, 马炀斐, 谭 琦, 李 琪, 王亚帝
(1. 锦州医科大学附属第三医院病理科,辽宁 锦州 120001;2. 锦州医科大学附属第三医院精准医学中心,辽宁 锦州 120001)
结肠癌(colorectal cancer,CRC)是临床上常见的消化道恶性肿瘤之一。在全球范围内,CRC是男性中第3 位和女性中第2 位最常被诊断出的癌症[1],在 我 国 是CRC 发 病 率 第3 位 的 癌 症[2]。尽管CRC 的早期诊断和治疗手段有很大改善,但其5年生存率较低,治疗效果不佳。现行的肿瘤药物不良反应较多,常见骨髓抑制和过敏反应等。因此,寻找不良反应少、质优价廉的药物至关重要。研究[3-4]显示:天然黄酮类衍生物具有抗肿瘤作用,且平价易得,而芦丁是广泛存在于植物中的黄酮醇配糖体,具有抗炎、抗氧化和清除自由基等多种药理作用,同时具有抗肿瘤作用[5]。芦丁可以明显抑制SW480 细胞的增殖,对CRC 的进一步发展起到很好的延缓作用,但芦丁对CRC 的具体作用机制尚不明确,Notch 是结肠癌中常发生突变的基因之一,Notch 在肿瘤中具有致癌特性,更清楚地了解Notch 信号传导及其在结肠癌中的作用可能是发现临床靶标的关键。Notch 信号通路是许多重要细胞信号转导通路的交汇点,在肿瘤发生发展中发挥重要作用。单独的Notch 蛋白并不足以成为有效的致癌基因,必须与其他癌蛋白协作才能导致细胞转化,可与其下游丝裂原活化蛋白激酶(mitogenactivated protein kinase,MAPK) 协作共同推进肿瘤的发生发展。芦丁抗肿瘤作用机制目前尚不清楚,其在CRC 中的抑瘤作用是否与Notch 和MAPK通路有关,目前尚未见相关报道。本研究探讨芦丁作用下CRC 细胞中Notch-1 的表达、促凋亡作用及其可能的分子机制,为CRC 的靶向治疗提供新的思路和药物基础。
1 材料与方法
1.1 数据库筛选毒性与基因比较数据库(Comparative Toxicogenomics Database,CTD)和GeneCards 数据库筛选芦丁相关mRNA,使用在线韦恩图制作软件对预测的与芦丁相关mRNA 取交集用于进一步分析。基因本体(Gene Ontology,GO) 和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库对交集mRNA 进行生物信息学分析。String 数据库分析其交集mRNA 表达的蛋白-蛋白互作(protein-protein interaction,PPI)网络。
1.2 细胞、主要试剂和仪器人CRC SW480 细胞株(吉林大学药学院药理学实验室馈赠)。芦丁(南京景竹生物科技有限公司),γ-分泌酶抑制剂DAPT 和兔抗人Notch-1 抗体(英国Abcam 公司),兔抗人B 细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)、Bcl-2 相 关X 蛋 白(Bcl-2 associated X protein,Bax)、 含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,caspase) -3和caspase-9 一抗及辣根过氧化物酶标记的山羊抗兔二抗(北京中杉金桥生物技术有限公司),DMEM 高糖培养基(美国Hyclone 公司),胎牛血清(浙江天杭生物科技股份有限公司),Notch-1 和GAPDH 引物(北京鼎国昌盛生物技术有限公司),实时荧光定量PCR 试剂盒(real-time fluorescence quantitative PCR,RT-qPCR)(北京全式金生物技术有限公司),Hoechst33258 染色液和Annexin Ⅴ-FITC/PI 凋亡检测试剂盒(碧云天生物技术公司)。Strata Gene Mx3000P 荧光实时定量分析系统(美国Agilent Technologies 公司),mini-protean 小垂直板电泳系统(美国Bio-Rad Laboratories 公司),SpectraMax Plus384 微孔板检测系统(美国Molecular Devices 公司), E-CLIPSE 80i 显微镜(日本Nikon Instruments 公司),CO2恒温培养箱(美国SIM 公司)。
1.3 细胞培养SW480 细胞生长于含10%胎牛血清的DMEM 高糖培养基中进行培养,置于37 ℃、5%CO2培养箱中,约2 d 换液1 次,0.25%胰蛋白酶消化,每周传代2~3 次,取对数生长期细胞用于实验。
1.4 RT-qPCR 和MTT 法检测药物最佳浓度取对数生长期的SW480 细胞,制成1×105mL-1细胞悬液,每孔1 mL 接种于6 孔细胞培养板内,分别给 予DAPT(0.1、1 和10 μmol·L-1) 24 h 后,提取细胞中总RNA,使用逆转录试剂盒将其逆转录成cDNA, 进 行RT-qPCR 实 验, 测 出 相 应 的Ct 值。利用2-△△Ct公式计算Notch-1 mRNA 的相对表达水平,以GAPDH 作为内参,实验重复3次。取对数生长期的SW480 细胞,制成1×104mL-1细胞悬液,每孔200 μL 接种于96 孔细胞培养板内,分别加入芦丁(5、15、45、135 和405 μmol·L-1)和DAPT (1、 2、 4、 8 和10 μmol·L-1) 干 预 人SW480 细胞,药物作用24 h 后,吸去培养液,每孔加入MTT 溶液(5 g·L-1)200 μ L,继 续 培 养4 h,终止培养,吸去MTT 溶液,按照每孔150 μL加入二甲基亚砜(DMSO),置于摇床15 min,使结晶溶解,置于酶标仪上490 nm 波长处检测吸光度(A)值,实验重复3 次,以A 值代表细胞的增殖活性, 根据半数抑制浓度(50% inhibiting concentration,IC50)值选出2 种药物最佳浓度。
1.5 实验分组芦丁与DAPT 分别用DMSO 配成1 mol·L-1的储液,-20 ℃保存备用。实验分为空白对照组(单纯培养基)、芦丁组(22 μmol·L-1)、DAPT 组(1 μ mol·L-1) 和 芦 丁+DAPT 组(22 μmol·L-1芦丁+1 μmol·L-1DAPT)。
1.6 Hoechst33258 核染色法检测细胞凋亡形态取对数生长期的SW480 细胞, 制成1×105mL-1细胞悬液,6 孔细胞培养板内每孔底部放置盖玻片(高压灭菌),使盖玻片浸在细胞培养基内,按每孔1 mL 细胞悬液接种,使细胞在玻片上生长,每组设3 个复孔,细胞贴壁后分组给药,24 h 后收集细胞,使用Hoechst33258 染色液染色,抗荧光淬灭封片液封片后于荧光显微镜下观察细胞凋亡形态,并使用Images Advanced 3.2 成像系统采集图像,实验重复3 次。
1.7 流式细胞术检测各组细胞凋亡率取对数生长期的SW480 细胞,制成每毫升1×105个细胞的悬液,每孔1 mL 接种于6 孔细胞培养板内,细胞贴壁后分组给药, 24 h 后收集细胞, 使用Annexin Ⅴ-FITC/PI 凋亡检测试剂盒,在1 h 内用流式细胞仪检测,实验重复3 次。细胞凋亡率=早期凋亡率+晚期凋亡率。
1.8 Western blotting 法检测凋亡相关蛋白表达水平取对数 生 长 期 的SW480 细 胞, 制 成5×105mL-1细胞悬液,每孔1 mL 接种于6 孔细胞培养板内,细胞贴壁后分组给药,作用24 h 后收集细胞提取蛋白,检测蛋白浓度并计算上样量。进行SDS-PAGE 凝胶电泳,湿转法转膜至PVDF 膜上,5%脱脂奶粉封闭1 h,一抗(1∶2000)4 ℃孵育过夜,TBST 洗膜后加入对应的二抗(1∶5000),采用超敏ECL 化学发光试剂盒检测杂交信号,采用Image J 软件对相应的蛋白进行定量分析,实验重复3 次。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 条带灰度值。
1.9 统计学分析采用SPSS 23.0 统计软件进行统计学分析。各组细胞凋亡率、Notch-1 mRNA 和蛋白表达水平以及凋亡相关蛋白表达水平符合正态分布且方差齐,以-±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 CTD 和GeneCards 数据库中芦丁的交集mRNACTD 数据库中发现与芦丁相关的基因174 个,包括31 个miRNA 和143 个mRNA,筛选mRNA 进行后续分析。GeneCards 数据库中共发现与芦丁相关mRNA 125 个。将上述2 个数据库中的mRNA 取 交 集, 共 得 到34 个mRNA: AHR、ALB、BAX、BCL2、CASP1、CASP3、CASP8、CASP9、 CAT、 CBR1、 CYP19A1、 CYP1A1、EIF2S1、 ERN1、 GSR、 HMOX1、 IGF1、IGF1R、 IL1B、 IRS1、 JUN、 LEP、 MAPK1、MMP9、 MPO、 NFE2L2、 NOS2、 PARP1、SIRT1、 SLC22A2、 SOD1、 TNF、 VEGFA 和XDH。见图1。

图1 CTD 和GeneCards 数据库中芦丁的交集mRNA 韦恩图Fig. 1 Venn diagram of intersection mRNA in CTD and GeneCards databases
2.2 芦丁相关交集mRNA 的GO 和KEGG 通路富集分析对34 个芦丁相关交集mRNA 进行GO 功能分析和KEGG 通路富集,将P值设定为0.05 获得分析结果:生物学进程中主要参与负调控凋亡过程、缺氧反应、巨噬细胞分化、外源性凋亡信号通路、直接凋亡过程和激活MAPK 活动等过程;在细胞组成方面参与线粒体、内质网、溶酶体和死亡诱导信号复合物的形成;在分子功能中与直接蛋白结合、半胱氨酸型内肽酶活性参与凋亡过程及转录因子结合等功能相关;KEGG 信号通路主要富集在癌症、CRC、肿瘤坏死因子(tumor necrosis factor,TNF)、凋亡和MAPK 等。
2.3 String 数据库检测Notch-1 与相关蛋白的作用关系String 数据库中使用PPI 网络分析,得到具有35 个节点数的Notch-1 PPI 网络,见图2A。PPI值为1.0e-16。其中与Notch-1 相互作用的蛋白(score>0.42) 有 16 个, 包 括 AHR、 ALB、CASP3、 CASP8、 HMOX1、 IGF1、 IGF1R、JUN、 LEP、 MAPK1、 MMP9、 NFE2L2、NOS2、SIRT1、TNF 和VEGFA,可参与细胞凋亡、大肠癌、MAPK 信号通路、癌症的途径和癌症中的转录失调等信号通路。交集的信号通路为MAPK 信号通路及凋亡,见图2B。提示Notch-1基因可能通过MAPK、细胞凋亡等关键信号调控CRC 的发生发展。

图2 交集mRNA 与Notch-1 蛋白的相互作用网络Fig.2 Interaction network of intersection mRNA and Notch-1 protein
2.4 DAPT 和芦丁最佳浓度分别给予0.1、1.0 和10.0 μmol·L-1DAPT 后,与空白对照组比较,不同浓度DAPT 组SW480 细胞中Notch-1 mRNA 表达水平均明显降低(P<0.01)。见表1。
表1 各组SW480 细胞中Notch-1 mRNA 表达水平Tab. 1 Expression levels of Notch-1 mRNA of SW480 cells in various groups (n=3,±s)
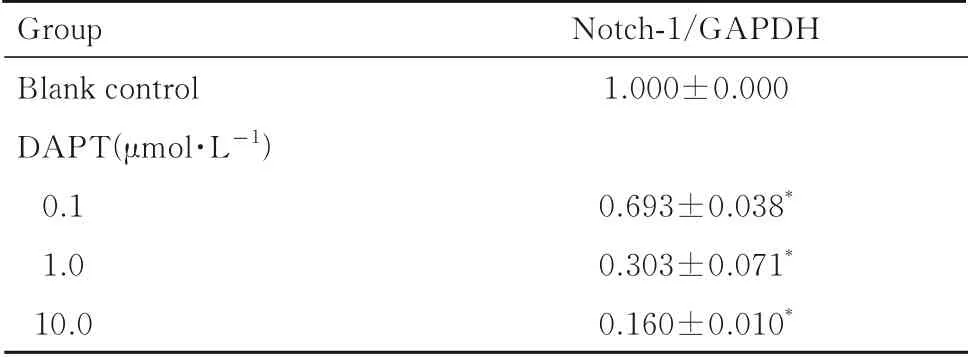
表1 各组SW480 细胞中Notch-1 mRNA 表达水平Tab. 1 Expression levels of Notch-1 mRNA of SW480 cells in various groups (n=3,±s)
*P<0.01 compared with blank control group.
Group Blank control DAPT(μmol·L-1)0.11.010.0 Notch-1/GAPDH 1.000±0.0000.693±0.038*0.303±0.071*0.160±0.010*
1、2、4 、8 和10 μmol·L-1DAPT 干预SW480细胞后,与空白对照组比较,不同浓度DAPT 组细胞增殖活性均降低(P<0.05),降低幅度随着DAPT 浓度的升高逐渐增大。见表2。
表2 不同浓度DAPT 作用后各组SW480 细胞增殖活性Tab. 2 Proliferation activities of SW480 cells after treated with different concentrations of DAPT in various groups(n=3,±s)
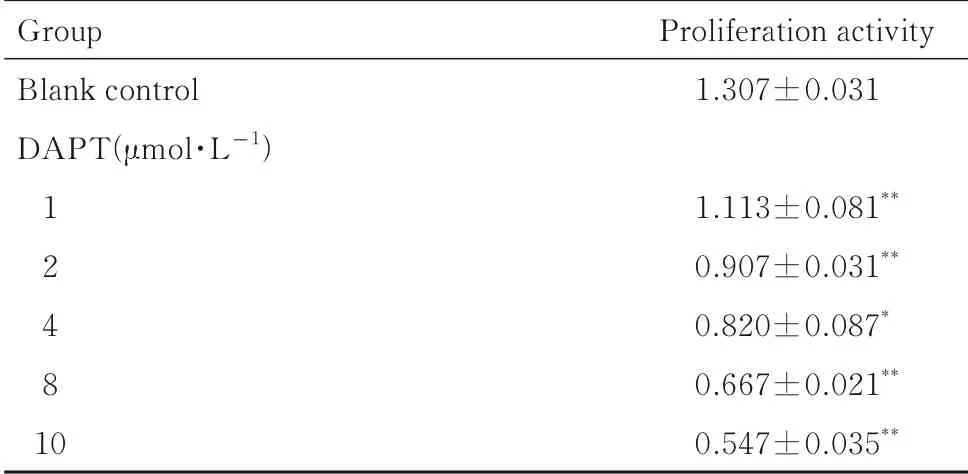
表2 不同浓度DAPT 作用后各组SW480 细胞增殖活性Tab. 2 Proliferation activities of SW480 cells after treated with different concentrations of DAPT in various groups(n=3,±s)
*P<0.05,**P<0.01 compared with blank control group.
Group Blank control DAPT(μmol·L-1)124810 Proliferation activity 1.307±0.0311.113±0.081**0.907±0.031**0.820±0.087*0.667±0.021**0.547±0.035**
5、15、45 、135 和405 μmol·L-1芦 丁 作 用SW480 细胞后,与空白对照组比较,细胞增殖活性均明显降低(P<0.05),降低幅度随着给药浓度的增加而增大,见表3。利用GraphPad Prism 软件计算得到芦丁对SW480 细胞的IC50值为22.34 μmol·L-1,故 将 芦 丁 的 最 佳 浓 度 设 定 为22 μmol·L-1。
表3 不同浓度芦丁作用后各组SW480 细胞增殖活性Tab. 3 Proliferation activities of SW480 cells after treated with different concentrations of rutin in various groups(n=3,±s)
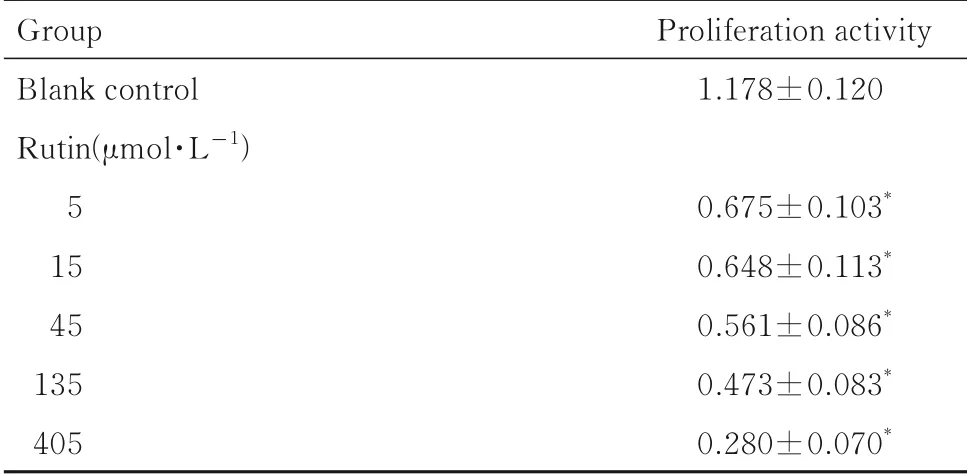
表3 不同浓度芦丁作用后各组SW480 细胞增殖活性Tab. 3 Proliferation activities of SW480 cells after treated with different concentrations of rutin in various groups(n=3,±s)
*P<0.05 compared with blank control group.
Group Blank control Rutin(μmol·L-1)51545135405 Proliferation activity 1.178±0.1200.675±0.103*0.648±0.113*0.561±0.086*0.473±0.083*0.280±0.070*
2.5 各组细胞凋亡的形态表现Hoechst33258 染色后,在荧光显微镜下观察。正常细胞的细胞核呈弥散均匀蓝色荧光,而凋亡细胞的细胞核呈浓染致密,或呈颗粒碎块状,颜色发白发亮。空白对照组细胞核大多呈弥散均匀蓝色,而芦丁组、DAPT 组和芦丁+DAPT 组细胞核呈现出不同程度发白发亮的颗粒碎块状,其中芦丁+DAPT 组细胞核发白发亮现象最为明显。见图3。

图3 各组SW480 细胞形态表现(Hoechst33258,×200)Fig.3 Morphology of SW480 cells in various groups (Hoechst33258,×200)
2.6 各组SW480 细胞凋亡率各组干预SW480细胞24 h 后细胞凋亡情况:与空白对照组比较,芦丁组、DAPT 组和芦丁+DAPT 组细胞凋亡率均明显升高(P<0.05);芦丁组与DAPT 组细胞凋亡率比较差异无统计学意义(P>0.05);与芦丁组和DAPT 组比较,芦丁+DAPT 组细胞凋亡率明显升高(P<0.05)。见图4 和表4。
表4 各组SW480 细胞细胞凋亡率Tab. 4 Apoptotic rates of SW480 cells in various groups(n=3,±s)

表4 各组SW480 细胞细胞凋亡率Tab. 4 Apoptotic rates of SW480 cells in various groups(n=3,±s)
*P<0.05 compared with control group;△P<0.05 compared with Rutin group;#P<0.05 compared with DAPT group.
Group Blank control Rutin DAPT Rutin +DAPT Apoptotic rate 05.470±0.630*7.097±0.571*13.567±1.294*△#

图4 各组SW480 细胞凋亡率Fig.4 Apoptotic rates of SW480 cells in various groups
2.7 各组SW480 细胞中凋亡相关分子蛋白表达水平Western blotting 法检测结果显示:与空白对照组比较,芦丁组、DAPT 组和芦丁+DAPT 组SW480 细胞中caspase-3 和caspase-9 表达水平均明显升高(P<0.05),Notch-1 蛋白表达水平和Bcl/Bax 比值明显降低(P<0.05);与芦丁组和DAPT组比较,芦丁+DAPT 组SW480 细胞中caspase-3和caspase-9 蛋白表达水平明显升高(P<0.05),Notch 蛋白表达水平和Bcl-2/Bax 比值明显降低(P<0.05)。见图5 和6。

图5 各组SW480 细胞中Bcl-2、Bax、caspase-3、caspase-9 和Notch-1 蛋白表达电泳图Fig. 5 Electrophoregram of expressions of Bcl-2, Bax,caspase-3,caspase-9 and Notch-1 proteins in SW480 cells in various groups
3 讨论
芦丁是天然的抗氧化剂,具有抗炎、抗病毒、预防和治疗心脑血管疾病等广泛的药理活性[6-7]。近年来有学者[8]发现:芦丁是一种安全的抗癌药物,具有较少的不良反应。研究[9]表明:联合中草药疗法可以普遍减轻诱导耐药性的危害和化疗的不良反应。本课题组前期研究[10-11]表明:芦丁联合奥沙利铂可以促进胃癌细胞的凋亡,同时芦丁也可以抑制CRC 细胞的增殖。在CRC 中芦丁和水飞蓟宾联合诱导调控凋亡和炎症等途径相关基因的表达,较单独使用更为有效[12]。但芦丁作用的分子机制目前尚不十分明确,深入了解芦丁抗肿瘤的分子机制,以期找到精确的诊治标靶具有重要的意义。
对芦丁抗癌机制的研究[13]显示:MAPK、p53(抑癌基因,蛋白质条带53000)、细胞凋亡以及核因子κB (nuclear factor kappa-B,NF-κB) 等不同细胞信号通路均参与了芦丁的抗癌作用。本课题组通过对芦丁抗癌相关作用通路进行生物信息学分析后发现:CTD 和GeneCards 数据库中共存在34 个交集mRNA,之后经GO 功能分析和KEGG 通路富集分析发现:芦丁的抗癌功能主要是通过介导癌症、CRC、TNF、细胞凋亡和MAPK 等信号通路实现的。随后利用String 数据库对交集mRNA 进行PPI 验证,结果提示芦丁可能通过作用MAPK 信号通路进而调控凋亡通路发挥其抗肿瘤的作用。本课题组前期研究[14]显示:芦丁可抑制胃癌细胞SGC-7901 增殖并诱导其凋亡,其机制可能与p38MAPK通路的激活密切相关。Notch 信号通路已被证明与各种类型的恶性肿瘤有关,在表达和存活方面参与了包括细胞增殖、细胞黏附、细胞凋亡和上皮-间充质转化在内的不同生物学过程[15-16]。研究[17]证实:Notch 信号通路在CRC 的进展中起着至关重要的作用,并与CRC 总生存期密切相关。在CRC中,阻断Notch 可导致小鼠CRC 细胞转化和分化,抑制肿瘤生长[18]。在以往研究[19-20]中,芦丁在三阴乳腺癌中的抗癌潜力与Notch 及MAPK 通路密切相关。本研究结果显示:Notch-1 通路抑制剂DAPT 及芦丁均可促进CRC SW480 细胞的凋亡,联合使用时细胞凋亡效果更明显,提示芦丁可能具有Notch 和MAPK 信号通路双重抑制作用。单纯干预MAPK 通路介导的靶向治疗可以对一些肿瘤生长起到抑制作用,但对具有高Notch 活性的肿瘤细胞,增殖占据优势。而靶向调控Notch 信号时,具有高MAPK 活性的肿瘤细胞也出现凋亡,联合靶向Notch 和MAPK 可对体内CRC 的生长具有明显的治疗作用[21-22]。因此,芦丁可能通过介导Notch-1 信号调控下游高活性的MAPK 通路发挥促进结肠癌细胞凋亡的作用。

图6 各组SW480 细胞中Bcl-2、Bax、caspase-3、caspase-9 和Notch-1 蛋白表达水平Fig.6 Expressions levels of Bcl-2, Bax, caspase-3, caspase-9 and Notch-1 proteins in SW480 cells in various groups
本研究分析芦丁组、DAPT组和芦丁+DAPT组SW480 细胞中Bcl-2 与Bax 表达水平结果显示:经药物作用后,与对照组比较,其余3 组细胞的Bcl-2/Bax 比值明显降低,提示芦丁可上调Bax 蛋白表达水平及下调Bcl-2 蛋白表达水平从而起到抗CRC 的作用,再次验证生物信息学分析及String 数据库的预测结果。Bcl-2 基因是凋亡抑制基因,主要通过自身二聚或与蛋白形成二聚体来发挥细胞凋亡的作用,而Bax 是凋亡促进基因,其通过增强线粒体的通透性,导致细胞色素C 释放、caspase-9 激活及后续的其他caspase 家族激活和最终导致细胞凋亡[23]。caspase 家族被激活后,在caspase 前体的N-端前肽和大亚基之间的特定位点被水解去除N-端前肽,随后在大小亚基之间切割释放大小亚基,进而形成两两组成的有活性的异四聚体。此时caspase-3 在外来蛋白信号的作用下被切割激活[24],随后caspase-3 对caspase-9 进行切割并使之激活,caspase-9 作为直接凋亡效应分子具有抑制癌症的作 用[25]。最 终,caspase-9 通 过 对caspase 靶 蛋 白 的水解,导致细胞发生凋亡。本研究各处理组中caspase-3 和caspase-9 蛋白表达水平均升高,提示二者与芦丁和Notch 信号通路加速CRC 细胞凋亡密切相关。
综上所述,生物信息学分析和本研究结果均表明:芦丁通过靶向Notch1 可加速CRC 细胞凋亡,且与Notch-1/MAPK 通路的下游凋亡蛋白密切相关。但芦丁是直接或间接通过Notch-1 调控下游的MAPK 信号通路发挥其抗肿瘤的作用目前尚不清楚,有待分子机制及临床试验进一步研究探讨。

