番茄果腐病拮抗菌的筛选及对番茄的防腐保鲜作用
张鸿雁 林国莉 李如莲 纪晓琦
(岭南师范学院生命科学与技术学院,湛江 524048)
番茄是一年生茄科类草本植物,是全世界种植最为普遍的果蔬之一,目前有144个国家种植,全球番茄面积大约300多万hm2,产量约1.3亿 t。我国番茄已经成为主栽作物,也是第一大出口国,同时也是全球第二大番茄品加工生产国,在经济发展和食物供给中占有重要地位。番茄含有丰富的番茄红素、维生素C、钾等营养成分,具有抗癌、防贫血、治高血压等重要功效。但由于番茄具有果皮薄、组织柔嫩多汁并富含糖分等特点,采后储存过程中容易感染微生物而发病腐烂[1]。番茄采后病害主要是果腐病。病原菌入侵是造成番茄果腐病的主要原因[2]。有研究显示灰葡萄孢(Botrytis cinerea)[3-4]、扩展青霉(Penicillium expansum)[5]、立枯丝核菌(Rhizoctonia solani)[6]等都会引起番茄果腐病,但没有葡萄座腔菌(Botryosphaeria dothidea)导致果腐病的报道。
番茄采后储藏和运输均会采取一定的保鲜措施,如物理、化学及生物方法等来抑制病害以降低采后损失。但物理保鲜法如低温储藏、气调储藏等措施成本高,需要设备和操作复杂。长期以来,化学方法防控是番茄采后病害保鲜的主要方法。但大量地使用化学药剂导致病原微生物产生抗药性,化学物质引起食品安全和环境污染问题,故寻求一种具有绿色、无毒、生态环保的果蔬病害防治方法已成为研究工作者关注的热点。
近年来,国内外利用拮抗菌进行番茄采后果腐病病害防控有一些报道,获得了对果腐病有较好拮抗作用及保鲜效果的菌株,其中主要以细菌[7]、酵母菌[8]、木霉[6]等为主。放线菌种类繁多,代谢产物丰富多样,是一类广泛用于防病的生防微生物。放线菌能有效抑制番茄灰葡萄孢(B. cinerea)[4]果腐病、鱼甘子青霉菌(P. choerospondiatis)软腐病[9]、芒果可可球二孢(Botryodiplodia theobromae)蒂腐病[10]等引起采后病害的病原菌的生长繁殖;另外,也有针对苹果轮纹病病原菌葡萄座腔菌(B.dothidea)[11]具有拮抗作用的放线菌的研究报道。
本文鉴定了导致番茄果腐病的病原菌,从健康番茄根际分离得到拮抗放线菌菌株,不仅能够解决当前面临的番茄采后果腐病问题,还可为其他果蔬采后防腐保鲜技术提供新思路和理论依据。
1 材料与方法
1.1 材料
供试番茄及土壤:番茄购自广东省湛江市麻章区金绿宝生态农场。选择颜色和大小均匀、无机械损伤的九成熟番茄果实进行常规实验室储存。储存期间挑选典型果腐病发病的番茄进行试验。筛选拮抗菌土壤取自金绿宝生态农场健康番茄根际。
培养基:病原菌分离、纯化、活化和保存用马铃薯蔗糖琼脂培养基(PDA),放线菌活化、拮抗性琼脂块制备培养用高氏1号琼脂培养基(GA),放线菌发酵液制备用GA液体培养基。
供试试剂:2.5 mmol/L dNTP和Taq DNA聚合酶(宝生物工程(大连)有限公司);ITS1和ITS引物(上海派森诺生物科技股份有限公司);Axyprep DNA凝胶回收试剂盒(爱思进生物技术杭州有限公司);QL-861旋涡震荡器(江苏省海门市麒麟医用仪器厂);SW-CJ-2D洁净工作台(苏州净化设备有限公司);Neofuge 13R台式高速冷冻离心机(上海力申科学仪器有限公司);GY-1硬度计(浙江托普仪器有限公司);PX-B32T糖度计(广州市普析通仪器有限公司)。
1.2 方法
1.2.1 病原菌的分离与鉴定
1.2.1.1 病原菌分离纯化 采用组织分离法和划线培养法分离病原菌[12]。切取发病番茄病健交界处组织块3 mm×3 mm的组织块,75%酒精浸泡30 s,1%次氯酸钠溶液消毒1-2 min,无菌水清洗3-5次,无菌滤纸吸干多余水分,置于PDA培养基,28℃恒温箱黑暗培养5-7 d。待分离物上长出白色菌丝,划线纯化后斜面4℃冰箱保存备用。
1.2.1.2 病原菌的形态学分析与致病性测定 挑取纯化的菌落边缘菌丝转接至PDA培养基中央,28℃恒温培养5-7 d,观察记录菌落特征。将病原菌在于PDA培养基上划线,无菌的盖玻片成45°插入PDA培养基内,与划线十字垂直,28℃培养5-7 d,用镊子将盖玻片取出,擦去盖玻片一面,在显微镜下对病原菌菌丝和分生孢子进行形态观察,记录病原菌菌丝和孢子的形态特征。初步确定致使番茄发病病原菌的分类地位[13]。
根据柯赫氏法则,对病原菌进行致病性测定。选取健康无伤口番茄,75%乙醇表面消毒后刺出伤口,在伤口处接种病原菌孢子悬液(1.0×107孢子/mL),以无菌水为对照。28℃培养,每天观察记录发病情况。选取发病症状与自然状态下相近的番茄进行病原菌分离鉴定,判断与所接种菌株形态等是否一致。
1.2.1.3 病原菌的分子生物学鉴定 依照核酸提取试剂盒说明书对病原菌进行DNA提取。引物为派森诺生物的PAGE序列,ITS1(TCCGTAGGTGAACCTGCGG)和 ITS4(TCCTCCGCTTATTGATATGC),PCR扩增体系为 1 μL 基因组 DNA(20 ng/μL),5.0 μL 10 Buffer( 含 2.5 mmol/L Mg2+),1.0 μL taq 聚 合 酶(5 U/μL),1.0 μL dNTP(10 mmol/L),1.5 μL ITS1 引物(10 μmol/L),1.5 μL ITS4 引 物(10 μmol/L),39.0 μL ddH2O, 总 体积 50.0 μL。50 μL PCR 反应体系于95℃预变性5 min,95℃变性30 s,58℃退火30 s,72℃延伸1 min,35个循环,72℃终延伸7 min。产物用Axyprep DNA试剂盒回收测序。得到的18S rDNA-ITS序列后,在NCBI的GenBank数据库经过Blast进行同源序列比对,下载参比序列在MAGE7.0软件中,邻接法构建系统发育树,通过亲缘关系确定分类地位。
1.2.2 拮抗菌分离、筛选与鉴定
1.2.2.1 放线菌的分离筛选 在番茄生产基地选择有代表性的健康植株,在植株周围采集0-20 cm表层土壤。放线菌分离采用稀释平板法。取5 g土壤加入45 mL无菌水中,土壤悬液经无菌水稀释后涂布于高氏一号培养基上,35℃培养7-9 d,按照相似度选择链霉菌菌落纯化保藏于-80℃。
1.2.2.2 拮抗菌的筛选 (1)平皿初筛:琼脂块法[14]。将制备好的病原菌菌悬液均匀涂布于PDA培养基上,正置直径5 mm放线菌琼脂块,28℃培养5-7 d,测定抑菌圈直径(D)及抑菌圈透明度(T)。将初筛得到的具有良好拮抗效果的放线菌菌株进行复筛。(2)抑菌率:生长速率法[15]。将放线菌无菌发酵液与PDA培养基按1∶4体积比混匀倒平板。平板中央放置5 mm病原菌菌饼,每处理3次重复,25℃培养7 d,定时测量菌落直径,计算抑菌率。(3)孢子萌发:病原菌接种到PDA培养基上,28℃培养6-9 d,加入无菌水冲洗分生孢子,经无菌纱布和滤纸过滤去除菌丝,用无菌水冲洗滤渣2-3次。用血球计数板测数,制得浓孢子悬液。按无菌发酵液:无菌水为1∶4配制发酵液加入病原菌孢子,使孢子浓度约为108孢子/mL,每处理3 次重复。25℃培养,4-5 h后用悬滴法[12]测定孢子萌发率。
1.2.2.3 拮抗菌的鉴定 (1)形态鉴定:插片法[16]。将待测菌株接种在GA琼脂培养基上,28℃培养8-15 d,镜检基内菌丝、气生菌丝、孢子丝的形态,观察待测菌株的表观特征。生理生化特征测定按照文献[17]中所介绍的方法进行。(2)放线菌16S rDNA的PCR扩增和序列分析:利用放线菌核酸提取试剂盒进行基因组DNA提取。以基因组DNA为模板,25 μL反应体系扩增16S rDNA,正向引物18#(AAGGTTGCGCTCGTTG),反向引物19#(AGAGTTTGATCCTGGCTCAG)。PCR扩增条件为94℃预变性5 min,94℃变性1 min,56℃复性1 min,72℃延伸2 min,25个循环;72℃延伸8 min。PCR扩增产物测序后数据库的提交、序列比对及系统发育树构建方法同病原菌鉴定。
1.2.3 X13无菌发酵液对番茄防腐保鲜作用
1.2.3.1 处理方法 将X13在高氏一号培养基上培养5 d后,接种到液体培养基中,28℃、150 r/min摇床振荡培养9 d。发酵液4 000 r/min离心5 min后,用0.22 μm灭菌微孔滤膜过滤除菌,得无菌滤液。滤液经无菌生理盐水稀释至体积分数分别为5%、10%和20%的无菌发酵稀释液备用。
将洗净筛选的番茄随机分成4 组,对照用生理盐水浸泡,其他3 组分别用体积分数5%、10%、20%无菌发酵稀释液浸泡处理5 min。果实浸泡后室温晾干,装入敞口PE袋中,储藏于(20±1) ℃。每处理20个果实,重复3次。
1.2.3.2 测定指标及方法 各处理每隔4 d观察番茄腐烂情况。根据番茄的腐败程度,将番茄果实腐烂率按照腐烂面积占果面比例大小划分为4 级:0 级,果实无腐烂;1 级,腐烂面积≤10%;2 级,腐烂面积10%-30%;3级,腐烂面积30%-50%;4 级,腐烂面积>50%。
腐烂指数/%=Σ(腐烂级别×该级果实数)/(总果实数×最高级别)×100
番茄经20%无菌发酵液处理后,对果实中多酚氧化酶(PPO)、过氧化物酶(POD)和苯丙氨酸解氨酶(PAL)进行测定。PPO活性测定采用分光光度法;POD活性测定采用愈创木酸法;PAL活性采用紫外分光光度法。番茄硬度采用果实硬度计测定;可溶性固形物用手持折光仪测定;可滴定酸采用NaOH溶液滴定法测定(以柠檬酸计);VC含量采用分光光度法测定。以上指标均参考曹建康等方法[18]进行。
1.2.4 数据处理 采用Microsoft Excel 2010软件进行数据整理,显著性采用SPSS22.0软件中的方差分析和 Duncan比较(P<0.05)。
2 结果
2.1 病原菌鉴定
从果腐病发病番茄分离一株病原菌,得到纯培养物标记为Qyg16-2。
2.1.1 病原菌的形态学分析 将病原菌接种到PDA培养基上。28℃培养到5-7 d。病原菌菌落呈圆形,较规则,早期为白色,菌丝稀疏,后期为灰色,气生菌丝发达、表面呈绒状。培养皿背面早期为浅黄色,后期为黑色。菌落颜色由菌落中心向外渐变(图1-A)。显微镜下病原菌Qyg16-2菌丝无色,有隔膜和分枝。分生孢子器黑色,球形,大小约130 μm×260 μm(图1-B)。单细胞分生孢子无色,近纺锤形,大小约(5.0-7.6)μm×(20-30)μm(图1-C)。通过菌落特征以及显微特征观察,初步判断病原菌Qyg16-2为葡萄座腔菌属(Botryosphaeria)。
2.1.2 病原菌系统发育分析 以病原菌Qyg16-2菌株的基因序列使用引物ITS1/ITS4进行PCR扩增,获得长度为540 bp的扩增片段,产物纯化后测序,将所鉴定菌株rDNA-ITS基因序列提交到 GenBank数据库(序列号 MT071502),经BLAST比对分析发现与菌株QYG-2序列相似性较高的菌株均为葡萄座腔菌属,且该菌株与与葡萄座腔菌B. dothidea(登录号NR111146.1)相似性达100%,聚在一个分支(图2)。结合菌株的培养和形态学特征,明确病原物Qyg16-2为葡萄座腔菌B. dothidea。
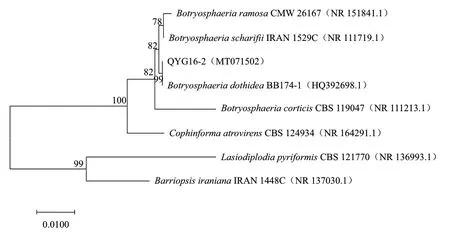
图2 病原菌Qyg16-2系统发育树Fig.2 Phylogenetic tree of pathogen Qyg16-2
2.1.3 致病性 将分离到的病原菌Qyg16-2回接于健康番茄上进行致病性试验,发现在5 d时表层覆盖一层稀疏呈圆形扩散的白色菌丝,后期果肉开始出现软烂,被侵染部位组织软化明显,直到整个果实腐烂(图1-D)。发病症状与自然条件下发病症状病症一致。从番茄回接后的发病部位病健交界处取得组织块,分离得到的病原菌与接种病病原菌一致。证明所分离接种的菌株是引起番茄果腐病的病原菌。
2.2 拮抗菌的筛选和鉴定
2.2.1 拮抗菌分离和筛选 从健康番茄根际土壤中筛选到不同形态的放线菌93株。从93株菌株中获得10株对番茄果腐病病原菌葡萄座腔菌有拮抗作用的放线菌。从表1可以看出,10株生防菌无菌发酵液对病原菌均有抑制作用,即均能产生抗菌物质,抑制病原菌生长。其中抑菌圈直径超过15.00 mm,抑菌效果比较明显的菌株有6株,分别为X1、X13、X19、X43、X85和X90。抑菌圈直径最大的菌株X13,直径(26.53±1.03)mm(图3-A),其次为X1,直径(20.31±2.12)mm,与其他菌株相比差异显著,直径最小的为X85,直径(18.92±1.11a)mm。选择6株放线菌进行抑菌率和孢子萌发抑制率试验。
抑菌率和孢子萌发抑制率试验结果(表1)可以看出,6株拮抗放线菌抑菌效果相差较大,X1和X13抑菌效果较好,抑菌率分别为(68.15±1.25)%和(82.53±0.93)%,X13抑菌能力最强,差异显著。同时,对孢子萌发抑制率结果与抑菌率结果相似,X1和X13分别为73.89%和98.37%,差异显著。选取X13进行菌种鉴定。
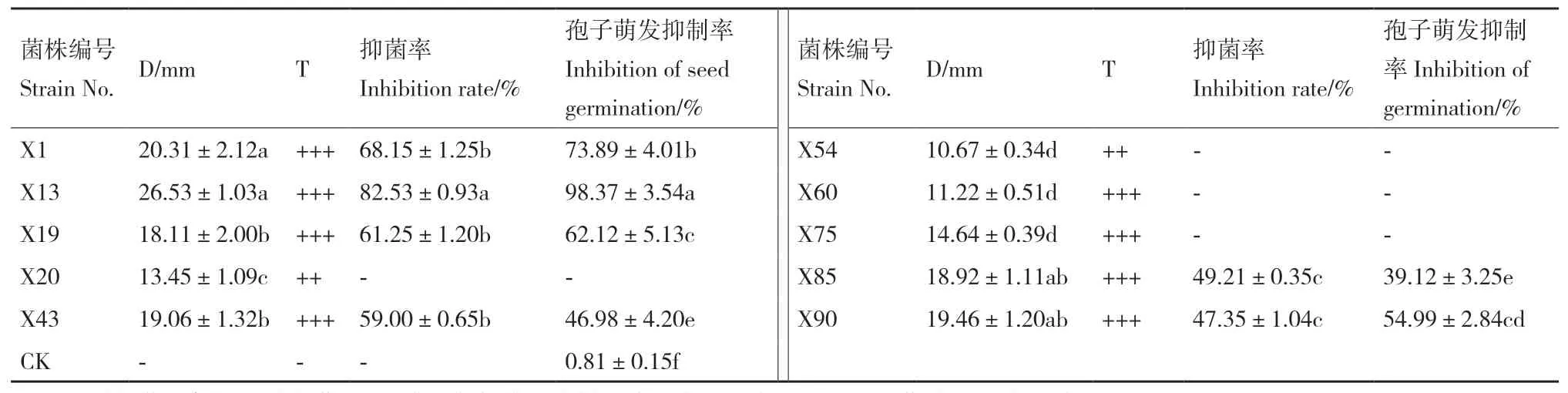
表1 放线菌对供试病原菌生长的抑制作用Table 1 Inhibitory effect of actinomycetes on the test pathogen
2.2.2 X13鉴定
2.2.2.1 X13的形态特征 通过划线法将菌株X13接种在高氏一号培养基上,置于培养箱28℃培养5 d后,可以观察到菌株X13生长良好,在培养基上可见到白色但不透明的菌落,菌落表面干燥且起皱,菌落的背面呈黄色,菌落规模较小且与培养基结合紧密(图3-B)。显微镜观察其孢子丝通常直、柔曲,螺旋形少(图3-C)。

图3 拮抗菌X13对病原菌的拮抗作用及其形态特征Fig.3 Inhibition effect of antagonistic Streptomyce strain X13 to pathogen and their morphological characters
2.2.2.2 X13的生理生化特征 参照《常见细菌系统鉴定手册》[17]对菌株X13进行明胶液化、牛奶胨化、硝酸盐还原、黑色素产生、酪氨酸酶产生及H2S产生等特性检测,发现菌株X13与桑氏链霉菌(Streptomyces sampsonii)生理生化指标相同。另外,X13可利用的碳源包括D-蔗糖、D-葡萄糖、D-木糖、D-果糖,但不能利用L-鼠李糖、肌醇(表2)。

表2 菌株X13的生理生化特征及碳源利用Table 2 Physicochemical characteristics and carbon source utilization of X13
2.2.3 X13的分子鉴定 对菌株X13的16SrDNA基因序列扩增产物进行测序后,得到约1 300 bp的基因序列。将该提交到NCBI数据库(序列号MZ363933)中,经BLAST比对分析,发现与X13菌株的16S rDNA基因序列具有高度同源性的均为链霉菌属,从这些序列中选取相似度较高的序列,利用MEGA7.0构建系统发育树(图4)。结果表明,菌株X13与桑氏链霉菌聚于同一分支,且序列相似性为99.11%,结合其生物学特性,可将菌株X13鉴定为桑氏链霉菌(S. sampsonii)。

图4 菌株X13的系统发育树Fig.4 Phylogenetic tree of strain X13
2.3 X13无菌发酵液对番茄防腐保鲜作用
2.3.1 X13处理对番茄腐烂指数影响 番茄经不同体积分数的拮抗菌X13发酵液处理后,储藏不同时间番茄果实腐烂指数变化结果见表3。
由表3可以看出,随着番茄储藏时间的延长,其腐烂指数也逐渐上升。对照的腐烂指数上升最快,在储藏到8 d时,对照和不同体积分数发酵液处理的番茄皆出现腐烂现象,对照的腐烂指数最高,为(9.81±1.06)%,发酵液处理腐烂指数最大为(4.98±1.35)%(体积分数5%),最小为(2.05±0.68)%(体积分数20%),差异显著。随着时间延长,到12 d、16 d和20 d,也表现出发酵液处理比对照腐烂指数低,差异显著,且处理的腐败速度明显慢于对照,16-20 d,腐烂指数稍有增加,差异不显著。同时,由表3可知,菌株X13不同体积分数无菌发酵液处理番茄,果实腐烂指数均明显低于对照,且体积分数越高,抑制效果越好。其中20%体积分数的无菌发酵液处理番茄在储存20 d腐烂指数(25.02±0.65%),对照是其约3倍,为(68.32±1.20)%。

表3 X13无菌发酵滤液对番茄腐烂指数的影响Table 3 Effects of cell-free fermentation filtrate of X13 on the decay index of tomato%
2.3.2 X13处理对对番茄诱导抗性的影响 番茄经不同体积分数的拮抗菌X13处理后,储藏不同时间番茄果实的诱导抗性变化情况结果见表4。
由表4可知,3项抗性酶活性PPO、POD和PAL皆出现从4-12 d上升,到12 d达到峰值,16 d后下降的趋势,但16 d后虽有下降,但3项酶活亦皆大于对照,下降速度明显变缓。对于PPO活性,与对照相比,12 d、16 d和20 d的PPO活性分别比对照增加109.0%、109.4%和98.0%,约为对照的2倍,差异显著。对于POD,与对照相比,随着储藏时间延长,增加量也逐渐上升,12 d活性增加了127.6%,虽16 d后POD开始下降,但处理后POD活性下降速度较慢。PAL增加量从93.3%(4 d)到216.7%(20 d),从8-20 d,PAL活性皆高于对照,差异显著。
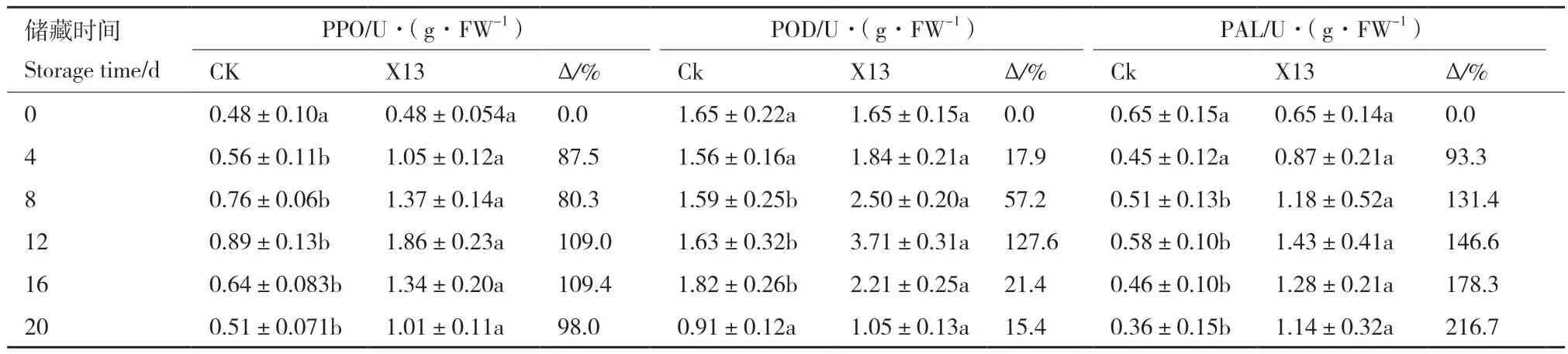
表4 X13无菌发酵滤液对番茄抗性酶活性影响Table 4 Effects of cell-free fermentation filtrate of X13 on the defense enzyme activity of tomato
2.3.3 X13处理对番茄果实品质的影响 番茄经不同体积分数的拮抗菌X13处理后,储藏不同时间番茄果实品质变化情况,结果见表5。由表5可知,对照和处理番茄硬度、可溶性固形物、可滴定算含量和VC含量皆出现下降趋势。随储藏时间延长,番茄果实硬度逐渐下降。但与对照相比,X13无菌发酵液处理硬度下降减慢,至储藏20 d,果实硬度为15.08 kg/cm2,较对照减少15.0%。随着储藏时间延长,可溶性固形物含量呈下降趋势,对照下降速度较快,至16 d和20 d,经处理的番茄可溶性固形物含量比对照减少4.0%和3.2%。可滴定酸含量趋势同可溶性固形物,对照从8 d开始,可滴定酸迅速下降,至16 d和20 d,处理比对照高25.0%和20.0%。果实Vc含量为16 d到20 d,比对照少损失19.3%和20.1%。
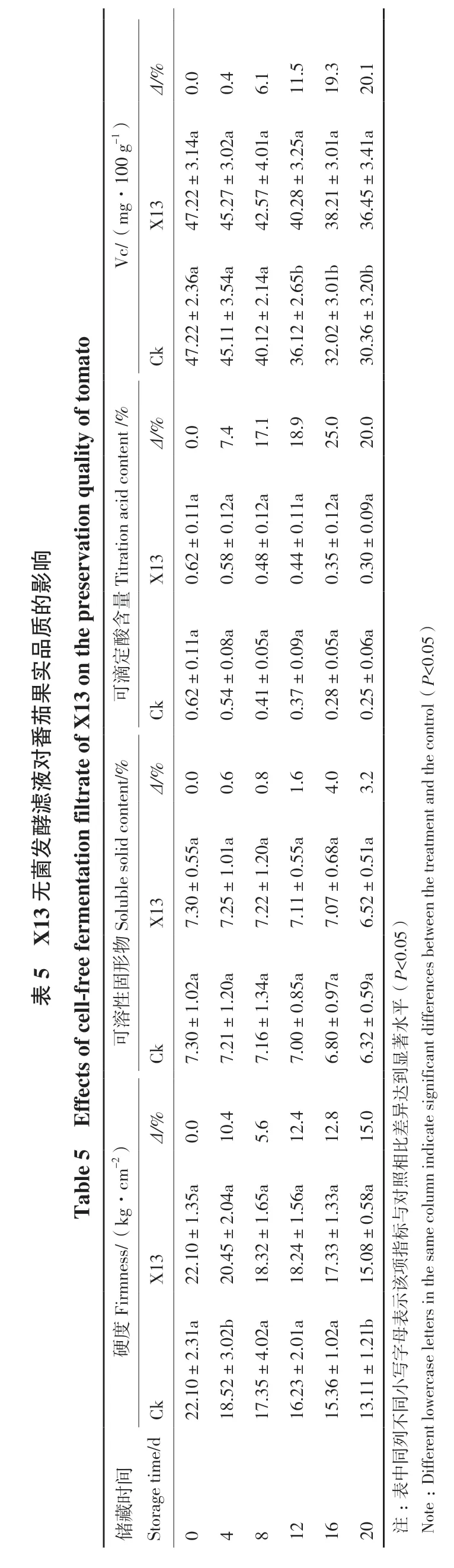
0.00.46.1 Δ/%.51119.3 20.1 3.14a a mg·100 g-1)4.01a 3.02a 3.25a 3.01 3.41a X137±45.27±42.5 40.2 47.22±8±.21±38.45±Vc/(36 3.54a 2.36a 2.14a 2.65b 3.01b b 3.20 ato 6±47.22±45.11±40.12±36.12±2±of tom Ck 32.0 30.3 uality Δ/%0.07.4 Titration acid content /%17.1 18.9 25.0 20.0 3 1a±0.1 0.58±0影.12a.12a响X10.62 0.48±0 0.44±0.11a 0.35±0.12a 0.30±0.09a质e p的reservation q量含品th 酸8a 5a 9a实on 定.0.05a.06a trol(P<0±0.11a±0.0±0.0 0.37±0 0.28±0 0.25±0.05)果13滴可茄Ck 0.62 0.54 0.41番对液the con滤content/%Δ/%0.00.60.81.64.03.2发酵n filtrate of X 5a菌.5.01a.20a 13无3 5 X Soluble solid X1 f cell-free fermentatio 7.30±0 7.25±1 7.22±1 7.11±0.55a 7.07±0.68a 6.52±0.51a物形表固2a 0a 4a性.3.85a.97a (P<0.05)溶 ±1.0±1.2平水ifferences between the treatment and ffects o 可Ck 7.30 7.21 7.16±1 7.00±0 6.80±0 6.32±0.59a著显到达ble 5 E .4 Δ/%异0.0差105.6 2)12.4 12.8 15.0比相n indicate significant d Ta kg·cm-1.35a 2.04a 1.65a 1.56a 1.33a a 0.58照对与ness/(8±标e colum X13 22.10±20.45±18.32±18.24±17.33±15.0指项Firm 该示度表硬2.31a 3.02b 4.02a 2.01a 1.02a 1.21b 母字写Ck .10±2218.52±17.35±16.23±15.36±13.11±小ercase letters in the sam同不列储Storage tim e/d同间中ifferent low时表:D藏:048121620注Note
3 讨论
本研究对来源于番茄果腐病病原菌进行组织分离纯化,经柯赫氏法则验证获得的病原菌菌株Qyg16-2。观察病原菌形态特征并进行rDNA-ITS序列分析,确定引起采后番茄果腐病病原菌为葡萄座腔菌B. dothidea。本研究采用来自采后储藏期间发病番茄样品获得病原菌,其致病菌与其他研究不同[3-6]。
葡萄座腔菌属(Botryosphaeria)真菌在世界范围内分布广泛,由其引起得叶斑,枝梢枯败,果实腐烂等果树病害症状,导致果实产量以及品质下降,带来巨大的经济损失。葡萄座腔菌属对水果的危害在猕猴桃樱桃[19]、蓝莓[20]、苹果[21]、葡萄[22]、柑橘[23]等都有研究报导,但针对其对番茄的侵染研究较少。葡萄座腔菌B. dothidea生长速度快,寄生性强,以菌丝体、分生孢子及子囊壳在残留的植物病残体上越冬,菌丝体、分生孢子器在第二年春天恢复活动,越冬后的4-6月间生成孢子,成为初侵染源[24]。
生防菌株的研究与应用对防止果蔬的微生物病害具有重要意义。目前针对桑氏链霉菌的研究较多,已经从土壤[25-26]、树木[27-28]和海洋沉积物[29]中分离到桑氏链霉菌(S. sampsonii),该菌能够抑制多种真菌生长,有明显的抗真菌活性,可抗阿切尔拟茎点霉(Phomopsis archeri)[25]及毛癣菌属(Trichophyton sp.)[26]等。李姝江等[28]发现桑氏链霉菌KJ40对杨树紫纹羽病原菌Rhizoctonia violacea除了具有较强拮抗作用外,还有促生抗病多种功能。
在外界因子作用下,植物能产生诱导抗性,如抗性酶的产生,来抵抗病原菌入侵,使植物免遭病害或减轻病害。郭虹娜等[29]发现杰克逊酵母挥发物明显提高草莓中过氧化氢酶(CAT)、多酚氧化酶(PPO)等酶活。孙平平等[30]发现梨灰霉病菌拮抗放线菌处理梨后果实的过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和苯丙氨酸解氨酶(PAL)活性。本研究表明拮抗菌X13无菌发酵液处理能显著提高番茄抗性酶活性,可以提高番茄抗病能力。
番茄由于皮薄多汁,受伤或受到微生物侵染后,容易腐烂变质,腐败指数是番茄新鲜程度的标志。随着储藏时间的延长,水果品质逐步下降。水果储藏过程中可采取措施缓解品质下降速度。季小诗等[31]发现拮抗酵母GS-316发酵液处理冬枣能够显著延缓冬枣果实失重率和还原糖含量的上升,抑制可滴定酸含量和Vc含量的下降,降低果实软化率,降低腐烂指数。施俊凤等[32]发现草莓采前喷施洋葱伯克霍尔德菌菌悬液可有效提升草莓品质,延缓果实硬度、可溶性固形物、可滴定酸,降低Vc含量。本研究中番茄通过拮抗菌X13处理后,腐烂指数下降较低,硬度、可溶性固形物、可滴定酸、Vc含量下降幅度减慢,说明X13可以维持番茄果实在储藏过程中的品质时间有所延长,减轻果实的腐败变质,表明该菌株在番茄采后保鲜方面有一定的实践应用价值。但本实验仅对X13菌株应用于番茄采后果腐病控制及保鲜效果进行了初步研究,仍需对其发酵液活性成分进行分离鉴定,并对抑菌机理,病原菌、拮抗菌及番茄果实互作及菌株X13的生产应用需进一步研究探索。
4 结论
从健康番茄根际土壤中分离得到了一株桑氏链霉菌 S. sampsonii X13,其对番茄果腐病病原菌葡萄座腔菌B. dothidea Qyg16-2有较强拮抗作用,X13可以抑制病原菌Qyg16-2孢子萌发和菌丝生长,其无菌发酵液对储藏期间番茄腐烂的发生具有良好的抑制效果,且对番茄果实品质具有较好的维持作用。

