SNP-array技术在超声波检测胎儿肾脏多囊性病变中的应用*
费冬梅, 黄朋, 李萌, 黄欢, 苏家荪, 欧阳鲁平, 黄红倩, 刘天盛, 李薇, 雷亚琴, 罗静思△
广西壮族自治区妇幼保健院 1遗传代谢中心实验室、广西出生缺陷预防控制研究所、广西遗传性疾病精准诊治重点实验室、广西出生缺陷防治基础研究重点实验室, 2优生遗传门诊,3超声科(广西南宁 530003)
胎儿肾脏多囊性病变(polycystic renal disease)是较常见的泌尿系畸形,种类较多[1],包括婴儿型多囊肾、多囊性发育不良肾、成人型多囊肾和梗阻性囊性发育不良肾等多种病变,产前表现各不相同,其病因及预后各不相同,部分是致命性的,必须尽早诊断,及时干预[2]。肾脏多囊性疾病是一组常见的肾脏囊性疾病,全球发病率为1∶500~1 000[3]。由于肾脏多囊性病变种类繁多,不能简单地将该疾病归为“多囊肾”,确切了解胎儿肾脏多囊性囊性病变类型对进一步产前咨询意义重大[4]。我们通过对107例产前诊断中心胎儿肾脏多囊性病例的超声表征、染色体核型和单核苷酸多态性微阵列(single nucleotide polymorphism array,SNP-array)技术检测结果及妊娠结局进行分析,探讨SNP-array芯片技术检测对肾脏多囊性病变胎儿产前诊断的临床意义,为临床咨询提供理论依据。现将研究结果报告如下。
1 资料与方法
1.1 一般资料 选取2018年1月至2020年12月,于广西壮族自治区妇幼保健院遗传门诊就诊的孕妇,行超声筛查结果提示肾脏多囊性病变的病例,行介入性产前诊断,羊膜腔穿刺术或脐带血穿刺取样活检术。同时行染色体核型分析及SNP-array检测,本研究经广西壮族自治区妇幼保健院伦理委员会批准[桂妇保院医伦快审(2022)第(1-3)号],并与受试者签署临床研究知情同意书。
1.2 研究方法
1.2.1 纳入和排除标准 纳入标准:定期于本院进行产前检查;单活胎妊娠;产前超声筛查提示胎儿肾脏多囊性病变者。排除标准:多胎妊娠;合并妊娠期糖尿病、妊娠期高血压等妊娠期合并症者;临床病历资料不全者。
1.2.2 产前超声检测 使用GE Volusion 730型彩色多普勒超声仪,经腹扫查,凸阵探头,频率设置为3.5~5.5 Hz。在胎儿冠状和矢状切面扫查胎儿肾脏。肾脏测量方法及肾脏大小参考严英榴主编《产前超声诊断学》的标准[5]。
1.2.3 介入性产前诊断方法及标本采集 本研究产前超声筛查发现胎儿肾脏多囊性病变者,均建议行介入性产前诊断,包括传统的染色体核型分析和SNP-array检测。妊娠16~22孕周经腹行羊膜腔穿刺术,抽取羊水30 mL,其中20 mL用于胎儿染色体核型分析,10 mL用于SNP-array检测。妊娠22孕周后经腹行脐静脉穿刺术,抽取脐血3 mL,其中2 mL用于胎儿染色体核型分析,1 mL用于SNP-array检测。
1.2.4 染色体核型分析 将采集的羊水或脐带血细胞,按照实验室SOP将细胞进行接种、观察、收获、制片及G显带后进行染色体核型分析。常规计数20个核型,分析5个核型,若发现异常核型时,则将计数与分析增加至50个核型。根据人类遗传学国际命名体制(ISCN2016),对染色体核型命名。
1.2.5 单核苷酸多态性微阵列检测 采用QIAamp DNA Blood Mini Kit试剂盒提取羊水、脐血样本基因组DNA用于SNP-array检测。提取DNA浓度>50 ng/L,A260/A280为1.8~2.0。采用illumina公司的HumanCytoSNP-12芯片进行SNP-array分析,根据标准操作流程对基因组DNA依次进行全基因组扩增、片段化、杂交和荧光染色,然后使用illumina公司的iScan芯片扫描仪对制备好的基因芯片进行扫描,获得的数据通过KaryoStudio软件进行分析。
1.2.6 SNP-array检测的判断和评价 数据分析参照广西壮族自治区妇幼保健院产前诊断中心实验室内部数据库及国际常用的基因组与表型公共数据库,包括正常人基因组变异数据库(DGV)、DECIPHER、UCSC Genome Browser、在线人类孟德尔遗传病的数据库(OMIM),以及PubMed文献数据库等公共在线数据库。拷贝数变异(copy number variation,CNV)分类判断准,参照参考文献[6]相关标准,其分类包括致病性CNV、疑似致病性CNV及临床意义不明CNV。
1.3 统计学方法 采用SPSS 22.0统计软件进行统计学处理。对胎儿染色体异常检出率等计数资料,采用百分比(%)表示。两种检测方法比较采用2检验,P<0.05为差异有统计学意义。
2 结果
2.1 产前超声检测结果 本研究超声异常的107例病例中,婴儿型多囊肾36例,超声影像表现为双侧肾脏对称性增大伴肾实质回声增强,肾皮质髓质界限无法区分。成人型多囊肾12例,超声影像表现为肾实质回声增强,均匀性增大,肾皮质髓质界限清楚,肾区内可见多个大小不等的囊性结构。多囊性肾发育不良59例,超声影像表现为肾脏增大,肾区内可见多个大小不等、数量不一的囊腔,像一串葡萄粒,受累肾脏形态异常。本研究中未发现梗阻性囊性发育不良肾。
2.2 染色体核型分析结果 本研究超声发现107例胎儿肾脏多囊性疾病病例,其中104例胎儿染色体核型正常,检出染色体核型异常3例,3例异常分别为1例克氏综合征,1例45,XN,der(14;21)(q10;q10),1例46,XN,der(13)t(3;13)(q27;q34)。5例染色体多态性,分别为46,XN,inv(9)(p12q13)和46,XN,1qh+,异常检出率2.8%(3/107)。
2.3 SNP-array检测结果 107例羊水、脐带血肾脏多囊性病变的胎儿样本中,SNP-array检出异常9例,异常检出率8.4%(9/107)。芯片异常为致病性CNV 6例,可能性CNV 1例,临床意义不明CNV 2例。将107例病例同时行染色体核型分析和SNP-array检测。
2.4 检出异常情况的统计学分析 SNP-array和染色体核型分析两种方法相比,染色体核型异常检出率为2.8%,SNP-array检测异常检出率为8.4%,两组间比较差异无统计学意义(2=3.178,P=0.075),核型正常者中的分布差异无统计学意义(P>0.05)。见表1。
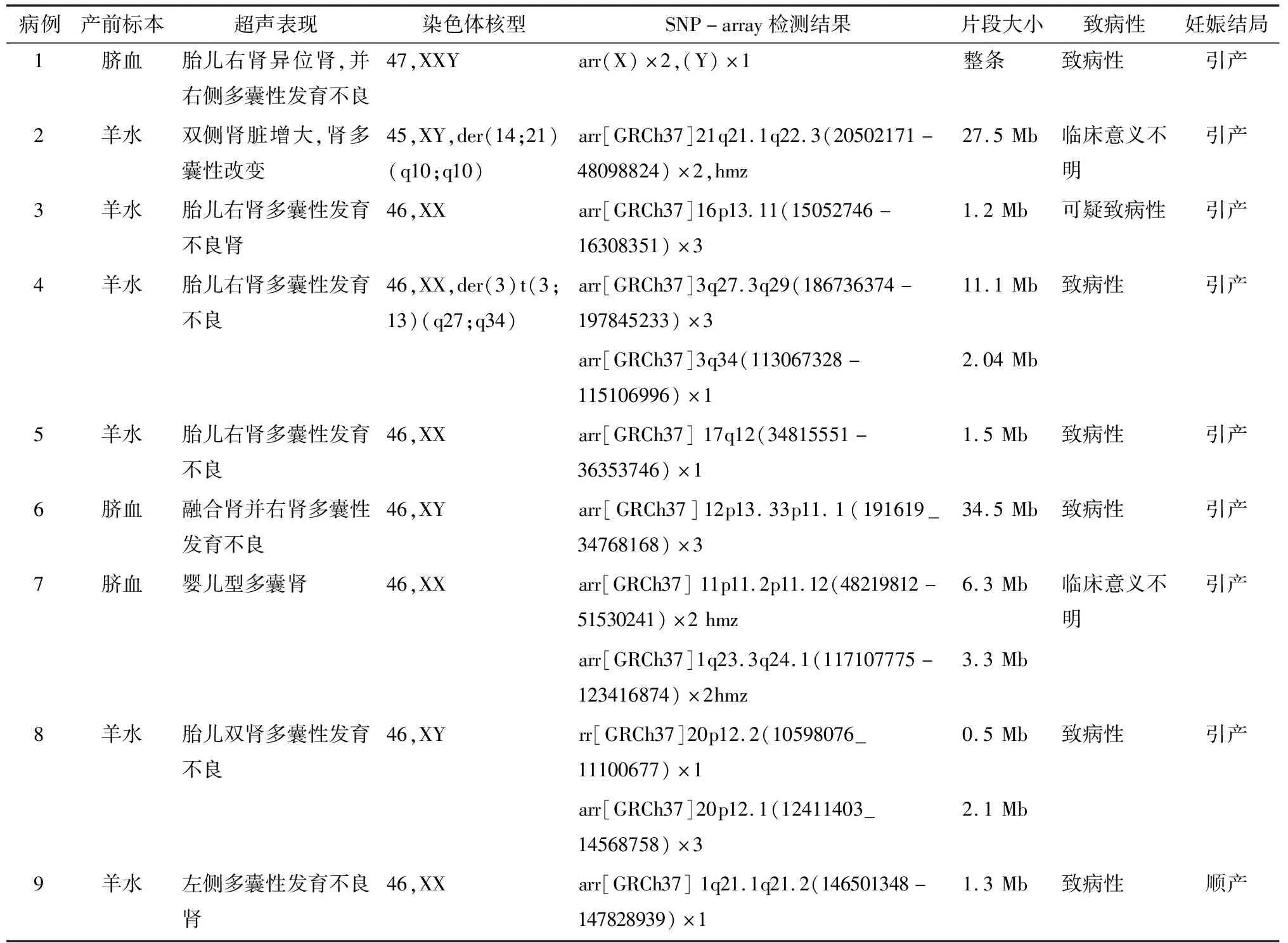
表1 9例胎儿肾脏多囊性病变的产前诊断结果及妊娠结局
3 讨论
胎儿肾脏多囊性病变是产前超声常见的泌尿系统异常疾病,大多研究仅报道了其超声检测中的关联,但是很少有人关注SNP-array结果,因此,本研究将超声筛查异常的肾脏多囊性病变进行SNP-array检测。近年来,伴随产前超声技术的发展,胎儿肾脏异常检出率不断提高,肾脏畸形的类型不同,预后亦不同,严重者胎儿无法存活[7]。肾脏多囊性病变是最常见的先天性肾脏异常,其种类繁多,将胎儿肾脏多囊性病变分为四型[8],即Potter Ⅰ型(婴儿型多囊肾)、Potter Ⅱ型(多囊性发育不良肾)、Potter Ⅲ型(成人型多囊肾)、Potter Ⅳ型(梗阻性囊性发育不良肾)。各类型发病原因不同,临床预后也不尽一致,遗传方式也明显不同。
对于产前超声检查提示为肾脏多囊性病变的胎儿,染色体核型分析技术是目前应用最广泛的细胞遗传学检测方法[9]。染色体核型分析的检出率较低,本研究97.2%染色体核型分析结果为阴性,由于本身有很大局限性。染色体核型分析是一种形态学检测,完全靠肉眼识别,其分辨率低只能达到5 Mb的水平,不能精确判断片段的来源、大小、性质及其所含的基因。研究中有6例染色体核型分析未见异常,而SNP-array提示微缺失或微重复,很大程度上弥补了染色体核型分析分辨率低的不足。染色体核型分析需要经过细胞培养、制片、染色等复杂实验操作,通常需要2~3周才能发放报告,并且染色体培养过程较为困难,人为因素较多,细胞培养失败概率比较高[10]。而SNP-array技术只需3 d就可以完成实验,无需细胞培养,通常1周就可以发放报告。SNP-array检测的优点还可分析没有生命力的组织,例如流产绒毛、宫内死胎样本等[11]。其检测仅需少量胎儿组织提取DNA就能达到检测目的,有助于排除致病性微缺失或微重复,从而避免患儿出生,降低出生缺陷率。
对于肾脏多囊性病变胎儿的遗传咨询和预后处理,需结合产前超声监测、染色体核型以及SNP-array技术等多方面综合考虑。婴儿型多囊肾可表现为严重的肾脏病变,胎儿预后不良,出生后多在新生儿期死亡。一般产前超声诊断婴儿型多囊肾脏,孕妇可选择终止妊娠放弃胎儿。成人型多囊肾多数在成人期发病,约40岁表现有高血压和肾功能衰竭症状,一般有家族史。多囊性发育不良大多数为单侧肾脏发病,对侧肾脏多为发育正常,预后良好;若为双侧病变,通常胎儿预后不良[12]。本研究中尚未发现梗阻性囊性发育不良肾。
Cai等[13]报道的147例先天性肾脏和泌尿系统异常中,SNP检测出CNV异常13例(8.8%):在异常CNV组中,多囊肾发育不良的胎儿中CNV的频率最高(13.5%),SNP-array技术的发展极大地提高了常规染色体核型无法被诊断的遗传病诊断率。一些研究报道,在先天性结构畸形和神经认知发育障碍中,可用于诊断另外12%~15%的遗传病。易凤梅等[14]报道了20例多囊性发育不良肾,染色体核型均为正常,CMA检测结果单纯多囊性发育不良肾者4例异常,合并其他结构异常者有3例异常,而本研究异常比例为8.4%。可能原因是由于选择病例存在偏倚。Staebler等[15]对73例多囊性发育不良肾的胎儿进行核型分析,仅发现2例(2.7%)胎儿染色体核型异常。在本研究中,我们对107例产前超声显示肾脏多囊性病变的胎儿伴或不伴其他肾外异常的胎儿进行核型分析,结果显示3例胎儿核型结果异常,检出率为2.8%(3/107),与Staebler等的文献报道基本一致。在临床工作中,常常会遇到染色体正常,但是超声检测或其他方法检测提示胎儿发育异常的情况,急需用其他方法来进行遗传学检测,以尽早判断胎儿的情况。SNP-array技术是近年来发展的一项分子检测技术,越来越多地应用到临床遗传学的产前诊断。该技术可通过一次实验同时检测微阵列芯片上高达几十万甚至上百万的DNA片段,可以检测到5~20 kb基因组片段的缺失与扩增。能够覆盖全基因组DNA,具有高通量、高分辨率、检测速度快等特点。该技术不但能检测基因组内微缺失/微重复(<5 Mb),还可检测嵌合体(嵌合比例>20%)、杂合性缺失(loss ofheterozygosity,LOH)以及单亲二倍体(uniparental disomy,UPD)等[16]。该技术在超声筛查提示异常的胎儿中应用越来越多,从而提高了异常胎儿中检测染色体微缺失和微重复综合征的水平。但SNP-array技术无法检测出染色体平衡易位、倒位。本研究通过两种方法联合应用,共计107例样本中,SNP-array检出9例异常,异常检出率为8.4%(9/107),核型的检出率仅是2.8%(3/107)。与染色体核型对比,大大提高了遗传性疾病的诊断率,降低其漏诊率。染色体核型异常检出率与SNP-array异常检出率比较,SNP-array技术检出率高于染色体核型分析技术检出率。
本研究SNP-array技术共检出6例致病性CNV病例(其中1例非整倍体异常),1例可能致病性CNV病例和2例临床意义不明的CNV病例。本研究中病例2染色体核型分析结果为罗伯逊易位,SNP-array检测结果为21q21.1q22.3区域存在27.5 Mb的纯合区(AOH),提示该染色体可能存在单亲二倍体(UPD)。未能检测出染色体平衡易位,SNP-array检测技术正成为新的染色体检测手段,但也有其局限性,不能检测染色体倒位和染色体平衡易位、点突变、基因组低比例嵌合、四倍体等。病例4染色体核型分析结果为46,XN,der(13)t(3,13)(q27,q34),核型分析结果为染色体不平衡易位,SNP-array检测显示3q27.3q29区域存在约11.10 Mb片段重复,13q34区域存在约2.04 Mb片段缺失,可见SNP-array能检测不平衡易位,因此结果与核型分析结果一致。从SNP-array检测结果我们不知道该缺失区域和重复区域是如何重排的,对于不平衡易位基因组只能标识基因组不平衡的区域,不能提供产生该变异或重排的相关机制。由此可见,将两者结合起来分析是有必要的。
病例8为检测到样本20p12.2区域存在约0.5 Mb片段缺失,为致病性拷贝数变异。20号染色体该片段缺失包含已知OMIM致病基因JAG1,该基因为单倍剂量敏感型基因,该基因的缺失与Alagille综合征相关;Alagille综合征是一种常染色体显性遗传病,主要表现为5种临床上的异常:胆汁淤积症、心脏病、骨骼异常、眼部异常以及特征性的面部表型;约39%的患者存在肾脏受累,主要是肾发育不良;该基因的突变可为新发变异也可遗传自受影响程度不同的双亲[17]。
17q12缺失综合征,该片段缺失包含关键基因HNF1B及LHX1,患者临床表现广泛,主要症状包括多囊肾,肾发育不良等肾脏方面的异常,以及青年期糖尿病,部分患者还可表现为多种神经发育异常,如智力低下和自闭症,语言发育迟缓等[18-19]。也有报道与妇女生殖系统苗勒管发育畸形有关[20]。Zhou等[21-22]报道了17q12微缺失病例,也充分阐述了17q12缺失与肾脏多囊性疾病的高度相关性,17q12缺失综合征是导致肾脏异常,成熟型糖尿病的年轻人和神经发育障碍的原因。Nagamani等[23]也报道了4例17q12微缺失患者的临床表现,其中2例表现为仍有保留肾功能的肾囊肿,1例为完全无功能的右肾多囊性发育不良,还有1例为肾发育不良并肾功能衰竭并行肾脏移植。本研究中仅检出1例,因超声检查发现“胎儿右肾多囊性发育不良”抽羊水行产前诊断,胎儿染色体核型正常,SNP-array检测arr[GRCh37]17q12(34815551-36353746)×1,约1.5 Mb片段缺失,17q12缺失的大小可为1.06~2.46 Mb。由此可见HNF1B基因缺失与胎儿多囊肾、肾脏发育不良密切相关,对指导下一胎妊娠具有非常重要的作用。研究中病例3、病例6和病例9未见有文献报道与肾脏多囊性病变有关,该16p13.11片段重复、12p13.33p11.1片段重复和1q21.1q21.2微缺失综合征是否会引起肾脏多囊性病变仍需进一步研究。
SNP-array检测最大的优势是具有较高的分辨率,检测临床上的一些重要结构异常具有较高的敏感性,尤其是在常见遗传综合征的检测上敏感性较高,这在产前诊断临床应用中已经得到印证。但该技术也有其局限性,不能检测平衡性的改变,如染色体平衡易位、倒位及复杂性重排。尽管基因芯片已取得了长足的发展,但许多技术问题仍有待完善,相信随着技术的不断提高,基因芯片在产前诊断上将发挥更加重要作用。SNP-array技术的不足之处,目前仍然无法对点突变致病的患者作出准确的检测。Dong等[24]对12个多囊肾病家庭进行检查和分析,12个家系中有9个被鉴定为致病变异,并在家族中引起常染色体显性多囊肾病,对先证者进行全外显子组测序(WES)或全基因组测序(WGS)以检测致病基因。本研究的后续工作将考虑应用全外显组测序或全基因组测序对染色体核型分析和SNP-array检测正常的胎儿样本进行基因突变检测。本研究中两种方法的比较差异无统计学意义,导致无统计学意义的原因可能由于入选样本量较小,没有足够的检验效能以至于出现假阴性的结果,因此需要扩大样本量,以得到更加全面可靠的评估。
综上所述,产前超声筛查虽然有一定的局限性,但是对筛查肾脏多囊性病变有重要的临床应用价值。如果能将SNP-array技术引入产前诊断,由于该技术具有高通量、高分辨率、检测速度快等特点,那么就可以尽早发现和诊断胎儿异常,减轻对孕妇的身体和心理伤害。对于有致病性报道的严重畸形胎儿,及时终止妊娠,可以降低出生缺陷率,提高出生人口素质,可以减轻家庭经济负担和精神压力。胎儿肾脏多囊性病变种类繁多,更需要我们做好超声检查及产前诊断,常规染色体核型分析联合SNP-array技术同时检测,两者可互相弥补,两种技术结合可提高检出率并能获得更多的遗传信息,可为胎儿产前诊断、遗传咨询及预后评估提供强有力的诊断依据。
利益相关声明:所有作者均声明不存在利益冲突。
作者贡献说明:实验设计、数据统计分析及论文撰写由费冬梅完成;基因芯片结果分析由黄朋和苏家荪完成;临床信息采集和随访妊娠结局由李萌完成;产前超声检测由黄欢完成;染色体细胞培养由欧阳鲁平和黄红倩完成;染色体核型分析由刘天盛和雷亚琴完成;基因芯片DNA提取由李薇完成;实验评估由罗静思完成。

