羟基七元瓜环固相微萃取测定环境水体中的硝基苯酚异构体
赵雨璇 董南 董美玉
摘要:以单羟基七元瓜环(Q[7]-OH)和端羟基聚二甲基硅氧烷(OH-PDMS)为固定相,利用溶胶-凝胶方法制备了PDMS/Q[7]-OH的固相微萃取搅拌棒(stir-bar sorptive extraction, SBSE),建立了SBSE-高效液相色谱(high performance liquid chromatography, HPLC)-二极管阵列检测器(diode-array detector, DAD)对环境水样中3种硝基苯酚异构体同时检测的分析方法。方法对萃取时间、溶液的pH值、盐离子浓度、解吸溶剂和解吸时间进行了优化。在优化条件下,SBSE-HPLC-DAD测定硝基苯酚异构体的线性范围为0.01~10.00 mg/L,相关系数均大于0.999 7,检测限在0.002~0.006 mg/L范围内,日内及日间精密度的相对标准偏差在2.9%~7.5%之间(C=0.8 mg/L),3个加标浓度的平均相对回收率在71.5% ~116.8%范围内。 方法灵敏、简便,可满足环境水样中硝基苯酚异构体同时测定的要求。
关键词:单羟基取代七元瓜环;固相微萃取小棒;硝基苯酚异构体;高效液相色谱;环境水样
中图分类号:O69;O657.72文献标志码:A
作为重要有机合成中间体的邻、间、对硝基苯酚在化工材料、农药和染料等工业领域有着广泛的应用。它们已被证实为环境内分泌干扰物之一,被联合国环境署列为环境必测项目之一[1]。硝基苯酚在生产和使用过程中会随生活污水及工业废水进入环境水体,对动物、微生物、植物和人体健康造成巨大的危害[2]。这几种异构体具有相似的物理化学性质,同时测定较难,从而一直是人们关注的课题。目前,环境水体中硝基苯酚的测定方法有色谱法、电化学方法[3]和毛细管电泳法[4]等。其中,色谱法是最常用的分析方法,包括气相色谱[5]、气相色谱-质谱联用[6]及液相色谱-质谱联用[7]等。色谱法由于检测灵敏度较低而环境水样中硝基苯酚的含量很低,需对样品进行预处理以满足仪器的测定要求。液/液萃取[6]、固相萃取[8]是传统的样品前处理方法,具有较好的富集、净化能力,但大量的有毒、有害有机溶剂的使用,较复杂的操作以及较多的样品使用量是其主要的缺陷。
固相微萃取(soild phase micro-extraction, SPME)于1989年由加拿大Waterloo大学Pawliszy教授课题组提出,是一种新型微型化和绿色环保的样品前处理技术。这种方法具有样品用量少、操作简单、富集倍数高的特点,可以集成样品的吸附、解吸、进样于一体,不使用或使用很少的有机溶剂[9-10]。SPME有多种萃取形式,包括管内固相微萃取、固相微萃取纤维和固相微萃取搅拌棒(stir-bar sorptive extraction, SBSE)等。瓜环是一类人工合成的新型大环化合物。亚甲基桥联不同数目的苷脲单元形成不同空腔大小的瓜环(Q[n],n=5~10)。瓜环对分子的识别作用可通过疏水的空腔和富含羰基氧原子的端口来完成,呈现出作用模式丰富、分子识别能力强的特点。疏水的空腔与中性小分子或分子的中性部分通过疏水作用发生主客体包结作用,而瓜环的端口因呈负电性可与分子的极性部分发生离子-偶极、氢键等作用[11-12]。
本文团队报道将普通七元瓜环衍生化为单羟基七元瓜环(Q[7]-OH)后与端羟基聚二甲基硅氧烷(OH-PDMS)一起作为固定相,溶胶-凝胶法制备了基于单羟基七元瓜环的固相微萃取搅拌棒并应用于食品中残留雌激素的测定[13]。本文基于该萃取小棒良好的分子识别能力,首次对环境水样中的3种硝基苯酚异构体同时进行了富集。为了提高萃取小棒对硝基苯酚异构体的萃取效率,对影响萃取效率的因素,如萃取时间、溶液pH值、盐离子浓度、解吸溶剂、解吸时间等进行了优化,并在最优萃取条件下,利用SBSE-高效液相色谱(high performance liquid chromatography, HPLC)-二极管阵列检测器(diode-array detector, DAD)方法对水中的硝基苯酚异构体进行了测定,取得了满意的结果。
1 材料与方法
1.1 试剂与仪器
甲醇、乙腈,色谱纯;磷酸、氯化钠、二氯甲烷,分析纯。三氟乙酸(TFA),γ-缩水甘油醚氧丙基三甲氧基硅烷 (KH-560),端羟基聚二甲基硅氧烷(OH-PDMS),甲基三甲氧基硅烷(MTMOS),含氢硅油(PMHS)均购自阿拉丁试剂公司(上海)。去离子水由Millipore 公司超纯水器制得。对照品邻硝基苯酚、间硝基苯酚和对硝基苯酚购自阿拉丁试剂公司,用甲醇配成浓度为1.0×10g/mL的混合储备液,于冰箱中4 ℃保存。混合贮备液经甲醇进一步稀释配成不同浓度的标准工作溶液并于冰箱中4 ℃保存。
岛津LC-10A高效液相色谱仪(日本),配备自动进样器和二极管阵列检测器(diode-array detector, DAD); KQ2200 型超声波清洗器(昆山超声波仪器有限公司);ZNCL-S-5D 多点智能磁力搅拌器(河南予华仪器有限公司)。TGL-16C高速离心机(上海安亭仪器厂)。
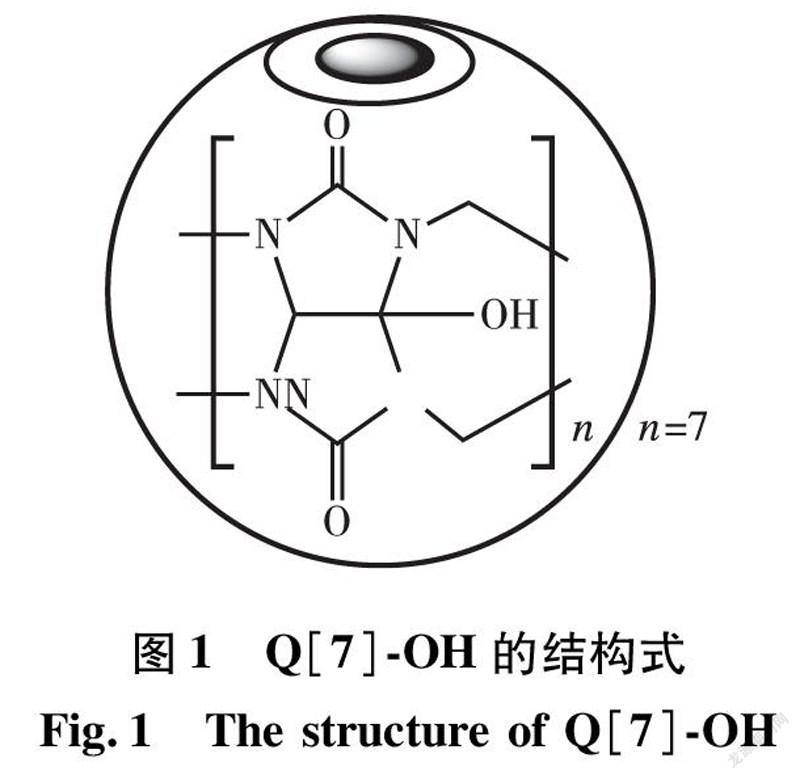
根据文献[14]的方法, 实验室自制单羟基七元瓜环(Q[7]-OH),结构如图1所示。
1.2 萃取小棒(SBSE)的制备
将1.0 mm × 15 mm 的玻璃管作为萃取小棒的载体,其内心密封一段铁丝并两端烧结封死。将此玻璃管浸泡在l mol/L的NaOH溶液中8 h,去离子水清洗后再浸泡在0.1 mol/L的HCl溶液中2 h,最后用去离子水洗至中性并在120 ℃下烘干备用。
SBSE小棒的制备:于10 mL聚氯乙烯离心管中依次加入Q[7]-OH 20 mg,TFA(95%)300 μL,CHCI 500 μL,OH-PDMS 300 μL,MTMOS 50 μL,PMHS 50 μL和KH-560 300 μL。离心管在涡旋振荡器上混匀3 min后,在高速离心机上以12 000 r/min离心5 min,用滴管移出上清液置于另一个10 mL的聚氯乙烯离心管中。将处理好的玻璃管放入此清液中进行反復涂覆,涂覆的次数可控制小棒涂层的厚度。涂覆好的SBSE小棒于氮气保护下室温放置12 h成胶。
小棒老化:为使凝胶涂层固化,需对小棒进行加热老化处理。成胶后的小棒放置于100 mL圆底烧瓶中,氮气保护下升温老化小棒。温度设置为60 ℃,小棒保持30 min,然后升温至120 ℃停留1 h,最后温度升到180 ℃保持1 h完成小棒的老化。
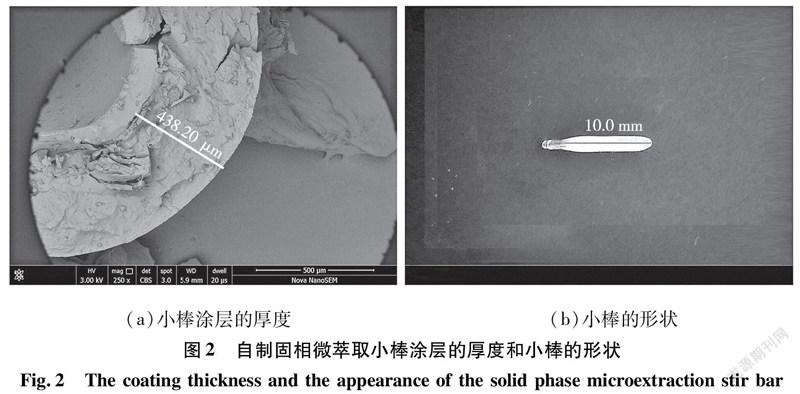
小棒清洗:小棒涂层上未反应的固定相可通过清洗的方法去除。将制备好的小棒在80 ℃蒸馏水中浸泡清洗1 h可去除未反应的Q[7]-OH,然后再放入40 ℃二氯甲烷中回流清洗2 h可去除未反应的其他有机反应试剂。制备好的小棒经电镜测量厚度大约为 440 μm ,如图2所示。小棒的涂层表面具有粗糙、多孔的特点,与文献[13-14]的结果一致,因此有关的表征如电镜、红外、热重等不过多赘述。(a)小棒涂层的厚度 (b)小棒的形状
1.3 SBSE-HPLC 实验方法
在10 mL带密封垫的样品瓶中放入1根自制的萃取小棒,精密加入经0.45 μm 滤膜过滤后的水样样品8.0 mL,并在室温下搅拌萃取50 min。萃取完成后,取出小棒用无尘纸擦干表面的水分。将萃取后的小棒放入200 μL样品瓶内插管中,加入甲醇100 μL,超声解吸10 min。取20 μL解吸液进行HPLC分析。小棒每次使用后,需用5 mL甲醇分别超声洗涤3次以除去吸附的杂质。
1.4 色谱条件
色谱柱,ODS-BP(SinoChrom,4.6 mm×200 mm, 5 μm);检测波长220 nm;流动相,甲醇-水(用磷酸调pH=5.0),其中甲醇的体积分数为30%;流速0.8 mL/min;进样量20 μL;温度,室温。
2 结果与讨论
2.1 萃取条件的优化
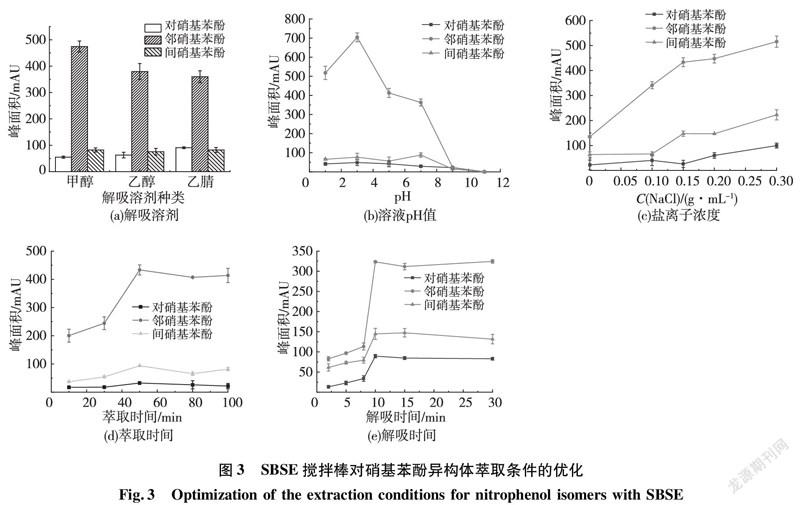
用自制的SBSE小棒考察了解吸溶剂的种类、溶液的pH值、盐离子浓度、萃取时间、解吸时间等因素对3种硝基苯酚异构体萃取效率的影响,确定最佳萃取条件。
2.1.1 解吸溶剂的考察
解吸溶劑是影响小棒萃取效率比较重要的因素。合适的解吸溶剂可使吸附的待测物质完全解吸以提高萃取效率。本实验考察了甲醇、乙醇和乙腈作为解吸溶剂对硝基苯酚异构体萃取效率的影响,结果如图3(a)所示。从图3(a)可以看出:甲醇对3种化合物的解吸效果最好,故选做本实验的解吸剂;自制小棒对邻硝基苯酚的萃取效率最好,这可能是因为邻硝基苯酚的空间位阻最小,最有利于分子上的苯环进入七元瓜环的空腔而发生相互作用。
2.1.2 萃取溶液的pH值
酸性或碱性化合物在溶液中的存在形式受溶液pH值的影响很大。一般中性存在形式更利于涂层的萃取。酚类化合物是酸性物质,在酸性条件下以分子形式存在有利于萃取。从图3(b)可以看出,3种硝基苯酚异构体在pH为3时,萃取效率均为最佳,故选择pH为3作为最佳萃取pH值。
2.1.3 盐离子浓度
盐效应可通过增加溶液中离子强度的方式降低有机物在水中的溶解度,使待测物以分子形式析出,有利于在涂层上的吸附。从图3(c)可以看出:随着加入盐离子浓度的增大,3个硝基苯酚化合物的萃取效率提高,盐离子浓度为0.30 g/mL时几乎已达到其饱和浓度,因此采用饱和氯化钠作为盐离子浓度。
2.1.4 萃取时间
萃取时间越长,待测物在小棒上吸附的量越多,最后吸附达到平衡,萃取量不再增加。从图3(d)可以看出,当萃取时间为50 min时,吸附量达到最大,所以选择50 min为最佳萃取时间。
2.1.5 解吸时间
解吸时间越长,目标物解吸得越彻底,但过长的解吸时间会缩短涂层的使用寿命。从图3(e)可以看出,解吸时间为10 min 时就可获得最好的萃取效率,因此选择10 min为最佳解吸时间。
2.2 SBSE-HPLC-DAD分析方法的方法学验证
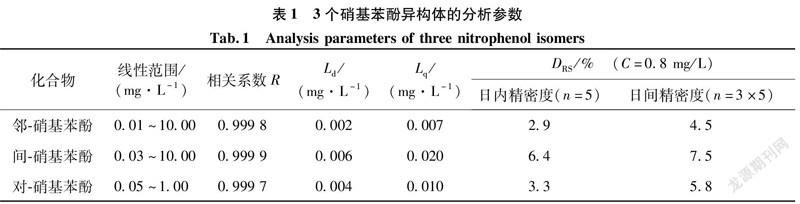
精密量取相同体积不同浓度的混合标准溶液分别加入到8 mL水样中,配成一系列浓度的加标溶液,按照1.3 和 1.4的方法进行处理并测定。以3个硝基苯酚异构体的峰面积对质量浓度进行线性回归,得到3个硝基苯酚的线性范围和相关系数。方法的检测限(Ld)和定量限(Lq)分别按照公式L = 3S/S和L= 10S/S进行计算,其中,S为10次空白试剂所测值的标准偏差,S为分析校准曲线的斜率。日内精密度以浓度为0.8 mg/L的样品在一日内连续测定5次的相对标准偏差来表示;日间精密度则以同一个样品连续测定5 d,每天重复测定3次的相对标准偏差表示。所有测定结果如表1所示。从表1可以看出:本法的线性范围为0.01~10.00 mg/L,检测限为0.002~0.006 mg/L,日内、日间精密度的相对标准偏差(D)为2.9%~7.5%, 说明该法具有较宽的线性范围、良好的灵敏度和重现性。
2.3 实际样品分析
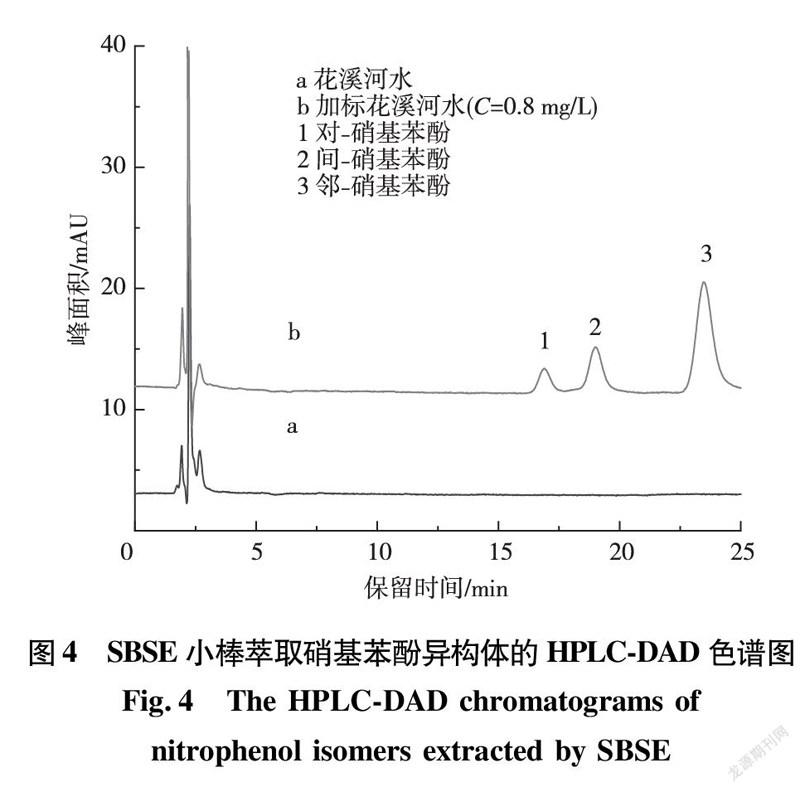
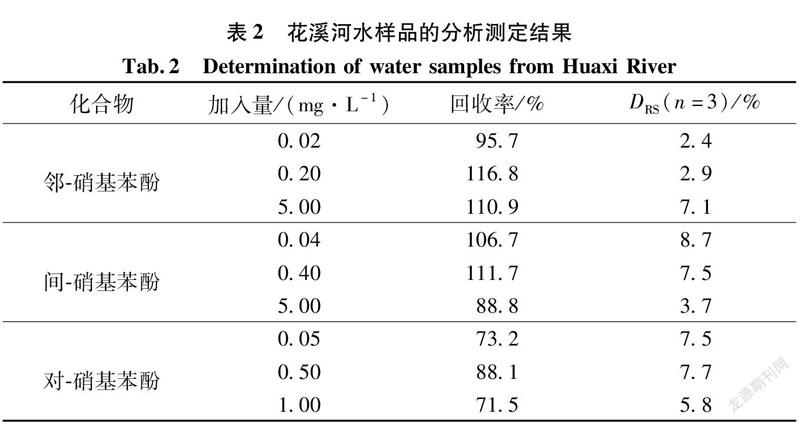
为检验本方法的适用性,对当地花溪河水、自来水和校园湖水进行了检测,没有检测出3种硝基苯酚异构体。以花溪河水为样本,在高、中、低3个浓度水平进行了加标回收率实验,相关的色谱图如图4所示,测定结果见表2。3个加标浓度的平均相对回收率为71.5%~116.8%,相对标准偏差为2.4%~8.7%,说明所建立方法的准确度和精密度良好,可用于实际水样中3种硝基苯酚异构体的测定。
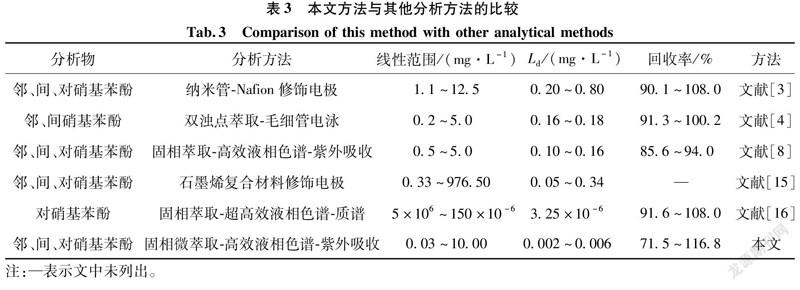
2.4 本文方法与其他分析方法的比较
将本文方法与文献报道的测定水样中硝基苯酚异构体的方法进行了比较,结果见表3。从表3可以看出,本文方法具有更好的灵敏度,样品处理简单、环保、取样量少。结果表明:自制萃取小棒选择性好,萃取性能高,能较好地提高仪器测定的灵敏度。
3结论
通过溶胶-凝胶方法制备了基于单羟基七元瓜环的固相微萃取搅拌棒,联用HPLC-DAD建立了水样中3种硝基苯酚异构体的测定方法。通过对萃取条件的优化,得到固相微萃取搅拌棒对酚类物质萃取的最优萃取条件为:萃取时间50 min, 溶液的pH值为3.0,盐离子浓度为饱和氯化钠,解吸溶剂为甲醇,解吸时间10 min。方法的样品预处理简单、环保、样品用量少。测定结果准确、灵敏,满足水样中痕量硝基苯酚异构体的检测要求。参考文献:
[1]BHUSHAN B, CHAUHAN A, SAMANTA S K, et al. Kinetics of biodegradation of p-Nitrophenol by different bacteria[J]. Bio-chemical & Biophysical Research Communications, 2000, 274: 626-630.
[2] 王志强, 张依章, 张远, 等. 太湖流域宜潥河酚类内分泌干扰物的空间分布及风险评价[J]. 环境科学研究, 2012(12): 1351-1358.
[3] 郭九吉, 薄新党, 王非, 等. 单壁碳纳米管-Nafion修饰电极同时测定硝基苯酚异构体[J]. 郑州大学学报(理学版), 2012, 44(2): 72-75.
[4] 程佳, 候文欣, 程晓昆, 等. 双浊点萃取-毛细管电泳法分离测定井水中痕量硝基苯酚位置异构体[J]. 安徽农业科学, 2011, 39(12): 7338-7341.
[5] 环境保护部. 水质 酚类化合物的测定 液液萃取/气相色谱法: HJ 676—2013[S]. 北京: 中国环境科学出版社, 2013.
[6] 环境保护部. 水质 酚类化合物的测定 气相色谱法-质谱法: HJ 744—2015[S]. 北京: 中国环境科学出版社, 2015.
[7] 彭华, 赵新娜, 王晶晶, 等. 固相萃取-液相色谱/质谱法测定水中硝基苯酚类化合物[J]. 环境监控与预警, 2017, 9(3): 31-34.
[8] 王芳, 岳方. 固相萃取-高效液相色谱法同时测定水中硝基苯酚的三种异构体[J]. 广东化工, 2011, 38(10): 155-156.
[9] ARTHUR C L, PAWLISZYN J. Solid phase microextraction with thermal desorption using fused silica optical fibers[J]. Analtical Chemistry, 1990, 62: 2145-2148.
[10]JELEN H H, MAJCHER M, DZIADAS M. Microextraction techniques in the analysis of food flavor compounds: a review[J]. Analytical Chimica Acta, 2012, 738:13-26.
[11]KIM J, JUNG I S, KIM S Y, et al. New cucurbituril homologues syntheses, isolation characterization and X-ray crystal structures of cucurbit[n]uril(n=5,7,and 8) [J]. Journal of the American Chemical Society, 2000, 122: 540-541.
[12]ANTHONY I D, RODNEY J B, ALAN P A, et al. A cucurbituril-based gynoscane a new supramolecular form[J]. Angewandte Chemie International Edition, 2002, 41: 275-277.
[13]姚鍵梅, 董美玉, 张凌雪, 等. 衍生瓜环固相微萃取搅拌棒-高效液相色谱测定食品中残留雌激素[J]. 分析化学, 2019, 47(3): 463-470.
[14]DONG N, ZHANG L X, YAO J M, et al. Monohydroxycucurbit[7]uril-coated stir-bar sorptive extraction coupled with high-performance liquid chromatography for the determination of apolar and polar organic compounds [J]. Microchimica Acta, 2019, 186: 846-856.
[15]王峻敏, 范哲峰. 石墨烯复合材料修饰电极对硝基苯酚同分异构体的测定[J]. 分析试验室, 2015, 34(9): 1086-1089.
[16]张再峰, 沈志群, 陆亮. 在线富集固相萃取-超高效液相色谱串联质谱法测定地表水中对硝基苯酚[J]. 环境监控与预警, 2019, 11(2): 31-33.
(责任编辑:周晓南)
Determination of Nitrophenol Isomers in Environmental Water by
Solid-phase Microextraction Based on Monohydroxy-Cucurbit[7]uril
ZHAO Yuxuan, DONG Nan*, DONG Meiyu
(School of Chemistry and Chemical Engineering, Guizhou University, Guiyang 550025, China)Abstract: Stir-bar sorptive extraction (SBSE) based on PDMS/Q[7]-OH was prepared by sol-gel method using hydroxyl-terminated polydimethylsiloxane (OH-PDMS) and monohydroxy-cucurbit[7]uril (Q[7]-OH) as stationary. A SBSE-High performance liquid chromatography with diode array detector (HPLC/DAD) method was developed for the simultaneous determination of three nitrophenol isomers in environmental water samples. The extraction time, pH value of solution, the concentration of salt ions, desorption solvent and desorption time were optimized. Under optimal conditions, the linear range of three nitrophenol isomers determined by SBSE-HPLC-DAD was between 0.01 mg/L and 10.00 mg/L, and the correlation coefficient were all greater than 0.999 7. The limits of detection of the proposed method were in the range of 0.002-0.006 mg/L. The mean relative recoveries at three spiked levels ranged from 71.5% to 116.8%, with intra-precision and inter-precision both in the range of 2.9%-7.5%. The proposed method is simple and sensitive, and it is suitable for the simultaneous analysis of phenols in environmental water.
Key words: monohydroxy-cucurbit[7]uril; stir-bar sorptive extraction; nitrophenols isomers; high performance liquid chromatography; environmental water samples

