肾盂癌与输尿管癌术后预后分析
王鹏远 尚义超 郑铎 尚攀峰 岳中瑾
上尿路尿路上皮细胞癌(upper tract urothelial carcinoma,UTUC)包括肾盂癌和输尿管癌,约占尿路上皮癌(urothelial carcinoma,UC)的5%~10%[1]。尽管病理分期、肿瘤分级以及淋巴结转移已被确定为UTUC的预后因素[2-4],然而,原发肿瘤位置对病人的预后的影响一直是一个有争议的话题。有学者研究发现输尿管肿瘤比肾盂肿瘤的预后差,从而提出这样的假设:输尿管的外膜薄且周围具有广泛的淋巴和血液通道,使肿瘤更加容易侵袭和转移,而肾实质和周围脂肪组织是肾盂肿瘤早期扩散的屏障[5-6]。此外,一些多中心研究发现肿瘤位置对于肿瘤的复发和生存没有影响[7-8]。因此,本研究回顾性分析2014年1月至2019年8月在兰州大学第二医院接受根治性肾输尿管切除术+膀胱袖状切除术的167例UTUC病人临床资料,探讨肿瘤位置与UTUC病人预后的关系。
对象与方法
一、对象
本研究167例UTUC病人,男85例(50.9%),女82例(49.1%)。平均年龄(65.1±8.4)岁。血小板淋巴细胞比值(PLR)≥130.22 69例(41.3%),纤维蛋白原(FIB)≥3.55 g/L 58例(34.7%)。肾盂肿瘤94例(56.3%),输尿管肿瘤73例(43.7%),其中输尿管上段肿瘤22例(13.2%),输尿管中段肿瘤21例(12.6%),输尿管下段肿瘤30例(17.9%)。18例(10.8%)出现膀胱或输尿管残端复发,17例(10.2%)出现远处转移。全部病人行根治性肾输尿管切除术+膀胱袖状切除术。术前经过新辅助化疗、放疗或免疫治疗等其他抗肿瘤治疗措施;术前合并有其他部位的恶性肿瘤,如膀胱癌等。术前已发生远处转移的病人,具有多发病灶(肾盂和输尿管)的病人均被排除在外。本研究经兰州大学第二医院伦理委员会批准。病理T分期根据2009年国际抗癌联盟TNM分期决定,肿瘤分级以世界卫生组织(WHO)1973年指南为标准。
二、随访
所有病人术后第1年每3个月随访1次,第2~3年每6个月随访1次,3年以上每年随访1次。随访项目:血常规、尿常规、生化检查、膀胱镜检查、影像学检查。结局指标为总体生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS)。OS定义为术后死亡的时间或随访终止时间,PFS定义为术后复发、转移、死亡的时间或随访终止时间。
三、统计学分析
采用SPSS 23.0统计软件处理数据。计数资料以例(%)表示,组间比较采用χ2检验。采用受试者工作特征(receiver operating character,ROC)曲线计算连续性变量的最佳截断值。采用Kaplan-Meier法绘制OS和PFS生存曲线,并用Log-rank检验生存曲线的差异。采用单因素和多因素Cox风险比例模型分析影响预后的因素。P<0.05为差异有统计学意义。
结果
一、临床病理特征
不同肿瘤位置病人的临床病理资料见表1。参考文献标准[9],将肿瘤直径3 cm作为划分标准,本研究肿瘤直径<3 cm 54例(32.3%),直径≥3 cm 113例(67.7%)。肿瘤分级G1~2级52例(31.1%),G3级115例(68.9%)。病理T分期pTa/T1期54例(32.3%),pT2~4期113例(67.7%)。肿瘤位于左侧75例(44.9%),右侧92例(55.1%)。血小板淋巴细胞比值(platelet-to-lymphocyte ratio,PLR)≥130.22 69例(41.3%),PLR<130.22 98例(58.7%)。纤维蛋白原(fibrinogen,FIB)≥3.55 g/L 58例(34.7%),FIB<3.55 g/L 109例(65.3%)。肾盂肿瘤和输尿管肿瘤与病人的性别、年龄、侧别、手术入路、肿瘤分级、病理T分期、术前PLR、术前FIB比较差异均无统计学意义(P>0.05),而肿瘤位置与肿瘤大小相关(P<0.001)。
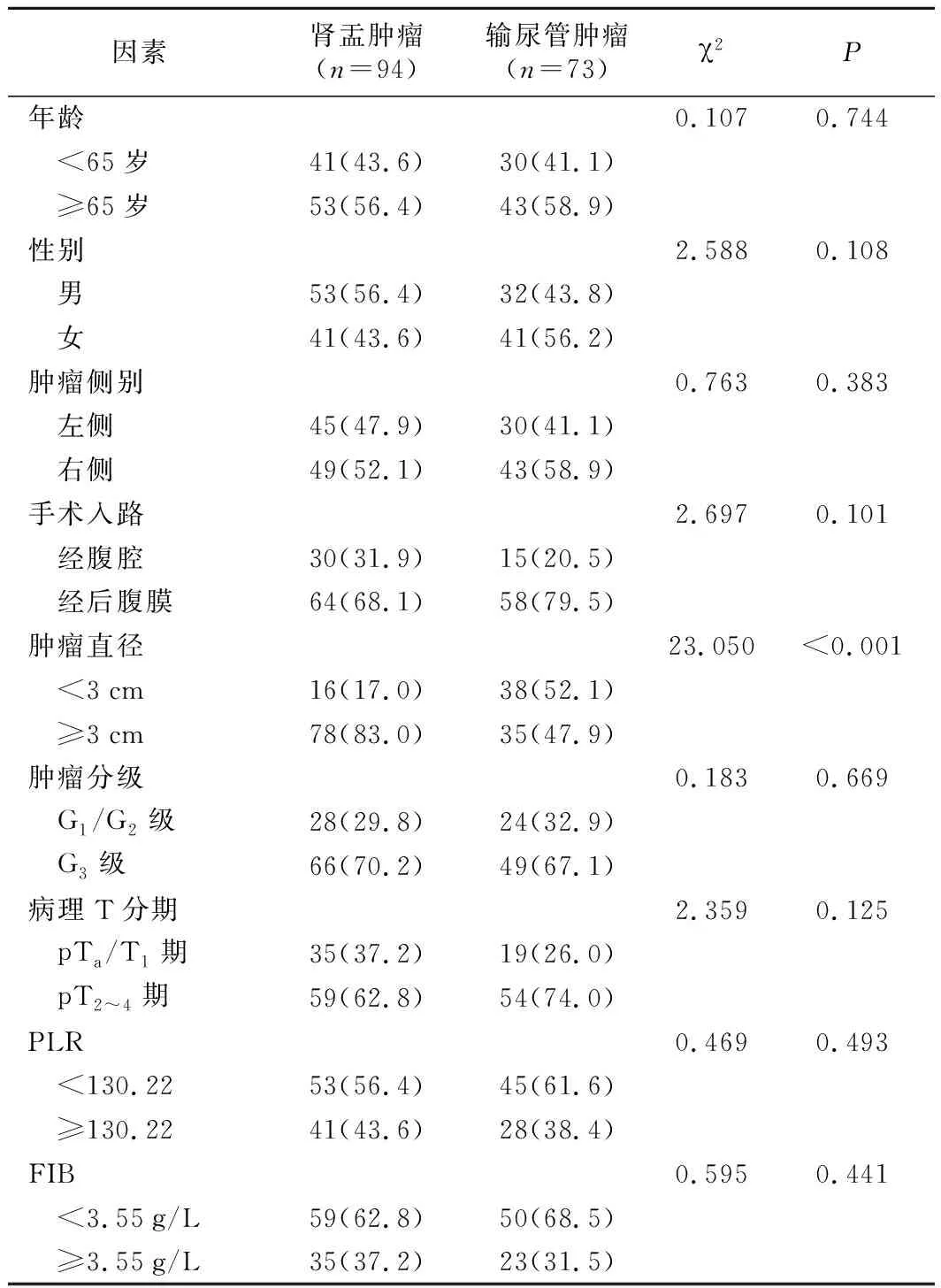
表1 不同肿瘤位置UTUC病人临床病理资料比较[例(%)]
二、肿瘤位置与OS和PFS相关性分析
本组167例病人中位随访时间为42(3~89)个月,27例(16.2%)死亡,34例(20.4%)出现远处转移或膀胱内复发。单因素分析结果见表2,年龄、性别、肿瘤侧别、手术入路、肿瘤直径、肿瘤位置与OS和PFS无相关性(P>0.05),病理T分期、术前PLR、术前FIB与OS和PFS呈显著相关性(P<0.05),肿瘤G分级仅与OS相关(P=0.011)。将单因素结果中有意义的指标纳入多因素分析中,结果见表3,肿瘤G分级、病理T分期和术前FIB升高是OS的独立预后因素,病理T分期及术前FIB升高是PFS的独立预后因素。生存曲线显示,肿瘤位置与OS和PFS无相关性(图1)。
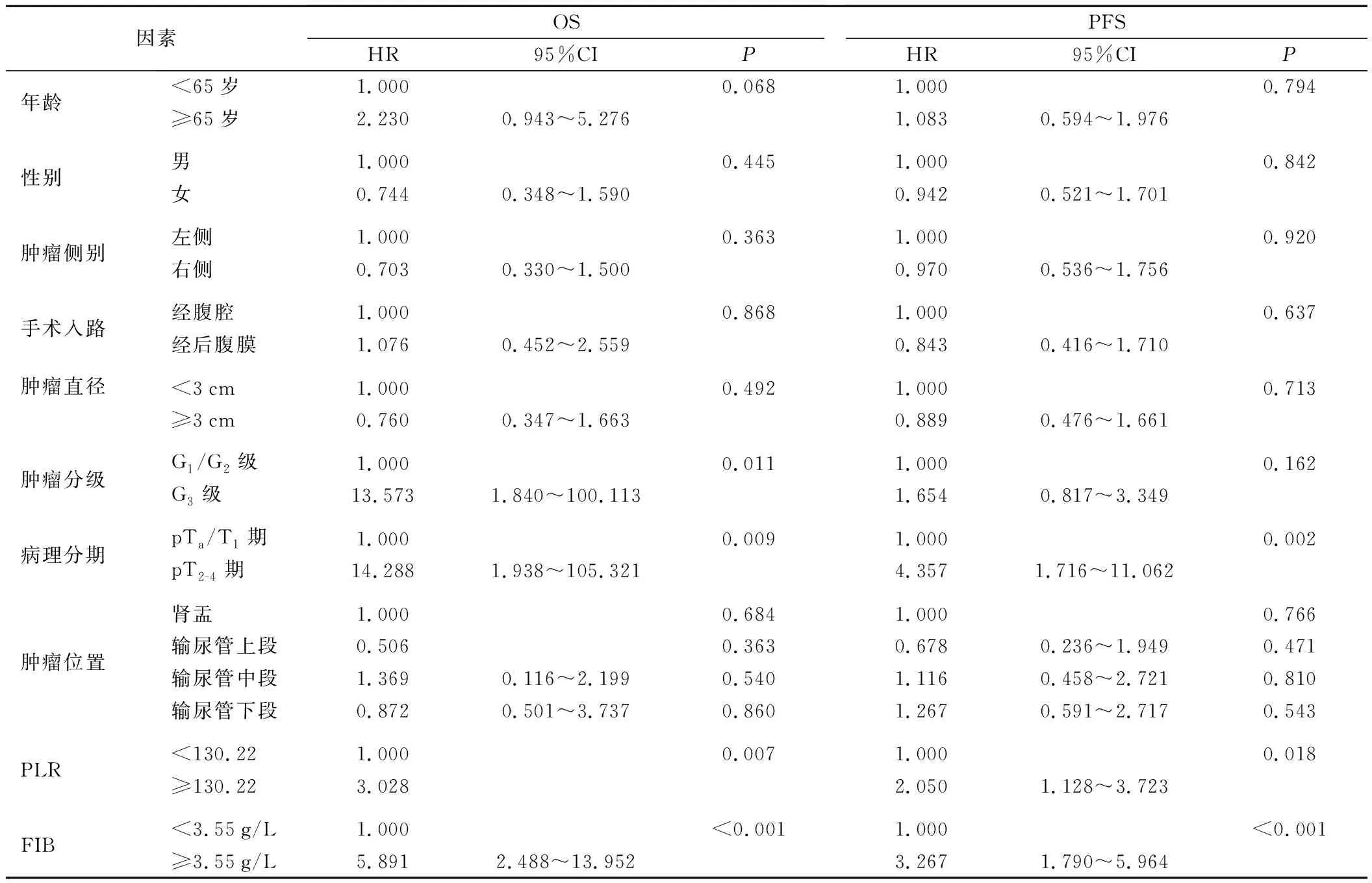
表2 UTUC病人OS及PFS的单因素分析

表3 UTUC病人OS及PFS的多因素Cox回归分析

图1 肾盂癌及输尿管癌生存曲线
讨论
UTUC作为一种少见但恶性程度相对较高的肿瘤,有关其预后和复发的危险因素一直是国内外学者研究的重点[10-14]。目前判断UTUC病人预后的指标主要有病理分期、肿瘤分级以及淋巴结转移等[2-4]。然而,肿瘤发生位置是否会影响UTUC病人的生存以及预后存在争议。两项单中心研究发现,输尿管近端的肿瘤病人预后更差,从而提出了输尿管的外膜薄且周围具有广泛的淋巴管和血管,肿瘤更容易侵袭和转移,而肾实质和肾周脂肪是肾盂肿瘤扩散的屏障的假设[5-6]。一项Meta分析显示,肾盂肿瘤的无复发生存率及癌症特异生存率优于输尿管肿瘤[15]。Inamoto等[16]根据肿瘤位置将UTUC病人分为8组,研究发现输尿管远端的肿瘤是预后的独立危险因素。然而其他大样本量,多中心的研究并未发现肿瘤位置与预后相关。Raman等[17]基于SEER数据库共纳入13 800例UTUC病人,发现UTUC病人预后与年龄、性别相关,而与肿瘤位置无关。Isbarn等[8]发现,相对于输尿管肿瘤,肾盂肿瘤的pT分期以及淋巴结转移率更高,差异有统计学差异,但肿瘤位置与预后无关。Margulis等[18]进行多中心研究发现,UTUC病人预后与年龄,pT分期,肿瘤分级,淋巴结转移等相关,与肿瘤位置无关。Williams等[19]认为,肿瘤多灶性是影响UTUC病人预后的危险因素,而不是肿瘤位置。本研究结果显示,肾盂肿瘤及输尿管肿瘤直径差异有统计学意义,这可能是由于肿瘤生长环境和肾盂及输尿管解剖结构不同造成。单因素分析显示,肿瘤位置与OS及PFS无关。多因素分析显示,病理T分期以及术前FIB升高是UTUC病人预后的独立危险因素。其中FIB作为评价凝血功能指标之一,近年来发现与肿瘤的发生发展密切相关。研究发现,FIB通过促进肿瘤新生血管形成和肿瘤细胞的黏附在肿瘤生长、侵袭和转移过程中发挥积极作用[20-22],这也为UTUC病人预后提供一个新的评价指标,但仍需大样本量,前瞻性研究证明。因此,对于不同位置的UTUC病人应该统一管理。
本研究仍有不足之处,首先,本研究的随访时间较短;其次,本研究为单中心回顾性研究,纳入的病例数有限,可能存在选择偏倚。尽管存在不足之处,但本研究与国内外大量研究结果一致:行根治性肾输尿管切除术+膀胱袖状切除术的UTUC病人,肿瘤位置无法预测病人的预后。对肿瘤位于肾盂和输尿管的UTUC病人术后不应给予不同的辅助治疗。

