多发性骨髓瘤病人椎体压缩性骨折风险预测模型构建分析
孙辉 王碧薇 崔泽军
多发性骨髓瘤(multiple myeloma,MM)由单克隆丙种球蛋白病(MGUS)演变而来[1],MGUS作为恶性前期,没有相关的骨髓浸润(<5%浆细胞),也没有骨骼事件,在80%的MM病人中发现弥漫性和(或)局灶性溶骨性破坏以及骨质疏松,这些变化导致骨折的高发病率,其中椎体压缩性骨折最常见[2-3]。预测即将发生椎体压缩性骨折的风险,是决定是否进行手术治疗、化疗等治疗的关键。除年龄、性别、体质量指数(BMI)等基础资料外[4-5],几项研究提出了通过测量局灶性侵蚀的数量或范围来预测骨折的方法,并表明双能X线吸收法测定的骨密度可预测MM的股骨、髋部骨折风险和治疗反应[6-7],但这些因素是否能成为预测椎体压缩性骨折的可用数据仍值得探究。本研究从病人基本特征和椎体特定因素出发,试图构建椎体压缩性骨折风险的预测模型,为早期采取针对性处理措施提供理论依据。
对象与方法
一、对象
我院2017年4月~2021年1月收治的MM病人114例。纳入标准:(1)符合MM诊断标准[8],经组织活检证明有浆细胞瘤或骨髓涂片检查中浆细胞比例>30%,伴有形态改变;(2)肝、肾功能正常;(3)具有较完整的临床资料。排除标准:合并其他部位肿瘤;合并代谢性骨病;合并单抗遗传病;合并骨质疏松;因创伤所致的椎体压缩性骨折。专门人员收集病人一般资料,对数据进行平行双录入。经我院伦理委员会批准,病人及家属均签署知情同意书。
二、方法
1.预测模型构建及验证:(1)建模:收集一般资料,对骨折风险行单因素和多因素分析,筛选与骨折有关的因素进行多因素Logistic回归分析:将筛选后各独立因素绘制风险预测模型的列线图;(2)模型验证:采用Bootstrap抽样法重复抽样1 000次,绘制校准曲线并计算C-index及95%置信区间。
2.治疗方案:参考中国多发性骨髓瘤诊治指南(2015年版)予以治疗,包括含蛋白酶体抑制剂、免疫调节药物、细胞毒药物的诱导、巩固和维持治疗。以硼替佐米/环磷酰胺/地塞米松(VCD)、来那度胺/硼替佐米/地塞米松(RVd)、硼替佐米/阿霉素/地塞米松(PAD)和硼替佐米/沙利度胺/地塞米松(VTD)为主。
3.资料采集:治疗前收集病人一般资料如年龄、性别、病程、BMI、DS 分期、免疫分型(IgA、IgG、轻链型)、骨折节段(单节段、多节段)、骨折部位(胸段、腰段)、骨髓浆细胞比例及脊柱肿瘤脊椎不稳评分(SINS)。
4.实验室及影像学资料:抽取空腹肘静脉血5 ml,采用全自动化血细胞分析仪(DxH 600型)检测血红蛋白(Hb)、血清白蛋白(ALB);采用LB-CA-1 钙离子测定仪测定血清钙水平;采用迈瑞BS-280型生化分析仪检测血清β2- 微球蛋白(β2-MG)、血肌酐(Scr)水平。采用全身螺旋CT扫描仪(西门子 Definition AS40CT)进行轴位扫描,设置参数层厚5mm,增强扫描静脉注射非离子型含碘对比剂,流速2.5 ml/s,基于最大可能感兴趣区域测量Hounsfield单位(HU)的CT衰减。
5.随访及椎体压缩性骨折诊断标准:随访观察3个月,于门诊定期复查,截止2021年5月1日,根据中国多发性骨髓瘤诊治指南(2015年版),经MRI、CT或X线片检查,任何椎体高度损失20%定义为椎体压缩性骨折。
三、统计学处理

结果
1.椎体压缩性骨折发生情况:截止末次随访时间2021年5月1日,44例发生椎体压缩性骨折,70例未发生椎体压缩性骨折,椎体压缩性骨折发生率为38.60%。
2.临床资料比较:骨折组和未骨折组性别、年龄、病程、免疫分型、DS分期、化疗方案、骨折节段、骨折部位比较差异无统计学意义(P>0.05),骨折组和未骨折组BMI、骨髓浆细胞比例、SINS评分比较差异有统计学意义(P<0.05)。见表1。
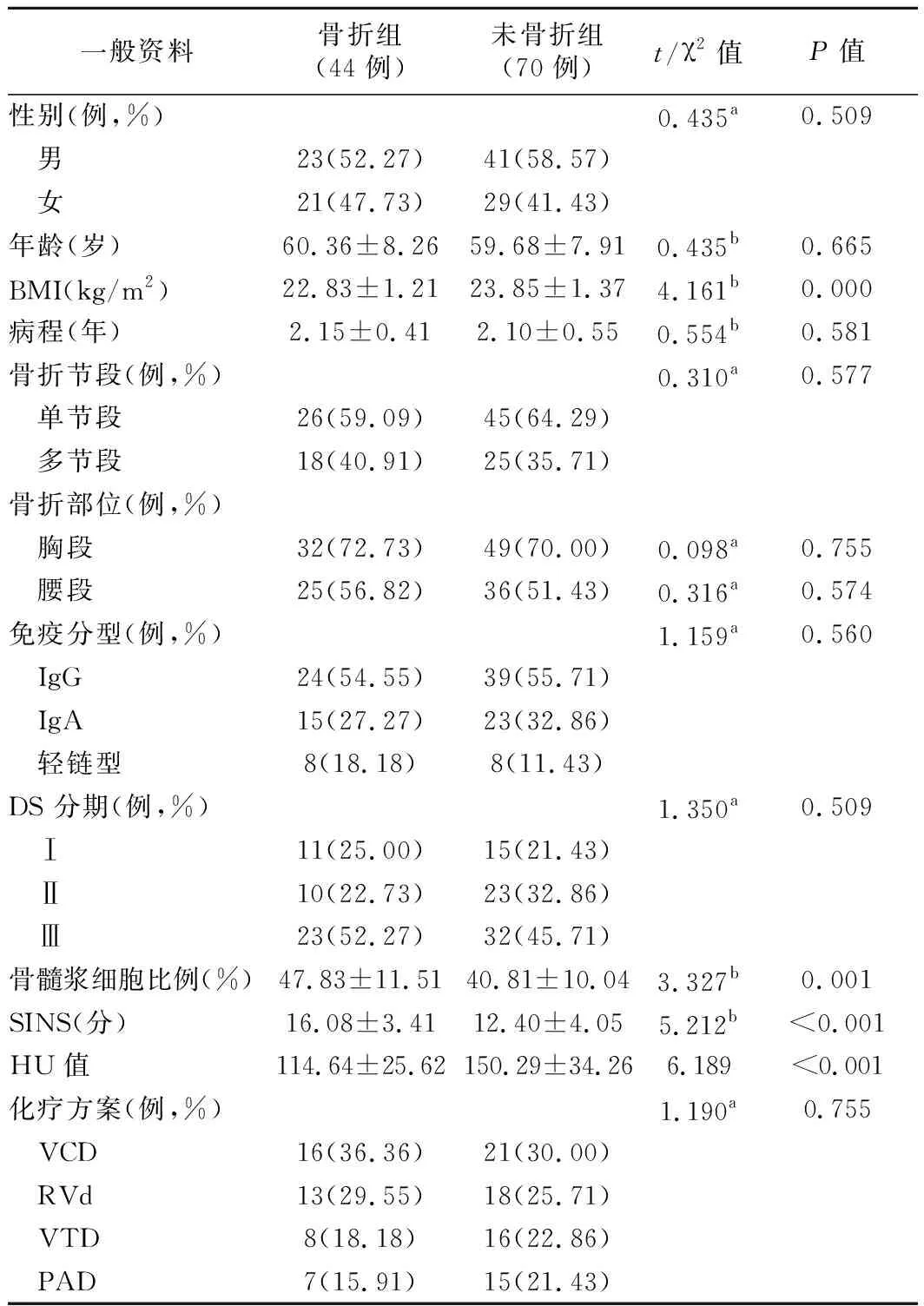
表1 两组病人一般资料比较
3.实验室及影像学指标对比:骨折组和未骨折组血清β2-MG、Scr、血清钙、ALB、Hb比较差异无统计学意义(P>0.05),骨折组和未骨折组HU值比较差异有统计学意义(P<0.05),见表2。

表2 两组实验室指标急影像学指标比较
4.椎体压缩性骨折风险多因素Logistic回归分析:以是否发生椎体压缩性骨折作为因变量(骨折=1,未骨折=0),将上述差异有统计学意义的变量作为自变量进行Logistic回归分析,变量筛选采用逐步法(α入=0.05,α出=0.1);多因素Logistic分析显示,高BMI(OR=0.464,95%CI 0.293~0.735)、高HU值(OR=0.966,95%CI 0.949~0.984)为骨折的保护因素,高SINS(OR=1.285,95%CI 1.111~1.487)、骨髓浆细胞比例大(OR=1.078,95%CI 1.025~1.133)为骨折的危险因素(P<0.05),见表3~4。

表3 椎体压缩性骨折风险Logistic分析的赋值表

表4 椎体压缩性骨折风险多因素Logistic回归分析
5.椎体压缩性骨折风险列线图模型的构建与评估:将影响MM病人椎体压缩性骨折风险的独立相关因素纳入列线图模型,预测骨折相关因素的C-index为0.913(95%CI 0.863~0.963),校正曲线显示观察与实际预测情况一致性好。见图1~2。

图1 椎体压缩性骨折预测列线图

图2 椎体压缩性骨折预测模型校正曲线
讨论
MM在疾病进展过程中会出现骨质破坏,且骨质破坏可发生在疾病的整个病程中,这种病理机制与破骨细胞及成骨细胞造成的骨质代谢失衡有关[9]。MM病人在发病过程易出现骨相关事件,其中以椎体压缩性骨折较为常见[10]。椎体压缩性骨折可引起严重背痛、脊柱不稳、新骨折风险增加、神经功能障碍和身体症状恶化。有研究证实,椎体压缩性骨折的发生风险与显著死亡率相关[11]。目前的治疗虽然能使病人获益,但这些治疗主要集中于缓解症状和防止骨折进展,但在脊柱不稳定的早期迹象开始时,获得最佳的功能结果,可能有助于提高这些治疗的成功率。预测MM骨折风险模型中,有研究多集中于对MM所致的长骨骨折探讨,并表明PET/CT影像学预测、较大的损伤尺寸及较长的病变潜伏期等变量制定新的评分系统可有效预测[12]。少量研究对MM椎体压缩性骨折进行预测,认为病人的特征,如年龄、性别、BMI是MM椎体压缩性骨折的预测因子[12-13]。
和既往研究不同的是,我们并未发现在年龄、性别方面的差异,虽然并非所有研究都发现年龄、性别方面与骨折间的这种联系,但普遍认为,女性、年长患有椎体压缩性骨折的风险更高[14-15]。Zijlstra 等[16]研究发现,男性病人患椎体压缩性骨折风险增加,出现这一情况的原因可能在于该研究中男性病人占比70.99%,本研究纳入男女占比较为均衡,故未出现这一情况。在年龄方面也未体现出差异,可能与样本量少和观察时间短有关。有研究指出,相较于高BMI者,低BMI者更容易发生骨折[17];20 kg/m2的BMI者与25 kg/m2的BMI者相比在骨质疏松或髋部骨折的发生率明显增加[18],也有文献在报道,椎体骨折与BMI下降10个单位有关[19]。本研究中,BMI作为预测因素也被确定,但没有明确机制解释BMI与骨折发生间的关系,我们认为,高BMI是骨量的保护因素,脂肪组织具有使雄激素芳香化为雌激素的作用,使外周脂肪组织中睾酮转化为雌二醇、雄烯二酮转化为雌酮,雌二醇和雌酮分泌则可刺激成骨细胞分泌IGF-1,刺激成骨细胞活性,增加骨密度,同时高BMI者骨所承受的机械负荷增加,可促进骨形成,减少骨吸收,以降低椎体压缩性骨折发生几率。
MM起源于红骨髓,其典型的病变特征为骨髓内异常浆细胞的增生。浆细胞又称之为效应B细胞,是机体免疫系统的重要组成部分,承担着应答抗原刺激和合成、分泌抗体(免疫球蛋白)的重要功能。骨髓浆细胞比例已被证实为MM疗效的评估和监测指标之一[20]。有研究显示, 骨髓瘤浆细胞可通过产生脂肪酸和生长因子,改变破骨细胞功能而导致骨质疏松性骨折发生[21];有研究显示,与骨髓浆细胞比例≥10%的MM病人比较,骨髓浆细胞比例小于10%的病人肿瘤负荷更低,中位生存期也显著延长[22]。本研究显示,骨髓浆细胞比例可预测椎体压缩性骨折发生,这与骨组织受到破坏有关。
脊柱的稳定性是脊柱保持运动程度的能力,肿瘤导致的脊柱不稳定性主要是骨结构破坏,这与退行性、创伤性脊柱不稳定有很大区别。一项荟萃分析显示,SINS可预测椎骨切除术后恶性肿瘤的疗效和生存率[23];Amelot 等[24]研究证实,术前脊柱不稳定性是MM术后生存的预测因素。本研究显示,SINS评分对椎体压缩骨折的预测具有一定价值。MM直接破坏骨质导致脊柱刚性降低,加之MM一般为多节段受累,更有可能发生脊柱不稳或者在原来存在脊柱退行性不稳的基础上又增加了肿瘤相关的不稳定。
在影像学方面,多项研究利用CT的HU值评估骨密度及其在评估骨折风险中的效用,且被认为是一种简单、实用和可靠的技术[25]。先前的一项研究报道了普通人群胸椎和腰椎的HU值,并表明HU值随着年龄的增长而降低,并且这种降低在更多的尾骨椎体中比例更大[26];Muchtar 等[27]研究证实,低BMI或低HU值)与较高的骨折风险相关。本研究中,HU评分较低的椎体压缩性骨折发生率更高,但风险比仅为0.966。与骨质疏松症病人比较,骨密度测定在评估MM病人骨折风险方面的诊断价值有限。因此,放射科医生关于即将发生骨折的风险的陈述对转诊临床医生特别重要,以便决定是否进行额外的外科治疗、椎体成形术、药物干预或放射治疗。另外,构建的列线图预测模型显示,上述因素预测骨折的C-index为0.913(95%CI 0.863~0.963),进一步说明上述因素的预测价值。
综上所述,由BMI、HU值、骨髓浆细胞比例、SINS因素构建的MM病人椎体压缩性骨折风险模型具有较高的预测价值。本研究也存在一定不足,在影像学方面,仅关注基于CT椎体压缩性骨折预测因素,无法详细获取与MM病人溶骨病变的位置、大小和形状以及周围骨组织质量相关的生物力学结构变化,未来的前瞻性研究可通过对骨结构和骨强度的复杂测量,如有限元分析技术,以多种方式改进临床评估,其次样本量相对较少,未对椎体压缩性骨折部位分别构建预测明显,可能导致研究结果出现一定的偏差,考虑到MM是一种异质性疾病,如何通过研究将现有的骨折风险因素有机结合起来,准确选择个性化治疗方案,仍是今后进一步努力研究的方向。

