生物质衍生Fe-N-C多孔炭材料的制备及其对硝基苯的催化还原性能
刘 杏, 尹 铸, 卢贝丽, 吴锋振, 黄 彪
(福建农林大学 材料工程学院,福建 福州 350108)
催化还原是制备石油化工和制药化学关键中间体的重要反应[1],其中硝基芳烃的催化还原是工业上和实验室中常用来制备相应苯胺类化合物的有效方法。苯胺是一种重要的中间体,年产量超过400万吨,在染料、颜料、药物和高分子等的合成中应用广泛,开发高效、经济的苯胺合成方法是化学工业领域一项具有挑战性的任务[2-3]。工业上传统的苯胺生产是以硝基苯为原料,加入过量的还原试剂,反应效率低,副产物多[4]。近年来,硝基苯选择性催化还原制备苯胺备受科学家们的关注。贵金属(Au、Pd、Pt等)基催化剂被广泛用于催化硝基芳烃还原制备氨基芳烃,并表现出较高的催化活性[5-6]。然而,由于贵金属的稀缺性和高成本,以及稳定性差等问题,开发稳定的非贵金属催化剂用于硝基芳烃的高效还原具有重要意义[7]。过渡金属是一类廉价且丰富的非贵金属,主要包括Fe、Co、Ni等,被认为是贵金属催化剂的潜在替代品[8-9]。然而过渡金属颗粒自身容易发生团聚、钝化而失活,杂原子掺杂的多孔炭材料可以作为载体,通过杂原子孤对电子与过渡金属之间的配位以及炭材料特殊的孔道结构稳定金属颗粒,进而提高过渡金属的催化活性[10]。目前,已有文献报道通过热解富含杂原子的金属-有机框架材料或过渡金属与有机配体的配合物成功制备均匀负载过渡金属的掺杂多孔炭材料[11-13]。生物质价格便宜、容易获得、对环境无害,是制备多孔炭材料的理想原料,生物质衍生多孔炭材料的开发利用符合可持续发展的要求。杉木属于亚热带树种,在我国南方分布广泛,在杉木加工生产的过程中,会产生大量的杉木屑,因此急需对林业废弃物杉木屑的高效利用进行研究,扩展杉木屑的应用范围,变废为宝[14]。本研究以廉价易得的林业废弃物杉木屑为碳源,尿素为氮源,与FeCl3·6H2O经过一步炭化制备了一系列Fe-N-C多孔炭材料,探讨了热解温度对多孔炭材料催化性能的影响,并详细考察了负载的铁和氮物种随温度的变化规律,以期为高效构建负载非贵金属的氮掺杂多孔炭催化剂的设计合成提供新思路。
1 实 验
1.1 原料、试剂与仪器
杉木屑(含水率8%~10%),粒径0.3~0.9 mm,福建泉州木材加工厂。尿素、六水合三氯化铁(FeCl3·6H2O)、硝基苯(C6H5NO2)、对硝基氯苯(C6H4ClNO2)、对硝基碘苯(C6H4INO2)、对硝基甲苯(C7H7NO2)、 3-硝基邻二甲苯(C8H9NO2)、对硝基苯酚(C6H5NO3)、 4-硝基苯胺(C6H6N2O2),均为市售分析纯。
Tecnai G2F20透射电子显微镜(TEM),美国FEI公司;X′Pert Pro MPD X射线粉末衍射仪(XRD),荷兰飞利浦公司;ESCALAB 250 X射线光电子能谱(XPS),英国赛默飞世尔科技有限公司;Micromeritics ASAP 2010比表面积与孔径分析仪,美国麦克仪器公司; Invia Reflex激光显微拉曼光谱仪(Raman),英国雷尼绍公司; ICAP7400电感耦合等离子体发射光谱仪(ICP-AES)、Vario EL Cube元素分析仪,德国元素分析系统公司;Agilent 5977 E气相色谱-质谱联用仪(GC-MS),安捷伦科技有限公司。
1.2 催化剂的合成
FeCl3·6H2O、尿素和杉木屑按照质量比2 ∶1 ∶1混合均匀后,在100 ℃烘箱中干燥12 h将水分烘干。干燥后,混合物在管式炉中N2氛围下以5 ℃/min加热速率升温至700、 800、 900和1 000 ℃,并保持 2 h,冷却至室温将样品取出,用纯水搅拌洗涤6 h后过滤,烘干备用。700~1 000 ℃下制备的样品分别标记为Fe-N-C-t(t=700、 800、 900、 1 000)。杉木屑在900 ℃下炭化,不加入FeCl3·6H2O和尿素的样品标记为C-900;尿素和杉木屑按照质量比1 ∶1在900 ℃下炭化,不加入FeCl3·6H2O的样品标记为N-C-900;FeCl3·6H2O和杉木屑按照质量比2 ∶1在900 ℃下炭化,不加入尿素的样品标记为Fe-C-900。
1.3 硝基苯的催化还原实验
将10 mg催化剂、 1 mL异丙醇溶剂、 0.25 mL水合肼(N2H4·H2O,质量分数80%)和1.5 mmol硝基苯依次加入25 mL的Schlenk反应管中。在一定温度下磁力搅拌加热反应一定时间后,取出冷却至室温,用乙腈进行稀释后采用GC-MS对产物进行分析。在进行催化剂的循环利用实验时,以Fe-N-C-900为催化剂进行硝基苯的还原反应,反应结束后通过外磁体回收催化剂,然后用乙醇和水洗涤,最后在80 ℃ 干燥箱中干燥12 h,再将其作为硝基苯还原反应的催化剂,循环5次。
1.4 分析与表征
采用TEM对样品的形貌进行分析,点分辨率0.23 nm,测试加速电压200 kV,晶格分辨率0.14 mm。采用TEM自带的X射线能谱(EDX)分析多孔炭材料中各元素的分布。通过XRD在20~80°范围内使用40 kV的Cu Kα辐射测量多孔炭材料的微晶结构。采用XPS分析多孔炭材料表面电子态,对材料表面的元素组成和化学状态进行分析。通过BET比表面积和孔径分析仪表征材料的比表面积和孔径分布,通过BJH计算得到孔径分布曲线,测试温度为77 K。使用激光显微Raman光谱仪在波长为532 nm下表征材料的缺陷和石墨化程度。采用ICP-AES对制备的Fe-N-C催化剂中Fe的含量进行测定。采用元素分析仪对Fe-N-C催化剂中的元素含量进行分析。采用GC-MS分析底物的转化率和产物的选择性,进样口温度260 ℃,载气为高纯He,恒流模式,流速1 mL/min,不分流进样,进样量1 μL,氢离子火焰检测器,初温70 ℃,保持2 min,升温速率20 ℃/min,终温280 ℃,保持3 min。
2 结果与讨论
2.1 Fe-N-C的分析与表征
2.1.1元素分析 通过元素分析和ICP-AES测试表明Fe-N-C中主要含有碳、氮、氧和铁元素(表1),含铁量从33.37%(Fe-N-C-700)增加到43.80%(Fe-N-C-1000),而700~900 ℃制备的Fe-N-C中含氮量差别不大,当温度升高到1 000 ℃时,含氮量显著降低,这主要是由于温度过高,炭材料表面不稳定的氮物种进一步分解挥发[15]。

表1 样品中各元素的量Table 1 Content of elements in the samples
从催化剂Fe-N-C-900的TEM和EDX图(图1)中可以看出,掺杂氮和负载的金属铁均匀地分散在炭材料基体上,有利于活性位点的形成,从而提高催化活性[16]。
2.1.2XRD和Raman分析 图2(a)为不同温度下制备的Fe-N-C的XRD图。由图可知,在700 ℃的炭化温度下,Fe-N-C-700在2θ=28.4°、 37.2°、 53.5°和74.0°等处的特征峰与Fe3O4的特征峰一致[17]。但当温度进一步升高至800 ℃时,Fe3O4的主要特征峰消失,同时在44.8°和65.1°处出现归属于零价铁的特征峰,表明随着热解温度的升高催化剂中铁的主要种类由Fe3O4转变成金属铁,其中也含有少量的二价铁和三价铁。

图1 Fe-N-C-900的TEM和EDX图Fig.1 TEM and EDX mapping images of Fe-N-C-900

1.Fe-N-C-700; 2.Fe-N-C-800; 3.Fe-N-C-900; 4.Fe-N-C-1000图2 Fe-N-C的XRD(a)和拉曼光谱(b)Fig.2 XRD patterns(a) and Raman spectra(b) of Fe-N-C
Raman光谱反映了炭材料的石墨化和结构缺陷程度。由图2(b)可知,Fe-N-C的Raman光谱在1345和1595 cm-1附近出现了2个宽衍射峰,分别归属于D峰和G峰。其中,D峰体现材料的结构缺陷,而G峰与材料的有序度相关,D峰和G峰的强度比(ID/IG)可以用来衡量样品中的结构缺陷程度[18]。从图2(b)可以看出来,ID/IG值随着温度的升高而逐渐增大,从0.82到0.99,说明随着热解温度的升高产生的缺陷增多,在催化时这些缺陷可以作为活性或吸附位点[19]。
2.1.3XPS分析 为研究Fe-N-C样品中氮的存在形式随温度的变化情况,采用XPS对样品表面的氮物种进行分析,图3为不同热解温度下Fe-N-C的XPS全谱图和N1s的高分辨谱图。

1.Fe-N-C-700; 2.Fe-N-C-800; 3.Fe-N-C-900; 4.Fe-N-C-1000图3 Fe-N-C的XPS全谱图(a)和N1s的高分辨谱图(b)Fig.3 XPS survey spectra(a) and high-resolution N1s spectra(b) of Fe-N-C
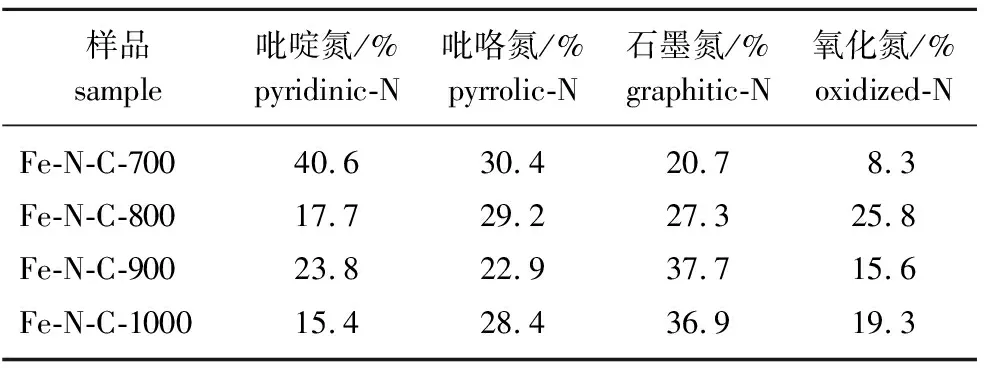
表2 Fe-N-C中不同氮物种的量Table 2 The content of different nitrogen species in Fe-N-C
对Fe-N-C催化剂的N1s峰进行分峰拟合,可以得到4个独立的分峰,分别为(398.4±0.2) eV(吡啶氮)、(400.5±0.2) eV(吡咯氮)、(401.6±0.2) eV(石墨氮)和402.8~404.3 eV(氧化氮)[20],4种氮物种含量分布情况见表2。由表2可知,在低温(700 ℃)下催化剂中主要以吡啶氮(40.6%)和吡咯氮(30.4%)为主。随着温度的升高,石墨氮的含量先增加后降低,由20.7%(Fe-N-C-700)和27.3%(Fe-N-C-800),增加到37.7%(Fe-N-C-900);而吡啶氮显著减少,说明随着温度的升高,部分吡啶氮转变为石墨氮。相关研究表明:石墨氮的掺杂可以在炭材料表面形成非均匀的电子分布,显著增强炭材料的催化活性[21]。
2.1.4比表面积和孔结构分析 为了进一步考察Fe-N-C的孔结构和比表面积,采用N2吸附/脱附曲线进行分析。如图4(a)所示,700 ℃制备的样品等温线符合I型等温线的特征。800~1 000 ℃制备的样品表现出I型和IV型结合型等温线的特征,在较低的相对压力(P/P0)区,吸附等温线有个急剧上升的趋势,当P/P0>0.4时,产生滞后回环,表明3种炭材料均存在微孔和中孔[22]。这一结论也通过图4(b)的孔径分布曲线及表3中Fe-N-C的孔隙结构参数得到进一步证实。

图4 Fe-N-C的N2吸附/脱附等温线(a)和孔径分布图(b)Fig.4 N2 adsorption/desorption isotherms(a) and pore size distribution(b) of Fe-N-C
由表3可知,当炭化温度从700 ℃升高到800 ℃时,比表面积从295 m2/g增加到529 m2/g,平均孔径和总孔容也相应地增加。Fe-N-C-700比表面积较小的原因可能是负载的Fe3O4颗粒占据了孔隙,堆积在中小型孔隙中[23]。当热解温度继续升高至900 ℃时,Fe-N-C-900的比表面积略有下降,这可能是由于在高温下炭材料的部分孔隙结构坍塌引起的。温度继续升高至1 000 ℃时,Fe-N-C-1000比表面积略有升高,可能是由于更高热解温度下,在孔隙结构坍塌的同时又有新的孔结构形成。综合分析可知,制备的催化剂Fe-N-C 是微孔和中孔并存的,微孔为硝基苯的催化还原提供活性位点,中孔可作为化学反应的通道[24]。
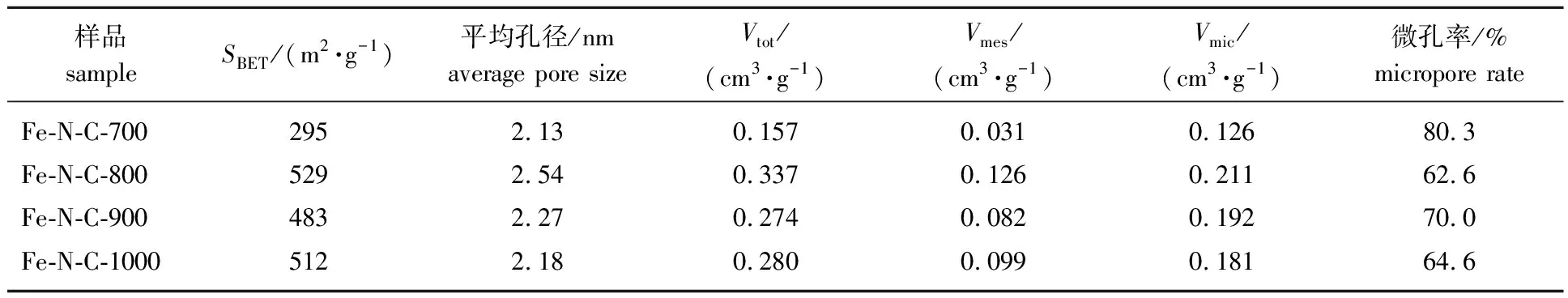
表3 Fe-N-C的比表面积和孔隙结构参数1)Table 3 Specific surface area and pore structure parameters of Fe-N-C
2.2 Fe-N-C的催化性能
2.2.1对硝基苯的催化还原性能 通过硝基苯催化还原制备苯胺的反应考察不同Fe-N-C多孔炭材料的催化性能,结果见表4。
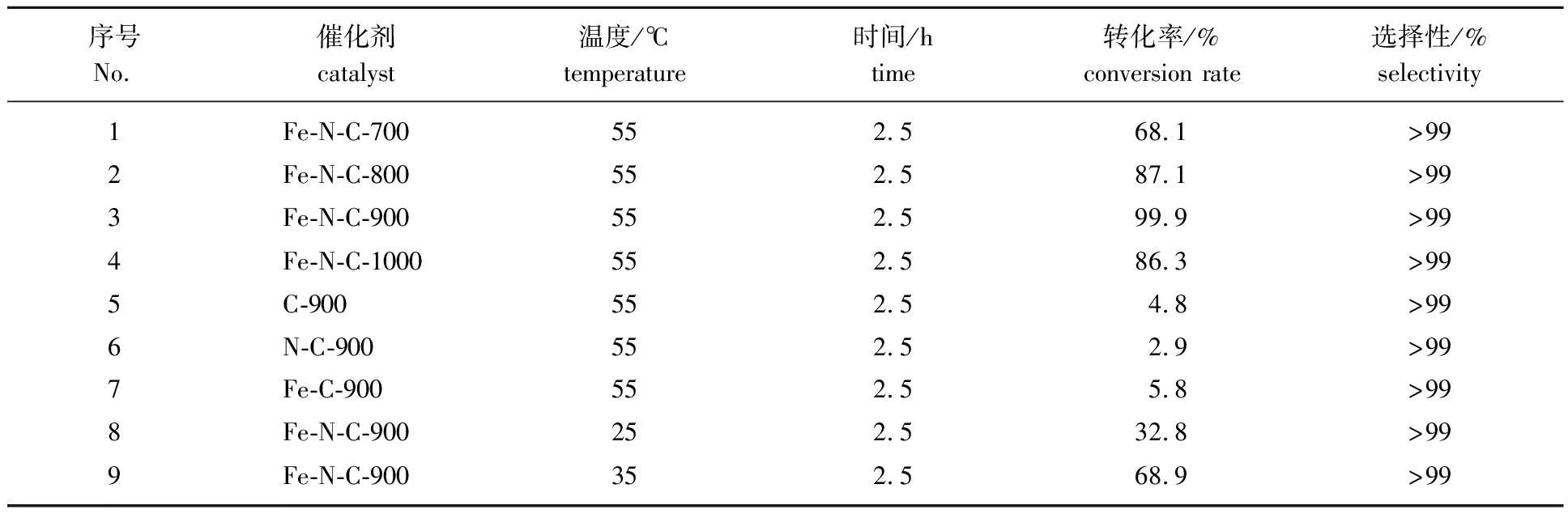
表4 不同条件下硝基苯催化还原反应的转化率和选择性Table 4 Conversion and selectivity of nitrobenzene catalytic reduction under different conditions
从表4中序号1~4的结果可以看出,当采用炭化温度为700、 800、 900和1 000 ℃下制得的Fe-N-C作为催化剂在55 ℃下反应2.5 h时,硝基苯的转化率分别为68.1%、 87.1%、 99.9%和86.3%,反应的选择性均大于99.0%。Fe-N-C-700的催化活性明显低于其他3种催化剂,这可能与Fe-N-C上的铁物种有关,Fe-N-C-700上负载的铁主要是Fe3O4,而其他3种催化剂上负载的铁主要以金属铁的形式存在,说明金属铁作为活性位点更有利于硝基苯的催化还原。Fe-N-C-900的催化活性最高,可能与该多孔炭材料掺杂氮的含量较高且石墨氮占比高有关。Fe-N-C-800的铁物种虽然也以金属铁为主,但其石墨氮含量明显低于Fe-N-C-900;Fe-N-C-1000虽然石墨氮含量也较高,但该材料掺杂氮的含量较低,导致催化性能降低。
为了进一步研究铁和氮对催化剂催化性能的影响,合成了不含铁和氮的C-900,不含铁的N-C-900和不含氮的Fe-C-900进行对比实验(No.5~7)。结果表明:这3种催化剂的催化性能都很差,转化率均不到6%。结合Fe-N-C的表征综合分析,石墨氮和金属铁都可能作为反应的活性位点共同作用,催化硝基苯的还原。而杂原子N的掺杂有利于金属颗粒的分散,分散良好的金属颗粒可以增强催化剂的活性[25]。接着对硝基苯催化还原的反应温度进行考察,当温度降低到室温25 ℃时,反应进行得很慢,反应2.5 h后硝基苯的转化率只达到32.8%,大量原料剩余(No.8)。当温度为35 ℃时,硝基苯的转化率可以达到68.9%(No.9),这主要是由于较高的反应温度有助于加快反应速率,从而提高硝基苯的转化率。
2.2.2对不同取代基硝基芳烃的催化还原性能 采用Fe-N-C-900作为催化剂,在55 ℃下催化含有不同取代基的硝基芳烃化合物的还原反应,反应转化率和选择性结果见表5。

表5 Fe-N-C-900催化还原带有不同取代基的硝基芳烃Table 5 Catalytic reduction of nitroaromatics with different substituents by Fe-N-C-900
由表可知,对于含有给电子取代基如甲基(—CH3)、氨基(—NH2)、羟基(—OH)的硝基芳烃来说,在该催化剂作用下都能顺利地转化为相应的产物氨基芳烃,转化率和选择性都很高。当硝基芳烃上含有吸电子基团如氯(—Cl)、碘(—I)时,反应2.5 h的转化率分别为63.2%和60.8%;当反应时间延长至4 h时,能够以优异的转化率和选择性得到相应产物,而未观察到采用贵金属催化剂时容易生成的脱卤素产物。由此,说明制备的Fe-N-C催化剂可以适用于不同的底物,普适性良好。
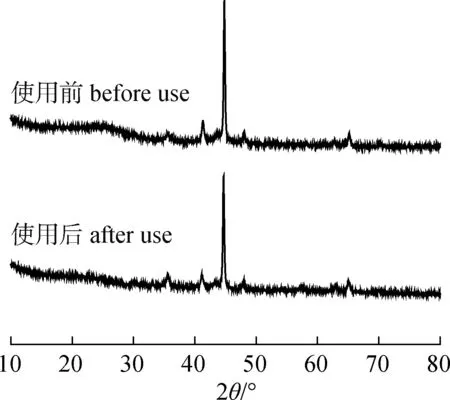
图5 循环使用前后Fe-N-C-900的XRD谱图Fig.5 XRD spectra of Fe-N-C-900 before and after recycling tests
2.3 催化剂的循环使用性能
催化剂的可回收性是多相催化反应的主要评价标准之一。由于Fe-N-C-900具有磁性,可以利用催化剂的磁性方便地对催化剂进行回收利用。Fe-N-C-900循环利用5次后,硝基苯的转化率仍达到98.3%,选择性为96.5%。对循环利用5次后的Fe-N-C-900的XRD谱图进行分析,发现其主要特征峰与反应前的催化剂一致,表明Fe-N-C-900在该催化体系中的稳定性良好(图5)。循环利用5次后,硝基苯的转化率和产物的选择性略有下降,可能是由于在分离和洗涤过程中催化剂的质量有轻微的损失。
3 结 论
通过简单地混合廉价的杉木屑、尿素和FeCl3·6H2O可以一步合成负载铁的氮掺杂多孔炭材料Fe-N-C,采用BET、XRD、XPS和元素分析等研究Fe-N-C催化剂的表面结构和元素含量随炭化温度的变化,不同温度下的催化剂对硝基苯的催化还原能力不同,结果表明:Fe-N-C-900的硝基苯催化还原性能最佳,能够以优异的转化率和选择性得到相应的氨基芳烃化合物。结合催化剂表征和硝基苯还原结果共同分析,发现可能是由于在不同温度下铁和氮物种的变化,引起催化剂活性的差异;催化剂中的金属铁和石墨氮协同作用促进硝基苯的催化还原。Fe-N-C-900简单的制备方法、良好的催化活性、底物普适性和可回收性使其具有潜在的工业应用前景。

