氧化苦参碱通过上调miR-485-5p的表达抑制宫颈癌细胞的增殖研究
铁炜炜,葛芬芬
宫颈癌的临床治疗以手术为主,但是肿瘤的复发率及转移率一直居高不下,难以防范[1]。因此,如何快速寻找到该疾病治疗与转移的分子标记和靶点至关重要,为其早期诊断及治疗提供相应的参考依据。miRNA是一类长度为单链的非编码微小RNA,其稳定性高度遗
传,主要通过其下游靶基因调控肿瘤的发生及发展[2]。有研究发现miR-485-5p的表达与多种恶性肿瘤有关,其可以作为抑癌基因参与肿瘤的侵袭转移过程中[3-5],但其在宫颈癌组织中的表达情况目前研究报道较少。本研究主要探讨宫颈癌组织中miR-485-5p的表达情况,从miRNAs的角度研究氧化苦参碱对宫颈癌细胞增殖的影响及其作用,现报道如下。
1 资料与方法
1.1 材料 实验仪器:荧光定量PCR仪(Roche480,罗氏诊断有限公司,德国);多功能酶标仪(美国BIO-RAD公司);CO2培养箱(英国RS Biotech公司);光学显微镜(德国Leica公司);恒温水浴箱(上海精宏实验设备有限公司);超净工作台(天津净化仪器厂)。实验试剂:氧化苦参碱(中国食品药品检定研究院,批号120609-202114);DMEM培养基(美国Gibco公司,批号21225155);MTT(美国Solarbio公司,批号M8219);双荧光素酶检测试剂盒(美国Promega公司,批号9FB325);反转录试剂盒(美国Thermo公司,批号K1654);Cyclin D1多克隆抗体(武汉博士德)。胎牛血清培养基(美国Sciencell公司,批号0507)。实验菌株:实验组为人宫颈鳞癌细胞株Siha(HPV 16+)(武汉博士德生物工程有限公司);对照组为正常宫颈上皮组织细胞,收集于2021年1—5月宁波市医疗中心李惠利医院子宫肌瘤摘除的新鲜子宫组织常规培养后所得。
1.2 方法
1.2.1 最适药物浓度检测 将Siha(HPV16+)细胞以5×103/ml接种到96孔板中,每孔加入100 l含有10%胎牛血清的培养基,24 h后观察细胞状态,同时加入不同浓度的氧化苦参碱(5、25、50、100、200 mol/L),同时设立空白对照。反应24 h后,每孔加入50 l MTT液继续反应2 h,酶标仪检测490 nm处每孔的吸光度,每孔重复测3次。
1.2.2 miRNAs表达量的检测 培养Siha(HPV16+)细胞系,提取各细胞的总RNA,逆转录后应用Real-Time PCR分别检测各细胞内mi R-126、mi R-485-5p及miR-30a的表达量,每孔重复测3次。
1.2.3 宫颈癌细胞株及宫颈上皮组织中Cyclin D1的表达检测 培养Siha(HPV 16+)细胞,收集细胞后,提取总蛋白,等量上样,SDS-PAGE电泳分离后转膜,封闭后分别孵育一抗、二抗,ECL发光检测,分析Cyclin D1的相对表达量,同时检测蛋白的灰度值。
1.3 统计方法 采用SPSS 21.0统计软件进行分析,计量资料以均数±标准差表示,采用 检验。<0.05为差异有统计学意义。
2 结果
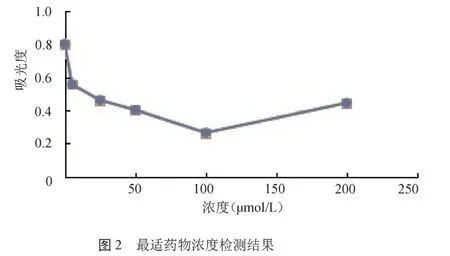
2.1 最适药物浓度检测结果 通过MTT的实验结果显示,在100 mol/L浓度时,其吸光度值最小,此浓度下对细胞的抑制效果最佳,故将此浓度设为最佳浓度,供后续实验使用。见封四彩图2。
2.2 两组miRNAs表达情况比较 实验组miR-485-5p表达水平明显下调,而两组miR-126及miR-30a表达水平差异均无统计学意义(均>0.05),见表1。
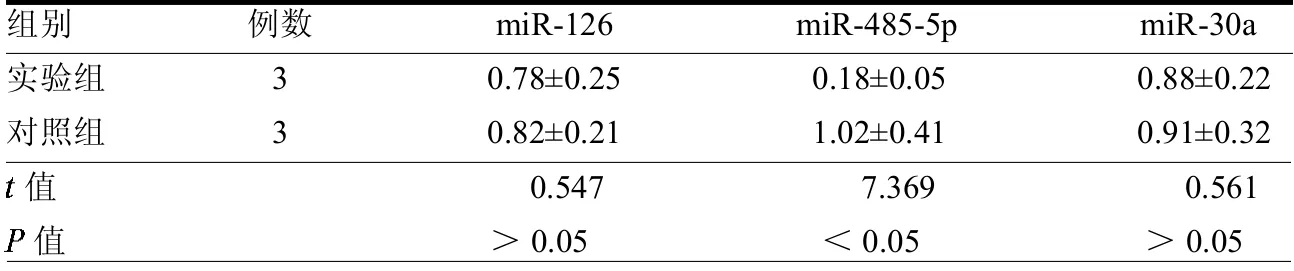
表1 两组miRNAs表达情况比较
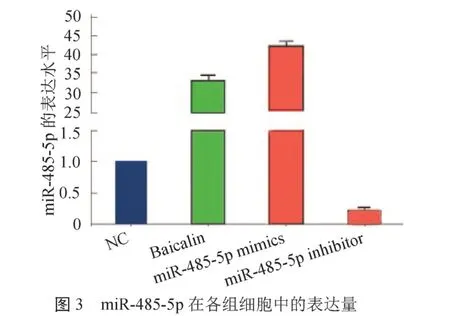
2.3 miR-485-5p的表达水平 与对照组相比,氧化苦参碱刺激细胞后,miR-485-5p的表达水平上调,miR-485-5p mimics转染细胞后,miR-485-5p明显升高,且升高幅度大于氧化苦参碱刺激后的水平;用miR-485-5p inhibitor转染细胞后,miR-485-5p表达量下调。见封四彩图3。
2.4 宫颈癌细胞株及宫颈上皮组织中Cyclin D1的表达结果 Western blot结果显示氧化苦参碱或miR-485-5p mimics处理人宫颈鳞癌细胞株Siha(HPV 16+)细胞后,Cyclin D1蛋白的条带变淡;mi R-485-5p inhibitor转染细胞后,Cyclin D1蛋白条带加深。
3 讨论
临床研究发现宫颈癌病变可能与患者的HPV感染、多孕及多产等多种因素密切相关[6],且研究发现宫颈癌组织中多存在多种基因的过表达情况[7]。相关研究在宫颈癌细胞株Siha上检测miRNA221的表达,研究其与肿瘤细胞侵袭转移行为间的关系,结果发现miRNA221在宫颈癌细胞株Siha中扮演促癌因子的作用。因此本研究先将不同浓度的氧化苦参碱作用于宫颈鳞癌细胞株Siha(HPV16+),应用MTT检测细胞的增殖情况,筛选最佳药物浓度。结果发现在100 mol/L浓度时吸光度最低,说明氧化苦参碱对Siha(HPV16+)细胞株增值具有明显的抑制作用,而且在100 mol/L浓度时细胞被抑制的程度接近最大值,因此将100 mol/L设为最适浓度,作为后续实验的处理浓度。
有研究发现Cyclin D1蛋白对患者体内的细胞周期具有一定的调节作用,其可以对肿瘤细胞的分化、增殖产生促进作用,延缓患者肿瘤细胞凋亡进程[8],进而对患者体内癌细胞的转移起到促进作用,导致患者的病情快速发展。宫颈癌患者肿瘤组织内多存在Pin1和Cyclin D1过表达现象,对肿瘤细胞的分化增殖具有重要作用[9]。有研究结果显示苦参碱对肿瘤的抵抗效果较为明显[10],苦参碱由中药苦参中提取的一种具有抗炎及抗病毒作用的生物碱。而大量研究显示,苦参碱具有良好的抗肿瘤作用[11];还有研究发现其除了上述作用外还具有抑制肿瘤细胞的转移,并加速肿瘤细胞凋亡的作用[12]。苦参碱对肿瘤的临床治疗效果较为显著,但关于其作用机制研究较少。因此本研究观察了苦参碱对宫颈癌细胞株和宫颈上皮组织中Cyclin D1表达的影响,以期对宫颈癌的临床治疗起到帮助。
本研究结果显示氧化苦参碱或miR-485-5p mimics处理人宫颈鳞癌细胞株Siha(HPV 16+)细胞后,Cyclin D1蛋白的条带变淡;miR-485-5p inhibitor转染细胞后,Cyclin D1蛋白条带加深。这说明氧化苦参碱处理宫颈癌菌株后可以抑制Cyclin D1表达,进而可以抑制宫颈癌细胞的增殖。临床研究发现miRNAs对基因的转录后表达调控具有极其重要的作用。目前随着研究的进一步深入,已经在人体中发现了接近700多种miRNAs,miRNAs主要是参与人体内的基因表达过程,但是关于其作用的机制目前尚不明确。相关研究发现在人体恶性肿瘤的发生及发展与miRNAs的异常调控具有一定的关联性[13-14],已经在乳腺癌、前列腺癌及肝癌等多种肿瘤中发现了miRNAs的异常表达[15-16]。本研究结果显示实验组中miR-485-5p在Siha(HPV16+)细胞中呈明显下调,而miR-126及miR-30a的表达无明显差异。这说明miR-485-5p的表达下降跟宫颈癌细胞的增值有关,使用氧化苦参碱处理后miR-485-5p的表达有所上升,说明氧化苦参碱可以通过上调miR-485-5p表达进而抑制宫颈癌细胞的增值。

