肠道菌群失调在糖尿病肾病发病机制中的作用研究进展
王 汉,王敦方,宋红新,马旭冉,苗金雪,李 佳,杨伟鹏,王海南
(1. 长春中医药大学中医学院,吉林 长春 130117;2. 中国中医科学院中药研究所,北京 100700;3. 清华大学医院,北京100084;4.国家药品监督管理局,北京 100053)
糖尿病肾病(diabetic nephropathy,DN)是由糖尿病所致的慢性肾脏疾病(chronic kidney disease,CKD),是糖尿病的主要微血管并发症之一,也是世界范围内终末期肾病(end-stage renal disease,ESRD)最常见的病因[1]。流行病学研究表明,全球糖尿病人数共计4.25 亿人,如果不加干预,到2045年全球糖尿病患者人数将上升至6.29 亿人[2]。随着糖尿病的流行,DN 的发病率呈快速增长趋势。大约30%~40%的糖尿病患者发展为DN,三分之一的患者进一步发展为ESRD,给社会带来了巨大的经济负担。
DN 的发病机制至今尚未完全阐明。目前认为其与长期的高血糖、糖基化终末产物、氧化应激、多元醇通路、蛋白激酶C 活性增高等途径相关,同时遗传易感性和环境因素也发挥着重要作用,最终导致肾脏结构和功能的变化,引起DN 的发生和发展。近年来研究表明,肠道菌群失衡是肥胖、胰岛素抵抗、糖尿病、肠道疾病及心血管等多种代谢性疾病的直接诱因[3]。最近人们认识到,肠道菌群的变化在DN 的发生发展中也可能起到了重要作用,但具体机制尚未明确,而针对肠道菌群的治疗方法被认为是防治DN 策略的新途径。因此,探究肠道菌群在DN 发病机制中的作用及探寻以肠道菌群为靶点的治疗策略,具有重要的科学价值。
1 DN 患者与健康人群肠道菌群的差异
DN 患者存在肠道菌群失调[4,5],实时荧光定量PCR、16S rRNA基因高通量测序等技术可以深入地研究DN 患者的肠道菌群结构。Tao 等[6]研究分析了经活检证实的DN、无肾脏疾病的2 型糖尿病(type 2 diabetes mellitus,T2DM)和健康患者的肠道菌群,发现三者之间肠道菌群的组成、相对丰度存在显著性差异。在属水平上,与DM 患者相比较,DN 患 者Escherichia shigella明 显 升 高,Prevotella明显下降。从而证明了肠道菌群可能参与了DM 到DN 的发展,并且通过检测粪便中Escherichia shigella与Prevotella的比例,可以将DN 从DM 患者 中区别开来,这可能有助于DN 的临床诊断[6]。Salguero等[7]通过同样的方法对DN(4 期~5 期)患者肠道菌群进行分析,与健康对照患者相比,DN 患者革兰氏阴性菌门(Proteobacteria,Verrucomicrobia和Fusobacteria)丰度显著增加。研究人员在不同的DN动物模型(rat,mice)粪便样本中研究发现Bacteriodetes/Firmicute 比 例 增 加[8,9],这 与1 型 糖 尿 病 儿童[10]和T2DM[11]患者研究数据相似。此外,Bacteriodetes 丰度的增加和Firmicute 丰度的减少也被证明与血糖和肥胖密切相关[11,12],但是本结论却存在争议。研究发现DN 患者粪便样本中Firmicute 丰度降低,关联分析也表明Firmicute 与空腹血糖(FBG)、糖化血红蛋白(HbA1c)及尿白蛋白肌酐比值(UACR)呈显著负相关,但是未发现Bacteriodetes 丰度有明显的升高[6]。另外,一些益生菌(Lactobacillus和Bifidobacterium)在DN 患者肠道中相对丰度降低,并且其相对丰度与蛋白尿严重程度呈负相关[5]。
除此之外,DN 患者体内可以检测出大量的有害细菌代谢物,而有益代谢物降低。由此可以推测,DN 患者肠道菌群变化为有害代谢细菌类群的增殖和有益代谢细菌类群的减少,具体表现为产生短链脂肪酸(short-chain fatty acids,SCFAs)菌群减少,促进内毒素、氧化三甲胺(trimethylamine-N-oxide,TMAO)、硫酸吲哚酚(indoxyl sulfate,IS)和对甲酚硫酸盐(p-cresol Sulfate,PCS)等有害物质生成的细菌类群的扩大[4]。
2 肠道菌群对DN 发生发展的介导作用
“微生物-肠-肾轴”理论阐明了肠道菌群结构与功能、肠道黏膜屏障与肾脏在物质代谢、免疫及炎性反应等多方面存在的紧密联系[13]。DN 患者肠道菌群组成和功能发生改变,破坏了肠上皮屏障,肠道微生物产生的有毒代谢物增加,引起了慢性炎症、血流动力变化、能量失衡、糖脂代谢紊乱和血管内皮损伤等,加重了肾脏疾病的进展(表1)。由于DN 患者肾小球滤过率下降,体内大量的代谢废物无法经肾脏排泄而堆积,经肠壁进入肠腔,导致肠道环境发生改变,进一步又加重了肠道菌群失调[14]。因此,DN 和肠道菌群失调相互影响、互相调控,这种关系使机体处于恶性循环中。

表1 肠道菌群代谢在DN 发病机制中的作用Tab 1 The role of gut microbiota metabolism in the pathogenesis of diabetic nephropathy
2.1 内毒素与慢性炎症
脂多糖(lipopolysaccharide,LPS)亦称内毒素,是革兰氏阴性菌外膜的成分,在体内能激发多种炎症反应。在DN 患者及动物模型血液中可以检测到内毒素,是由于“肠漏”导致的LPS 通过小肠黏膜的紧密连接处进入血液循环[23]。在肾脏中,细胞表面模式受体Toll 样受体2(toll-like receptor 2,TLR2)和TLR4 的调控已参与了DN 中炎症的发病机制。越来越多的证据表明,LPS 在宿主体内引起的肾脏炎 症 反 应 是 通 过TLR2/4 相 关 通 路 介 导 的[24,25](图1)。LPS 与TLRs 受体结合激活MyD88/NF-κB 信号通路,产生促炎细胞因子如肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)增加肾脏组织炎症。TLRs 的激活也促进转化生长因子-β(TGF-β)的分泌,介导了肾系膜细胞的增殖、肾小球硬化和间质的纤维化[26]。在TLR2 受体基因缺陷的1 型DN 小鼠模型中,肾脏MyD88 信号通路减弱,蛋白尿、足细胞和肾小管损伤、巨噬细胞积聚和促炎细胞因子减少[27]。另 一 项 关 于1 型DN 的 研 究 表 明,在 缺 乏TLR4 受体的小鼠,肾脏NF-κB 激活减少,可免受蛋白尿、系膜扩张、肾小球硬化和肾功能丧失的影响[28]。牙龈卟啉单胞菌(Porphyromonas gingivalis)是引起牙周炎的主要微生物,其外膜成分脂多糖(Pg-LPS)与肾小球内皮细胞TLRs 受体结合,可导致1 型糖尿病小鼠和高脂饮食诱导的T2DM 小鼠发展为DN,引起肾小球1 型胶原纤维(type 1 collagen)蛋白的表达、蛋白尿、SCr、BUN 的升高,并降低糖尿病鼠的存活率[26,29]。因此,LPS 破坏肠黏膜屏障与肾脏TLRs 受体结合激活NF-κB 信号通路是肠道菌群介导DN 的炎症机制。
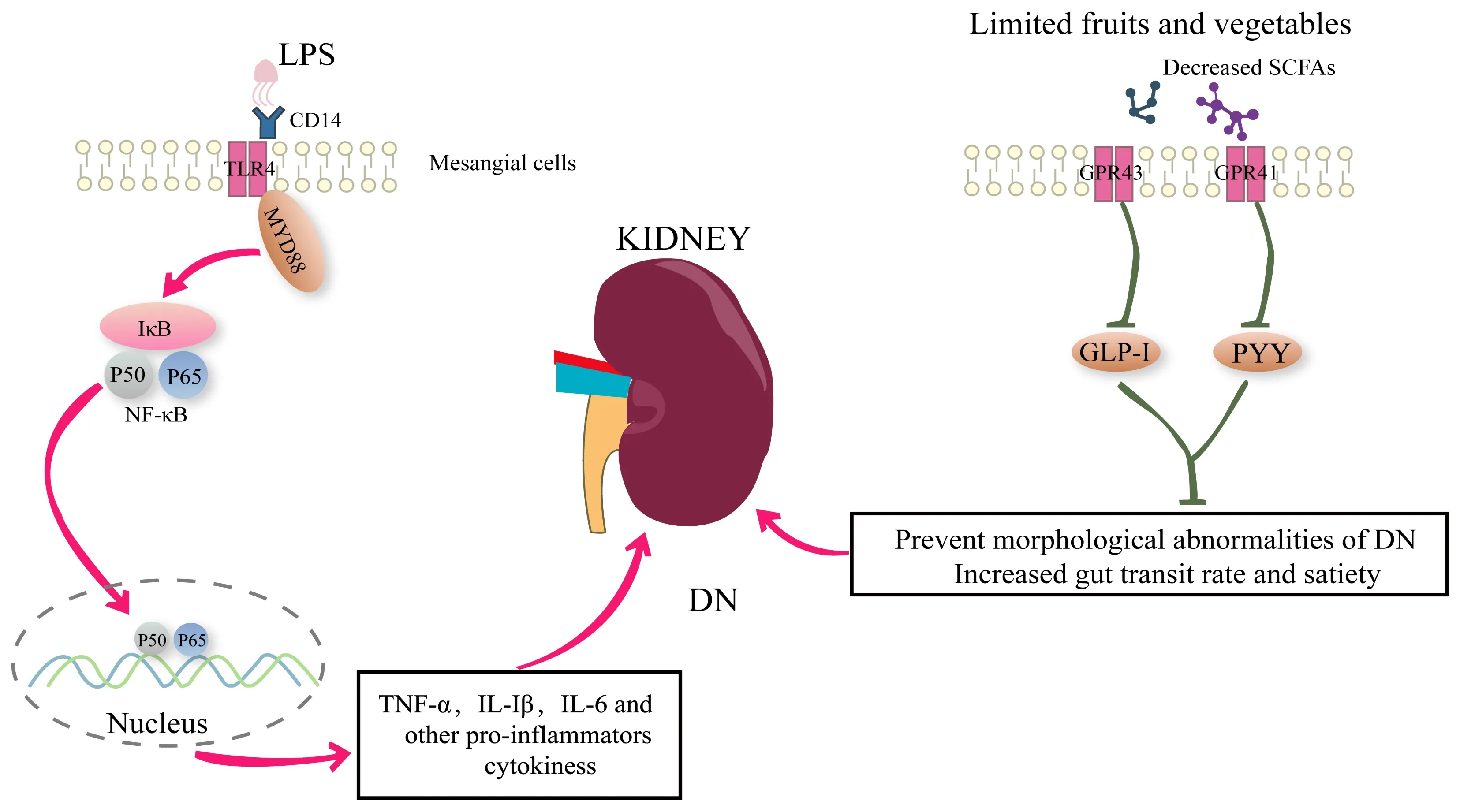
图1 炎症反应和SCFAs 减少在DN 进展中起关键作用Fig 1 The inflammatory responses and decreased short-chain fatty acids play a critical role in the progression of diabetic nephropathy
2.2 短链脂肪酸与能量平衡
短链脂肪酸(SCFAs)是肠道微生物群通过发酵宿主不能消化吸收的膳食多糖而产生,其不仅是肠道菌群维持肠道免疫的介质,而且作为信号分子,可被游离脂肪酸受体2(free fatty acid receptor,FFAR2)(是一种G 蛋白偶联受体,也称为GPR43)和游离脂肪酸受体3(FFAR3,也称为GPR41)识别并激活体内信号通路,对调节宿主能量代谢和葡萄糖稳态具有重要作用[15]。DN 患者为了防止高血糖和高钾血症,长时间限制了食用含糖和富含钾的食物,包括水果和蔬菜。由于水果和蔬菜是发酵成SCFAs 的主要来源,限制这些食物的摄入减少了SCFAs 的生成,从而也影响了DN 的进展[27](图1)。SCFAs 可激活肠上皮细胞GPR41 受体导致肠道激素肽YY(peptide YY)的释放,增加肠道转运率和饱腹感。激活GPR43 受体可减轻炎症反应,刺激L细胞释放胰高糖素样肽-1(glucagon-like peptide 1,GLP-1)[30]。GLP-1 可调节胃排空,控制食欲,促进胰腺β 细胞的存活和增殖,刺激胰岛素的分泌。临床研究表明,GLP-1 受体激动剂可改善DN 患者胰岛功能,并降低血压、血脂、炎症及减少体重[31]。基于肠促胰素的药物治疗不仅能抑制DN 患者肾小管钠的重吸收,还能降低肾小球高压和蛋白尿,从而预防肾脏形态学异常[32]。另外,最近研究发现,SCFAs 尚有抗炎、抗氧化,保护肾脏损伤的作用。Huang 等[33]通 过 体 外 实 验 观 察 了SCFAs 对 高 糖 和LPS 诱导的肾小球系膜细胞(glomerular mesangial cells,GMCs)的 影 响,发 现SCFAs 能 明 显 抑 制GMCs 的 增 殖,减 少ROS 的 产 生,提 高MAD 和SOD 的 水 平,降 低 了ICAM-1、MCP-1 及IL-1β 释放。结果也证明了SCFAs 可以抑制高糖和LPS 诱导的GMCs 氧化应激和炎症反应。
2.3 胆汁酸与糖脂代谢
胆汁酸(bile acids,BAs)是以胆固醇为原料在肝脏经一系列酶促反应合成,肠道菌群对于BAs 的转化必不可少。在肠道菌群的作用下,初级胆汁酸7ɑ-羟基脱氧后生产次级胆汁酸,即脱氧胆酸和石胆酸[34]。肠道菌群通过BAs 受体法尼醇X 受体(farnesoid X receptor,FXR)及G 蛋白偶联BAs 受体(Gprotein-coupled bile acid receptor, Gpbar1,即TGR5)在BAs 合成、脂类代谢和葡萄糖稳态方面发挥重要的调节作用[35]。FXR 在肠道和肾脏中均具有较高的表达水平,并且能够被初级胆汁酸激活。既往研究已被证明,FXR 能负性调控DN 的发生发展[36]。FXR 激动剂能够减少高脂诱导的C57BL/6J小鼠肾小球硬化,小管间质纤维化及蛋白尿。在肾小球系膜细胞中,过表达FXR 或给予FXR 激动剂治疗同样能够抑制固醇调节元件结合蛋白-1(sterol regulatory element-binding protein-1,SREBP-1)及其它脂肪相关基因,提示FXR 可能在调节肾脏脂代谢和炎症、纤维化方面发挥作用,而FXR 敲除小鼠表现出加重的肾脏损伤[37]。与FXR 相反,石胆酸和脱氧胆酸等次级胆汁酸是TGR5 的配体,它们会与小肠L 细胞的TGR5 结合,激活胞内cAMP 途径、刺激GLP-1 分泌,促进糖代谢[38]。Thomas 等[39]研究证实TGR5 受体缺乏的小鼠糖耐量受损,而TGR5过表达的小鼠则GLP-1 及胰岛素分泌增加,糖耐量改善。给予肥胖小鼠TGR5 激动剂可以增加其GLP-1 的分泌,提高胰岛素敏感性。因此,肠道菌群通过BAs 代谢和FXR/TGR5 信号转导途径,调控DN 的发生与发展。
2.4 短链脂肪酸/硫酸吲哚酚/对甲酚硫酸盐与肾素-血管紧张素系统
肾脏血流动力学异常是DN 早期的重要特点,表现为肾小球高灌注状态。在糖尿病环境中,高血糖可能激活肾素-血管紧张素系统(renin-angiotensin-system,RAS),导致肾小球微循环的自我调节受损,从而导致肾血流量增加和肾小球内高压[40]。在这个复杂的过程中,肾素在肾小球旁器的释放起着重 要 信 号 机 制。Pluznick 等[16]研 究 发 现SCFAs 中的丙酸可与肾小球旁器嗅觉感受器受体(olfactory receptor 78,Olfr78)结合减少肾素的分泌从而降低血压,而经过抗生素治疗和Olfr78-/-小鼠发现降压作用减弱,证明了肠道菌群通过SCFAs 与Olfr78 受体结合是减少肾素分泌的信号转导机制。作为RAS的主要效应物,血管紧张素Ⅱ(angiotensin-Ⅱ,AngⅡ)是血管紧张素Ⅰ(AngⅠ)经血管紧张素转换酶(ACE)酶解后形成的一种强效血管收缩剂,是该系统的主要效应肽。研究表明,丁酸作为肠道微生物群发酵复杂碳水化合物终产物,可以降低Ang Ⅱ诱导的SD 大鼠高血压,同时改善AngⅡ介导的肾损伤,包括尿蛋白、肾小球硬化和肾纤维化及炎症因子等[41]。相反,肠道菌群发酵的尿毒症毒素IS 和PCS 可作为RAS 的刺激因子,激活RAS/TGF-β 信号通路导致肾脏纤维化,经动物实验证明,用氯沙坦阻断RAS 可以显著降低IS 和PCS 引起的肾小球硬化的严重程度[42]。该研究说明了肠道菌群参与了肾脏RAS 的激活导致了肾脏血流动力学的变化,介导了DN 的发展。
2.5 氧化三甲胺与血管损伤
研究证实,与不合并DN 的糖尿病患者相比,DN 患者死亡率更高,且大部分死亡是由于心血管疾病(cardiovascular disease,CVD)导致[43]。糖尿病引起的血管并发症,除了高糖引起的糖基化终末产物(AGEs)、氧化应激、脂代谢紊乱、高血压等经典机制外,氧化三甲胺(trimethylamine-N-oxide,TMAO)的重要性也受到了广泛关注[18]。Wang等[44]利用代谢组学方法对2 000 多种化合物进行筛选发现TMAO、胆碱和甜菜碱(一种TMAO 前体)与CVD 风险和动脉粥样硬化的进展相关。检测血浆TMAO 的浓度可作为CKD 患者冠状动脉粥样硬化、CVD 和死亡率的预测因子[45]。TMAO 可以通过增加动脉粥样硬化前清除受体分化抗原36(CD36)和清道夫受体A(SRA)的表达,造成胆固醇在细胞内的堆积。同时TMAO 能降低胆汁酸合成胆固醇7α-羟化酶(cholesterol 7-alpha-hydroxylase,CYP7A1)的表达,从而抑制胆固醇的转运,造成胆固醇在细胞内的堆积和泡沫细胞的形成,从而成为动脉粥样硬化和CVD 的风险因素[44]。另外,TMAO 可 通 过 肾 脏 清 除,在ESRD[46]和3~4 期CKD[47]患者中检测到血清TMAO 浓度升高。最近也被证明TMAO 与CKD 患者的肾脏功能和炎症相关[48]。在动物膳食中添加TMAO 或其前体胆碱成分使血清TMAO 浓度升高,可导致肾小管间质纤维化、胶原蛋白沉积、Smad3 磷酸化,使肾功能进行性损伤[49]。将CKD 患者的粪便样本移植到无菌小鼠体内同样也增加了血清TMAO 的浓度,并且对小鼠进行抗生素处理后可以防止胆碱引起的TMAO 升高而导致的动脉粥样硬化[47]。以上研究表明,动脉粥样硬化的发生发展与依赖于肠道菌群代谢的食源性磷脂酰胆碱存在一定的关系,并且参与了DN 及CVD 的进展。
3 以肠道菌群为靶点治疗DN 的新方法
上文综述了肠道菌群在DN 的发生、发展过程具有重要的作用。以肠道菌群为靶点,采用益生菌、益生元或粪菌移植对肠道菌群进行靶向性的调节有望成为预防、治疗DN 的有效方法。
3.1 益生菌与益生元
益生菌是在临床试验中已被证实对人体健康有益的、作为食物添加成分的活菌。而益生元则是指能够在人体内被肠道菌群利用、激发有益菌(包括益生菌)的生长和代谢的食物成分。Abbasi 等[50]研究发现添加植物乳杆菌A7 的益生菌豆浆可以改善DN 患者肾功能,包括尿蛋白、SCr 和eGFR,对DN 新型标志物(肿瘤坏死因子受体1、胱抑素C)也有显著性降低,可能是益生菌豆浆改善了肾脏氧化应激所致。在3~4 期DN 患者中,使用混合细菌(嗜酸乳杆菌KB27、双歧杆菌KB31 和嗜热链球菌KB19)治疗6 个月,降低了BUN 和UA 水平[51]。在ESRD 患者使用益生菌也有一定的益处,在ESRD患者接受血液透析时服用益生菌[52]或富含纤维的食物[53],可以减少血清PCS 的生成。而在一项健康志愿者的临床试验中,初步数据也已经证明了一种富含益生元纤维(大麦β-葡聚糖)的功能性食品能够调节肠道菌群组成和代谢[54]。此外,大麦β-葡聚糖能够增加粪便SCFAs 水平,并降低循环中PCS 水平[55],这表明大麦β-葡聚糖能够诱导由糖分解细菌驱动的肠道新陈代谢。这些数据表明,益生菌和益生元的存在改变了肠菌代谢,促进了含氮物质的利用及排出,从而减少了尿毒症毒素的积累。以益生菌和/或益生元为靶点的治疗可能有助于延缓DN的进展。
3.2 粪菌移植
粪 菌 移 植(fecal microbiota transplantation,FMT)作为重建肠道菌群的最有效手段,被认为是近年来突破性医学进展[56,57]。现已被证明FMT 能够有效治疗复发性、难治性艰难梭菌感染,同时也可应用在代谢紊乱等疾病的治疗中[58]。目前,FMT与DN 的相关性研究较少,多集中在肥胖、糖尿病、ESRD 动物模型及少部分患者。研究结果显示,将链脲佐菌素(streptozocin,STZ)诱导的DN 小鼠行FMT 治疗后,肠道中SCFAs 含量增加,降低了24 h尿总蛋白(24-UP)、SCr、BUN 水平,提示了肠道菌群对DN 小鼠的肾脏功能有调节作用,机制可能是经FMT 治疗后增加了产生SCFAs 的特定菌有关[59]。Hu 等[60]通 过 体 内 与 体 外 实 验 证 明 了FMT可以有效降低DN 模型大鼠血清乙酸水平,减少GPR43 激活介导的胆固醇稳态失调,从而减轻了肾小管的间质损伤,保护肾脏。Wang 等[61]通过FMT对STZ 诱导的T2DM 模型小鼠进行研究,治疗8 周后小鼠FBG、HbA1c 及胰腺内炎症因子IL-6 的水平明显降低,改善了胰岛β 细胞功能及IR。文献报道我国哈萨克族人民T2DM 患病率为1.56%,明显低于其他民族[62]。研究者将哈萨克族健康个体的肠道菌群移植到db/db 小鼠中,连续灌胃2 周后,通过荧光检测发现哈萨克族健康个体菌群就已经在db/db 小鼠肠道中定殖,经FMT 处理db/db 小鼠10 周后,检测FBG、2hBG、TG 等代谢指标得到改善,同时db/db 小鼠肠道中糖尿病相关菌脱硫弧菌(Desulfovibrio)和球形梭菌(Clostridium coccoides)水平明显降低[63],提示了来自哈萨克族健康个体的粪便细菌可能用于临床治疗糖尿病。以上研究,为FMT治疗DN 打开了新的视窗,其发挥作用的关键就是依靠整体菌群。
4 小结与展望
随着高通量测序技术和其他系统生物学技术的快速发展,获得微生物全基因组序列日渐变得容易,DN 与肠道微生物的关系也不断被揭示。关于肠道菌群影响DN 的机制主要是经过来源于细胞壁成分LPS 及其代谢产物SCFAs、TMAO、IS、PCS等发挥作用的。然而,肠道菌群结构和功能的变化在DN 的发病机制中的作用尚未完全明晰,现有研究着重于探索微生物群丰度的变化,即“多或少”的影响,并没有遵循“科赫法则”的框架进行“验明正身”。目前,DM 和ESRD 与肠道菌群的研究日益增多,DN 作为DM 发展为ESRD 的中间阶段往往被忽略,研究较少。在未来,无论在动物研究亦或临床试验研究,有必要探究从DM-DN-ESRD 发展过程中肠道菌群具体变化及扮演的角色,从而才能针对肠道菌群优化治疗方案,阻止疾病进展。
作者贡献度说明
王汉为本文主要撰写者;王敦方和宋红新负责文献查阅和部分内容的撰写;马旭冉和苗金雪进行了绘图;李佳对文章提出了修改意见;杨伟鹏和王海南提出本文的思路并对文章进行了审核及修改。

