清肝活血方治疗酒精性肝硬化湿热瘀结证的随机对照临床试验
潘洁露,邢练军,张 济,喻 晓,张海燕
(上海中医药大学附属龙华医院脾胃病二科,上海 200032)
酒精性肝硬化(alcoholic liver cirrhosis,ALC)是指以长期饮酒或短期大量饮酒引起的肝损害和门静脉高压症的肝硬化,是酒精性肝病(alcoholic liver disease,ALD)的良性终末阶段[1,2]。在多年酗酒的患者中,大约有20%~25%的患者开始脂肪变性,发展为纤维化、肝硬化[3]。有证据显示,ALD 患者肝穿刺提示脂肪性肝炎的患者中有肝纤维化和肝硬化的比例分别是20%~40% 和8%~20%[4]。世卫组织(World Health Organization,WHO)研究报告显示,全球大约三百三十万死亡病例与饮酒有关,占到肝病死亡总人数的6%,50%肝硬化患者的危险因素是酒精滥用[1]。ALD 已成为我国最主要的慢性肝病之一[5]。
由于早期ALC 肝脏仍具有代偿功能,因此缺乏特异性的临床症状,或仅有乏力,食欲不振,右上腹胀等表现,易被忽略。随着疾病进一步发展,至晚期逐渐累及多个器官,出现消化道出血、肝性脑病、腹水、肝肾综合征甚至癌症等并发症。目前ALC 的治疗方案仍不完善,禁酒和营养支持仍是最基本最重要治疗手段。患者治疗后仍存在肝炎和纤维化,尚缺乏严格的抗炎和肝保护药物的临床试验数据。近年来无创肝功能评级已获得越来越多的关注和认可。无创性瞬时弹性成像(transient elasography,TE)技术FibroTouch 检测肝硬度测量值(liver stiffness measurement,LSM)来诊断和评估肝纤维化和肝硬化已广泛运用于临床[6]。
本课题组在结合临证和文献研究的基础上,首倡“湿热瘀血为患”是ALD 的基本病机[7]。其基于中药经方小柴胡汤长于疏肝和胃,乏于活血功效,故课题组以清肝利湿、活血散结为法,拟定清肝活血方(Qing Gan Huo Xue Prescription,QGHXP)。全方由柴胡、黄芩、丹参、鳖甲、葛根组成,在临床运用于ALD 治疗已逾20 年[7,8]。前期实验研究表明,QGHXP 具有较好的治疗酒精性肝纤维化的作用[9-11]。课题组为进一步探究QGHXP 用于ALC 治疗的临床疗效,采用随机对照的方法,以无创肝功能评估方法用于ALC 疗效的评估。
1 资料与方法
1.1 病例选择
自2019 年6 月1 日~9 月31 日于上海中医药大学附属龙华医院脾胃病二科门诊经诊断为ALC 且中医辨证为湿热瘀结证的患者。
1.2 诊断标准
西医临床诊断标准:参照《酒精性肝病防治指南(2018 年更新版)》[5]所制定的ALD 诊断标准:(1)有长期饮酒史,一般5 年以上,男性≥40 g/d,女性≥20 g/d;或两周内有大量饮酒史,乙醇量>80 g/d。应注意性别、遗传易感性等因素的影响。乙醇量(g)换算公式=饮酒量(mL)×乙醇含量(%)×0.8;(2)临床症状为非特异性,无症状或右上腹胀大,厌食,乏力,体重减轻,黄疸等;随着疾病的加重,出现神经心理症状,蜘蛛痣,肝掌等表现;(3)血清AST、ALT、γ-GT、TBil、PT、平均红细胞容积(MCV)和缺糖转铁蛋白(CDT)等指标升高;(4)肝脏B 型超声、CT、MRI 或瞬时弹性成像检查有典型表现;(5)排除其他肝脏疾病。符合第1 项,排除其他肝病原因,并符合与第3 和第4 项,可诊断为ALD;其中ALC 诊断标准:临床表现为肝硬化,血清生化指标,瞬时弹性成像和影像学改变。
中医症候诊断标准:参照2018 年《中药新药临床研究指导原则》[12]湿热瘀结证参考以及《肝纤维化中西医结合诊疗共识意见》[13]:
肝胆湿热证主症:(1)口干苦或口臭;(2)胁胀或痛;(3)大便黏滞秽臭或大便不爽。次症:(1)纳呆;(2)胃脘胀闷;(3)倦怠乏力;(4)皮肤巩膜黄染。舌脉:舌质红、苔黄腻、脉弦数或弦滑数。
痰瘀互结证主症:(1)面色晦暗;(2)体态肥胖;(3)纳呆口渴。次症:(1)呕恶痰涎;(2)右胁下肿块,刺痛或钝痛,推之不移。舌脉:舌体胖大,边有齿痕或舌质黯有瘀斑,脉弦滑或弦涩。”两者的诊断标准制定,具备主症3 项及以上和次症1 或2 项,可诊断为相应证型。
1.2.1 纳入标准 (1)年龄18~65 岁;(2)符合中西医ALC 诊断标准;(3)1 周内未服用相关药物者;(4)否认高血压病、糖尿病、心脑血管疾病等需要长期服用各类西药者;(5)研究期间无怀孕计划及产后非哺乳期间者;(6)精神、智力正常可配合本次研究者;(7)知情同意并愿意接受本次治疗方案。
1.2.2 排除标准 (1)合并乙、丙型肝炎等其他肝脏病;(2)观察期间同时参与其他临床研究或使用了其他治疗方案者;(3)观察期间自行使用其他药物者;(4)未完成随访,或因其他原因退出治疗者;(5)研究期间合并较为严重的心脑血管疾病,造血系统及精神类疾病的病例;(6)观察期间怀孕的妇女;(7)自身免疫性肝病、糖尿病内分泌性脂肪肝、药物性肝病、中毒性肝炎、肝恶性肿瘤、非酒精性脂肪肝、肝肾衰竭患者、隐匿性肝炎、不明原因的肝病患者;(8)对多烯磷酯酰胆碱和/或中药过敏者;(9)不能坚持完成治疗或完成主要观察指标者。
1.2.3 剔除标准 (1)凡在入组后发现不符合试验方案者;(2)入组后发现严重躯体疾病者;(3)治疗期间复发饮酒者;(4)依从性<80%,>120%,不按方案服药的患者。
1.2.4 脱落标准 (1)失访者;(2)依从性差导致病历资料不全者;(3)因不良反应自行退出者。
1.2.5 终止试验标准 (1)病情加重,Maddrey 判定函 数≥32 分[计 算 公 式:4.6×PT(s)+TBil(mg/dL)];(2)发现一项或更多下列临床或实验室指标的:显著肝肿大;发热;白细胞计数>12 000/mm3伴有明显中性粒细胞分化;肝性脑病;肝脏收缩期杂音;其他新发症状,考虑疾病进展或恶化的;(3)试验期间出现严重不良反应者;(4)治疗期间妊娠者。
1.3 试验设计
本试验采用随机、阳性药对照的方法进行。随机方法:运用SAS 统计分析系统产生流水号为001~073 的数字将受试者随机分为中药组和对照组。
1.4 治疗方法
1.4.1 药物介绍 清肝活血方由柴胡9 g、黄芩9 g、丹参15 g、鳖甲9 g、葛根15 g 组成,颗粒剂剂型,由四川新绿色药业科技发展有限公司提供,由上海中医药大学附属龙华医院负责采购。多烯磷酯酰胆碱胶囊为赛诺菲北京制药有限公司生产,规格228 mg/粒(批号:国药准字H20059010)。
1.4.2 分组及服药方法 中药组:清肝活血方,每日2次,每次150 mL,开水冲服。对照组:多烯磷脂酰胆碱胶囊456 mg tidpo。所有治疗药物服用24 周。
1.5 观察指标及方法
1.5.1 临床症状疗效 治疗前后参照Glasgow 量表[14]对受试者的相关临床症状(口苦或口臭、胁胀或胁痛、乏力;黄疸、纳呆、面色晦暗、呕恶痰涎等)进行中医证候积分评分,并在疗程结束后采用尼莫地平法判定临床疗效。临床痊愈:疗效指数≥90%;显效:疗效指数≥70%,有效:疗效指数≥30%;无效:疗效指数<30%。疗效指数=(治疗前积分-治疗后积分)/ 治疗前积分×100%。总有效率=(临床痊愈例数+显效例数+有效例数)/患者总例数×100%。
1.5.2 肝酶水平 血清AST、γ-GT、ALT、ALP,由上海中医药大学附属龙华医院检验科检测。
1.5.3 ALC 无创肝功能评估 FibroTouch 检测LSM 值;APRI 评 分、FIB-4 指 数 和Maddrey 判 别函数。
1.5.4 不良反应 本次试验治疗完成后持续随访1周并记录受试者有无出现不良反应的发生情况。
1.6 统计学处理
应用SPSS21.0 进行统计学分析,计量资料采用均数±标准差(±s)进行统计描述;肝功能等生化指标采用t检验,临床有效率比较采用卡方检验,以P<0.05 为差异有统计意义。
2 结果
2.1 一般资料
自2019 年6 月1 日~2019 年9 月31 日于上海中医药大学附属龙华医院脾胃病二科门诊收治,经诊断为ALC 患者,且中医辨证为湿热瘀结证,通过数字随机法分组,共纳入73 例ALC 患者,中药组37 例,因再次饮酒剔除2 例,西药组36 例,因再次饮酒剔除2例。最终完成研究69 例,中药组35 例,年龄(56.86±6.76)岁,西药组34 例,年龄(58.03±8.27)岁,两组性别和年龄比较,差异无统计学意义(P>0.05),具有可比性。两组饮酒年限和日饮酒量比较,差异无统计学意义(P>0.05),具有临床可比性(表1)。本试验治疗至随访结束时无不良反应报告。
表1 两组基线资料比较(±s)Tab 1 Comparison of baseline data between the two groups(±s)
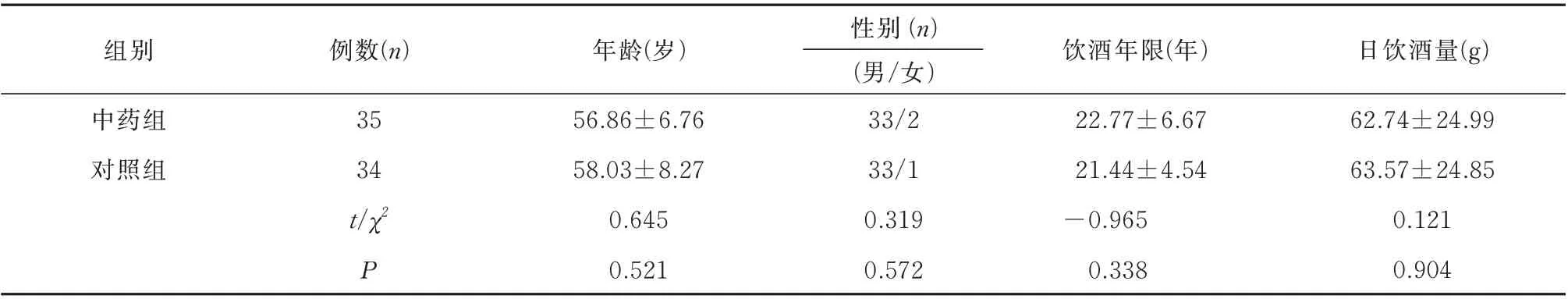
表1 两组基线资料比较(±s)Tab 1 Comparison of baseline data between the two groups(±s)
组别例数(n)年龄(岁)饮酒年限(年)日饮酒量(g)中药组对照组35 34 t/χ2 P 56.86±6.76 58.03±8.27 0.645 0.521性别(n)(男/女)33/2 33/1 0.319 0.572 22.77±6.67 21.44±4.54-0.965 0.338 62.74±24.99 63.57±24.85 0.121 0.904
2.2 临床症状疗效
治疗后中药组患者临床痊愈、显效、有效、无效例数分别为0、10、20、5 例,总有效率为85.70%;对照组分别为0、4、17、13 例,总有效率为61.80%,中药组总有效率优于对照组,且差异有统计学意义(χ2=5.130,P<0.05)。
2.3 肝酶水平
治疗后中药组AST、γ-GT、ALT、ALP 水平均低于对照组,且差异有统计学意义(P<0.05)。见表2。
表2 两组治疗前后肝酶指标水平比较(U/L,±s)Tab 2 Comparison of AST、γ-GT、ALT、ALP levels betweenthe two groups before and after treatment(U/L,±s)
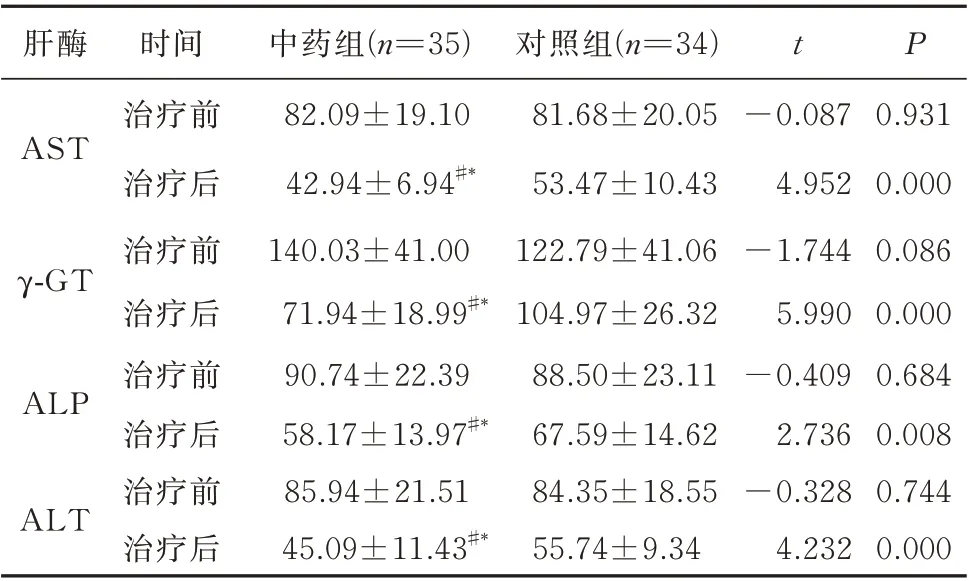
表2 两组治疗前后肝酶指标水平比较(U/L,±s)Tab 2 Comparison of AST、γ-GT、ALT、ALP levels betweenthe two groups before and after treatment(U/L,±s)
注:与组内治疗前比较,#P<0.05;与对照组治疗后比较,*P<0.05。
肝酶t P 0.931 0.000 0.086 0.000 0.684 0.008 0.744 0.000 AST γ-GT ALP ALT时间治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后中药组(n=35)82.09±19.10 42.94±6.94#*140.03±41.00 71.94±18.99#*90.74±22.39 58.17±13.97#*85.94±21.51 45.09±11.43#*对照组(n=34)81.68±20.05 53.47±10.43 122.79±41.06 104.97±26.32 88.50±23.11 67.59±14.62 84.35±18.55 55.74±9.34-0.087 4.952-1.744 5.990-0.409 2.736-0.328 4.232
2.4 ALC 无创肝功能评估
Fibrotouch 检测显示,治疗前两组LSM 差异无统计学意义(P=0.22);经治疗后,中药组LSM 低于对照组,且差异具有统计学意义(P=0.01),见表3。
表3 两组治疗前后LSM 比较(KPA,±s)Tab 3 Comparison of LSM between the two groups before and after treatment(KPA,±s)

表3 两组治疗前后LSM 比较(KPA,±s)Tab 3 Comparison of LSM between the two groups before and after treatment(KPA,±s)
注:与组内治疗前比较,#P<0.05;与对照组治疗后比较,*P<0.05。
时间中药组(n=35)对照组(n=34)t P 0.22 0.01治疗前治疗后15.15±1.54 14.19±1.49#*14.72±1.30 15.06±1.24-1.246 2.639
治疗后,两组APRI 评分、FIB-4 指数及Maddrey 判别函数低于治疗前(P<0.05),具体数值如表4 所示。与对照组相比,治疗后中药组试验组APRI 评分、FIB-4 指数较低,且差异有统计学意义(P<0.05);治疗后中药组Maddrey 判别函数低于中药组,且差异有统计学意义(P<0.01)。
表4 两组治疗前后ALC 无创肝功能评估(±s)Tab 4 Noninvasive liver function evaluation of ALC before and after treatment(±s)
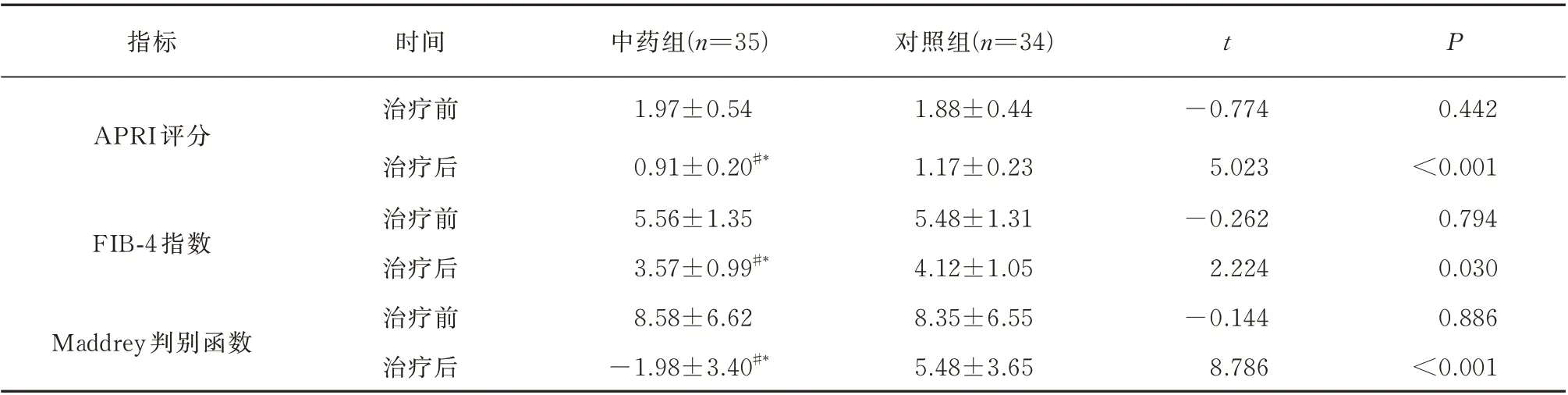
表4 两组治疗前后ALC 无创肝功能评估(±s)Tab 4 Noninvasive liver function evaluation of ALC before and after treatment(±s)
注:与组内治疗前比较,#P<0.05;与对照组治疗后比较,*P<0.05。
指标时间中药组(n=35)对照组(n=34)t P 0.442<0.001 0.794 0.030 0.886<0.001 APRI 评分FIB-4 指数Maddrey 判别函数治疗前治疗后治疗前治疗后治疗前治疗后1.97±0.54 0.91±0.20#*5.56±1.35 3.57±0.99#*8.58±6.62-1.98±3.40#*1.88±0.44 1.17±0.23 5.48±1.31 4.12±1.05 8.35±6.55 5.48±3.65-0.774 5.023-0.262 2.224-0.144 8.786
3 讨论
在祖国医学中,ALC 没有独立病名,但古代医家对饮酒引起的人体伤害已有较深入的认识,并将其归类于“伤酒”、“酒癖”、“酒臌”等论述。通过对ALC 病因病机的研究,湿热酒毒是导致其疾病发生的首要因素,湿热瘀结为ALC 的基本病机,QGHXP 包含柴胡、黄芩、丹参、鳖甲和葛根,以清肝胆湿活血化瘀为治则,故本方治疗ALC 切中根本病机。在前期动物实验中发现QGHXP 可明显改善大鼠肝脏脂肪变性及肝脏炎症程度,降低血清ALT、AST 水平,降低血浆内毒素水平,通过调节库弗细胞保护大鼠免于酒精性损伤,可能通过TGF-β1/Smad 通路抑制上皮细胞向间质细胞转化[9,10]。
肝穿刺仍是公认的评估肝纤维化和肝硬化程度的金标准,但因其创伤性的操作特质和潜在的并发症而未在临床实践中全面推广并且未被病患接受。近年来非创伤性即无创肝纤维化和肝硬化评估方法越来越受到关注,如TE 中临床运用最广泛的 为FibroScan 和FibroTouch[15]。越 来 越 多 研 究 显示,单一的血清学指标会随疾病的急重程度和患者个体条件而改变,不能准确反映纤维化程度,于是,结合性血清标志物(integrating serum markers)渐渐成为研究的焦点[16],其综合多项生化指标和人口学信息制定于大部分肝病患者的诊断、评估和预后[17]。如FIB-4 指数(Fibrosis-4 index/indices),使用年龄、AST、ALT 和血小板计数,已在临床用于纤维化评估十余年,对进展性纤维化患者的诊断特异性达97%[18]。大样本临床试验显示FIB-4 指数有效用于预测慢性乙肝患者肝硬化和肝脏相关性不良事 件[19]。ALD 患 者Maddrey 判 别 函 数 与 短 期 死 亡率预后的关系对评估ALD 的发病和预后有一定参考价值。APRI 评分(AST to platelet ratio index,APRI)即AST 与血小板比率评分,对于肝硬化患者变化以及发生HCC 风险的评估具有重要参考意义[20]。两者被证实是用于评估非酒精性脂肪性肝病肝纤维化合理的工具[21]。
回顾本试验数据显示,经过24 周治疗后中药组的LSM 值、FIB-4 指数显著降低,显示肝纤维化肝硬化程度所有改善,且优于多烯磷脂酰胆碱。APRI评分、FIB-4 指数及Maddrey 判别函数包含患者年龄信息,以及AST、ALT、血小板计数、凝血酶原时间和总胆红素在内的单一生化指标,通过科学的算法获得肝功能评估和疾病预后,三者均优于对照组,故更进一步提示QGHXP 可能改善ALC 进展和预后。
经治疗,患者口干口苦、胁胀、胁痛、脘痞纳呆等症状显著缓解,通过计算临床症状积分得到中药组的临床有效率优于对照组,说明QGHXP 可改善患者肝功能水平同时还可缓解临床症状。通过现代药理学研究显示,君药柴胡制剂对实验性肝损害有显著对抗作用,并能促进肝纤维吸收,从而减缓硬化发生。黄芩是中医重要的清肝药,有效成分具有促胆汁分泌、降低胆红素含量。鳖甲可抑制结缔组织增生,保护肝损伤、提高肝内蛋白合成。故联合作用,起到改善肝功能作用。此外,柴胡有效成分尚可抑制胃液分泌,故可缓解患者脘痞纳呆的症状。黄芩、葛根和丹参抑制血小板聚集,可调节凝血功能,故一定程度上降低Maddrey 判别函数改善预后。
综上所述,此次试验采用FibroTouch 检测LSM 值联合无创肝功能评估法来评估QGHXP 治疗ALC 的疗效,研究发现QGHXP 可有效改善患者肝功能,缓解临床症状,并改善肝纤维化肝硬化程度和疾病预后,是一种有效的治疗方法。本试验尚有不足之处,肝纤维化、肝硬化的形成与肝脏长期损伤密切相关,其治疗周期也相对漫长,应以更长的治疗周期和停药后的随访周期,进一步加强ALC的疗效评估,值得未来进一步探究和应用。
作者贡献度说明:
邢练军:总负责人、提供研究思路。潘洁露:设计研究方案。邢练军、潘洁露:负责整个研究的实施。张济、潘洁露:负责病例收集,填写病例报告表,完成随访。喻晓、张济:负责数据的录入、核对。潘洁露、张济:进行数据分析及论文撰写。张海燕:参与论文修改。

