KIRREL家族的研究进展*
杨友涵, 黄守卫, 安超群, 曾 燕, 魏 珍
武汉科技大学脑科学先进技术研究院,武汉 430065
KIRREL(kin of irregular chiasm-like protein)家族属于细胞粘附分子免疫球蛋白超家族,包括KIRREL1、KIRREL2和KIRREL3三个成员。KIRREL1于2001年由Donoviel等[1]首次发现,由于其结构与裂孔素(nephrin)相似且在肾脏丰富表达,因此被命名为NEPH1。2003年,Sellin等[2]发现了NEPH2和NEPH3。同年,Sun等[3]第一次命名了KIRREL2,并在胎儿脑、胰腺和视网膜母细胞瘤细胞系中发现了KIRREL2的4种不同剪接形式:KIRREL2、KIRREL2A、KIRREL2B和KIRREL2C,而Ihalmo等[4]则在大鼠和人的肾小球提取物以及体外培养的足细胞中鉴定到一个由708个氨基酸组成的Ⅰ型跨膜蛋白,命名为Filtrin,后来鉴定发现KIRREL2、NEPH3和Filtrin为同一蛋白质。KIRREL3于2003年被Ueno等[5]从小鼠的骨髓基质细胞中分离出来,于2005年被Tamura等[6]发现在小鼠脑内表达,后亦确认KIRREL3与NEPH2为同一蛋白质。2013年,Durcan等[7]发现KIRREL1还存在一个亚型KIRREL1B,具有促进肌细胞融合的作用;一年后,他们利用NCBI的基因数据库分析出KIRREL3存在两种亚型KIRREL3A和KIRREL3B,并分析了这两种蛋白的结构,同样在肌细胞中检测到其存在[8]。
KIRRELs作为细胞粘附分子免疫球蛋白超家族成员在细胞粘附和信号转导过程中发挥作用,对细胞的结构和功能进行调控,参与了多种恶性肿瘤细胞、神经元、骨骼肌细胞、足细胞的相互识别和粘附。探明其结构和功能,对于理解细胞的识别、粘附过程以及为相应疾病的治疗提供思路具有重要意义。
笔者对KIRREL家族有着浓厚的兴趣,在2020年12月以“KIRREL1”、“KIRREL2”、“KIRREL3”等为关键词,按照“表1 KIRREL家族文献检索策略”在中国期刊全文数据库(CNKI)和PubMed进行检索。将检索结果导入文献管理软件EndNote X9,删除重复文献。在后续的文献整理过程中,获取到许多有趣信息,例如“KIRREL3与MAP1B等多种蛋白的互作,可能介导神经元的发育和损伤后修复”。以这些蛋白以及“neural”等为关键词在PubMed继续检索,检索时间截至2021年8月,以补充完善信息(表1)。

表1 KIRREL家族文献检索策略Table 1 KIRREL family literature retrieval strategy
1 KIRREL家族的结构及部分作用位点
人源KIRREL1/2/3基因分别位于染色体1q23.1,19q13.12和11q24.2上。KIRRELs蛋白在结构上相似,都由胞外结构域(extracellular domain,ECD)、单次跨膜结构域(transmembrane domain,TMD)和胞内结构域(intracellular domain,ICD)组成,其中胞外结构包括1个信号肽和5个免疫球蛋白结构域(图1)。根据剪接形式以及蛋白质翻译后修饰的不同,3种KIRRELs又被划分出多种亚型。
KIRREL1存在KIRREL1A和KIRREL1B两种亚型,分子量分别在87 kD和70 kD左右,它们具有不同长度的胞内结构域。KIRREL1A在胞内存在一个原癌基因酪氨酸蛋白激酶同源体2(proto-oncogene tyrosine-protein kinase Src homology 2,SH2)结合位点(Tyr637,Tyr638),能结合并调节生长因子结合受体2(growth factor receptor bound 2,Grb2),以及C末端的一个PDZ结合位点(C末端氨基酸序列-QTHV)。KIRREL1B没有这两个酪氨酸(Tyr)残基和PDZ结合位点,但Scansite分析预测可能存在一个磷脂酰肌醇-3,4,5-三磷酸pleckstrin同源物(phosphatidylinositol-3,4,5-triphosphate pleckstrin homology,PIP3PH)结合位点[2,7]。
KIRREL2的胞内结构域具有5个磷酸化位点[9],然而在不同组织器官中KIRREL2存在不同的剪接形式,这些不同剪接形式被称为不同亚型:①从胎儿脑中获取的cDNA最长,其编码的蛋白被命名为KIRREL2;②胰腺中大分子量的KIRREL2亚型被命名为KIRREL2A,具有与胎儿脑中KIRREL2亚型相同的胞内和跨膜结构域,不同的胞外结构域;③胰腺中小分子量的KIRREL2亚型被命名为KIRREL2B,KIRREL2B的mRNA比KIRREL2A的mRNA缺少一个外显子,因此KIRREL2B具有更少的胞外免疫球蛋白结构;④视网膜母细胞瘤中的KIRREL2亚型没有免疫球蛋白区域和跨膜区域,信号肽直接融合到胞内结构域,是目前发现的分子量最小的KIRREL2蛋白,被命名为KIRREL2C[3]。
KIRREL3被发现与多种蛋白存在相互作用:其胞外结构与微管相关蛋白1B(microtubule-associated protein 1B,MAP1B)和肌球蛋白16(myosin ⅩⅥ,MYO16)相互作用;其胞内结构与钙调素相关丝氨酸激酶(calmodulin dependent serine protein kinase,CASK)、Na+-K+-ATP酶的β1亚单位(sodium/potassium-transporting ATPase subunit beta-1,ATP1B1)、泛素折叠修饰剂结合酶1(Ufm1-conjugating enzyme 1,UFC1)、丝氨酸羟甲基转移酶2(serine hydroxymethyrltransferase-2,SHMT2)和突触后致密蛋白(post synaptic density protein 95,PSD-95)存在相互作用[10-11]。KIRREL3胞外免疫球蛋白结构域上共有5个糖基化位点(Asn167,Asn253,Asn324,Asn361,Asn498),根据胞内结构存在的差异,将其区分为KIRREL3、KIRREL3A、KIRREL3B三个亚型[8]。KIRREL3A存在1个原癌基因酪氨酸蛋白激酶同源体3(proto-oncogene tyrosine-protein kinase Src homology 3,SH3)结合位点(AA759-773)和1个PDZ结合位点,KIRREL3B没有这两个结构[8]。

图1 KIRREL家族成员模式图Fig.1 Model diagram of KIRREL family members
2 KIRREL家族蛋白的功能
KIRREL家族的功能多样。现有研究表明,在肿瘤方面,KIRRELs的高表达可以促进黑色素瘤、胰腺癌、胃癌、乳腺癌等恶性肿瘤的发展,其突变还导致人体出现对某些肺癌药物的抗性;在神经元的发育尤其是神经元的突触连接方面,KIRRELs具有促进嗅球、海马、小脑脑区神经元发育的作用,其中KIRREL3的作用更明确,还可能介导神经元的损伤后修复;在肌细胞和肾脏足细胞中,KIRRELs具有促进肌细胞的融合以及损伤后修复的作用,还参与肾脏足细胞的滤过作用;单独的KIRREL2可对血糖浓度进行调控,其缺失与糖尿病的发生有关。
2.1 KIRREL促进肿瘤的发展
在原发性以及继发性黑色素瘤、良性纤维组织细胞瘤和胰腺癌中,KIRREL1基因均高表达[12-14]。类似的,在胃癌[15]、乳腺癌患者癌变部位,KIRREL1 mRNA和蛋白质的表达量明显高于癌旁组织,免疫组化实验结果表明,KIRREL1在乳腺癌组织中的表达率高达43.7%[16],而在小鼠乳腺癌组织中发现存在KIRREL1B的mRNA[7]。KIRREL1在胃癌、乳腺癌以及黑色素瘤发生发展的过程中扮演了怎样的角色,是否为癌基因以及具体的机制目前尚不明确,需要进一步的研究[16-17]。从病理组织切片检测以及全基因组分析的结果来看,不同肿瘤,同一肿瘤不同临床分型分期,KIRREL1是否表达以及表达强弱存在差异,因此KIRREL1可能可以作为某些特定肿瘤的确诊标志物或分期判断依据。相比于手术、放疗和化疗,服用特异性的靶向药是癌症治疗中副作用最小最易操作的治疗方案,然而耐药性成为靶向药完全取代其它治疗方案的阻碍。通常,靶向耐药是由于靶向的蛋白/基因发生突变,使小分子抑制剂或激动剂失效,而KIRRELs的突变也可能是某些耐药发生的原因。例如,在产生肺癌抗药性的患者体内检测到KIRREL1第398位的丙氨酸(Ala)突变为丝氨酸(Ser),使患者对厄洛替尼(erlotinib)出现耐药[18]。因此,KIRREL1或许也可以作为一个特定肿瘤预后的标志物,辅助判断疗效,但需要更多的临床研究,得到确切的数据,探明其灵敏度与准确度。此外,有研究表明:KIRREL3与丝氨酸羟甲基转移酶2(serine hydroxymethyrltransferase 2,SHMT2)共定位和互作[10]。SHMT2高表达于多种肿瘤组织样本,通常位于线粒体内,催化细胞内丝氨酸和甘氨酸的转换,并产生活化的一碳单位供给S-腺苷甲硫氨酸,为肿瘤细胞的核酸代谢提供原料,可促进肿瘤细胞的增殖[19-24]。这提示我们,作为细胞粘附分子,KIRREL3也可能参与肿瘤细胞相关信号转导。
2.2 KIRRELs介导神经元的发育
KIRREL1和KIRREL3存在于小鼠的嗅球(olfactory bulb,OB)、副嗅球(accessory olfactory bulb,AOB)和小脑[25];KIRREL2存在于小鼠的OB、AOB、小脑[26]。这三种蛋白质均具有促进神经元发育的作用[25,27]。KIRREL2和KIRREL3的缺失会导致AOB和犁鼻感觉神经元(vomeronasal sensory neuron,VSN)兴奋性突触(非对称突触)的形成出现障碍以及连接强度降低,影响AOB后部的突触连接[28]。KIRREL3敲除小鼠的AOB数目减少而体积异常增大,雄性小鼠之间的攻击性显著降低[29],这可能是副嗅球的结构异常导致小鼠获取气味信号的功能受限的表现。虽然在人体不存在AOB这一解剖结构,但其结构改变可以很好地帮助我们理解神经元的连接过程。在OB最背侧区域的轴突融合过程中二者也是不可缺少的,KIRREL2的缺失会导致错误的轴突靶向结合,出现部分神经元轴突错误地连接到中央区域的情况[30]。抑制嗅感觉神经元(olfactory sensory neuron,OSN)或者堵塞鼻腔,KIRREL2的表达下降,KIRREL3的表达升高,其表达受环核苷酸门控(cyclic nucleotide-gated,CNG)离子通道和维甲酸受体(retinoic acid receptor,RAR)调控。RAR介导的信号转导调节CNG通道的数目从而维持着KIRREL2的表达并选择性抑制神经元死亡。当RAR被抑制,CNG亚基CNGA2(cyclic nucleotide-gated channel A2)表达减少,CNG通道数目降低,KIRREL2表达减少;而CNG通道的减少又会促进维甲酸(retinoic acid,RA)的降解进一步抑制RAR的信号通路,形成正反馈加剧KIRREL2的表达减少,导致异常嗅球增多[31-32]。KIRREL2和KIRREL3调节嗅球神经元分布的均质性以及精确连接,它们的正确表达是影响神经元束状轴突的形成和轴突靶向性的重要因素[33-34]。
KIRREL3是进化高度保守的,在果蝇、非洲爪蟾、斑马鱼、小鼠、大猩猩和人等物种体内均有表达[35]。人体中,KIRREL3表达于心脏、肺、肝脏、肾脏、睾丸、大脑和肌肉等组织器官,在胎儿大脑中表达最高[35]。研究表明KIRREL3是神经发育障碍疾病的重要调控蛋白,它通过促进神经元突触形成和提高突触的可塑性,来控制神经元的功能[36-38],其缺失会影响神经的发育[39-40]。流行病学调查发现,KIRREL3基因突变的儿童,可能会导致神经质的发生,出现皮肤粗糙、鼻梁扁平、内眦褶等面部畸形[41]。而且雅各布森综合征[42]、智力障碍、自闭症、多动症和阿尔兹海默病等疾病的发病也与KIRREL3缺失有关[37]。在一项针对36名自闭症患者的流行病学调查中,发现变异的KIRREL3导致了神经发育的失调[43];染色体易位导致的KIRREL3基因受损的患者出现了智力障碍(intellectual disability,ID)[44]。最新的研究证明,KIRREL3在海马、大脑皮层、嗅球、杏仁核、丘脑和小脑广泛存在,参与维持与运动、感觉和认知相关的神经元网络[45]。
在与记忆密切相关的海马体内,KIRREL3表达于齿状回(dentate granule,DG)神经元和少量γ-氨基丁酸(γ-aminobutyric acid,GABA)能神经元中,参与突触的发育过程[46]。KIRREL3聚集在神经元连接处,促进丝状伪足的形成,进一步促进突触连接,以此介导细胞的嗜同性结合(相邻细胞表面同种粘附分子间的相互识别与粘附,也称同亲性结合)[47]。丝状伪足是DG神经元轴突的突起,能刺激GABA能神经元释放GABA,对CA3锥体神经元产生抑制效应,缺乏KIRREL3会导致丝状伪足的数目明显减少,神经环路的结构和功能受损,可能这就是KIRREL3基因敲除小鼠的CA3神经元过度活跃,出现多动现象的原因,但KIRREL3不是突触建立连接所必需的,它的缺失只会影响到丝状伪足的数量(密度)[48]。
KIRREL3与MAP1B、MYO16、CASK、UFC1、ATP1B1以及PSD-95多种蛋白的互作,可能介导神经元的发育及损伤后修复过程。MAP1B在人的胚胎时期处于高水平,出生两周后开始下降,并保持较低水平,但在成人体内的海马、嗅球等可塑性较高的组织中依然保持高水平,主要存在于神经元和神经胶质细胞中[49],其第25位和1201位丝氨酸磷酸化形式特异性存在于神经元轴突部位,在受损神经元中的表达量更高[50],可参与微管的稳定及动力学过程,在神经损伤及神经退行性疾病中是促进神经元轴突再生所必需的[51]。有趣的是,小鼠海马组织中的KIRREL3,在2~3周左右蛋白表达量达到高峰,待小鼠成年后表达量会降低[47],与MAP1B表现出时间与空间一致性,提示二者可能共同促进海马区神经元的发育及损伤后修复过程。MYO16同样在大脑发育过程表达上调,通过与蛋白磷酸酶(protein phosphatase,PTP)的相互作用调控磷酸肌醇3激酶(phosphoinositide 3-kinase,PI3K)信号来调节神经元的形态[52]。与KIRREL3存在胞内互作的蛋白中,CASK作为突触分子可通过调控Ca2+/CaM丝氨酸/苏氨酸激酶Ⅱ(Ca2+/CaM serine/threonine kinase Ⅱ,CaMKⅡ)的自磷酸化,改变CaMKⅡ的活性,磷酸化的CaMKⅡ招募含SH2结构域的信号分子(如Grb2),转导细胞的增殖与分化信号,从而影响突触可塑性和记忆行为[53]。对脑发育畸形的智力障碍患者的调查也提示了CASK的突变与发病的密切关系[54]。UFC1与神经细胞粘附分子(neural cell adhesion molecule,NCAM140)相互作用,NCAM140介导酪氨酸激酶Fyn的激活,促进大脑中GABA能神经元突触的成熟[55]。KIRREL3具有调节海马神经元靶向特异性,介导CA3与GABA能神经元连接的作用[47],可能与UFC1起协同作用。ATP1B1作为Na+-K+-ATP酶的一个亚基被发现,在海马、躯体感觉皮层、后扣带回皮质的GABA能神经元中高表达[56],在神经元特异性转录因子(specific transcription factor 4,Sp4)的调节下,介导神经元能量的产生、神经元活性、能量消耗的偶联[57]。KIRREL3羧基端存在的PDZ结合位点在突触后神经元存在的情况下,可直接与PSD-95这种支架蛋白结合[11],PSD-95由PDZ、SH3等结构域组成,对于维持突触结构及突触可塑性有重要作用[58],SH3结构域参与包括信号转导、细胞增殖和细胞运动在内的多个生物学过程,或许KIRREL3A在神经元突触以及神经-肌接头等位置的贡献比KIRREL3B更大,因为SH3常聚集在突触以及神经末梢等处,可以与KIRREL3A的胞内结合位点结合[8]。KIRREL3与这些蛋白的互作进一步提示了它参与神经元细胞的识别,介导突触的形成、发育、跨突触的信号传递以及损伤后修复的作用。
KIRREL3对表型的影响目前尚存在争议。有研究者认为,海马脑区的DG神经元中高表达KIRREL3,在小鼠新物体的识别中起作用,敲除KIRREL3后,小鼠对新物体的识别功能受损,且表现出多动的特点[59]。也有研究表明,海马脑区的损伤不会引起新物体的识别障碍,新物体识别障碍可能是由于皮质部分的损伤引起的[60]。还有人认为KIRREL3基因敲除小鼠在听觉、触觉以及运动技能等方面的缺陷更为明显[36]。KIRREL3基因敲除小鼠表现出明显的多动症以及自闭症的行为特点,一方面提示KIRREL3基因的正常表达与神经系统的功能的确有着密切关系,另一方面提示我们KIRREL3基因敲除小鼠可以作为研究多动症等疾病的模型[61]。
2.3 KIRRELs在肌细胞融合中的作用
KIRRELs在骨骼肌的融合、修复中发挥作用。在探究脊椎动物肌肉形成的实验中,研究人员发现斑马鱼体内的KIRREL作为特殊的KIRREL家族分支存在于硬骨鱼类,其蛋白结构与哺乳动物KIRREL3最接近,具有传递融合信号的功能,在斑马鱼体内表达于融合能力强的成肌细胞膜,缺失将会导致肌细胞的融合障碍[62]。同样,在小鼠腓肠肌中的实验结果表明,KIRREL1A促进骨骼肌的融合以及骨骼肌的损伤后修复,敲除KIRREL1A,细胞增殖速度减慢以及细胞间融合受到抑制。在小鼠骨骼肌正常的增殖和分化过程中几乎检测不到KIRREL2的表达,但是在肌细胞受损后KIRREL2的mRNA的表达量上升,说明KIRREL2有促进骨骼肌修复的功能[63]。除了促进骨骼肌的融合以及骨骼肌的损伤后修复,KIRREL3还参与调节神经元与肌细胞的结合,在成年小鼠的背根神经元中,KIRREL3将本体感受器的神经元轴突定位到肌梭[64]。进一步的研究表明,KIRREL3在骨骼肌分化过程中能促进肌原细胞分化为梭形,此形态学变化有利于肌细胞行使收缩牵拉功能[65]。KIRREL3在成人骨骼肌中的表达规律和作用还有待研究,有报道称在成人骨骼肌中存在3种KIRREL3的转录本,而这3种转录本在静息、运动以及运动后损伤时并不是一直存在的,但KIRREL3蛋白在不同状态下都是可以检测到的,这可能与KIRREL3跨越了非常大的基因组区域有关(约580 kb),完成一次完整转录需要时间较长,部分先转录的mRNA被降解。那么具体什么因素能触发骨骼肌中这种“闲置”mRNA的降解呢?这对于成人骨骼肌的损伤和修复的研究有重要意义[8]。
2.4 KIRRELs参与肾脏足细胞的滤过作用
肾小球滤过膜外层是肾小囊上皮细胞,也称足细胞,足细胞的足突交错形成裂隙,裂隙上有一层滤过裂隙膜,是滤过的最后一道屏障。位于滤过裂隙膜的nephrin,与KIRREL家族所有成员的胞外结构域均存在相互作用,形成促进细胞粘附的异源二聚体[66-67],阻止蛋白质的渗出。
KIRREL1在肌球蛋白1C(myosin 1C,MYO1c)的介导下,从足细胞的胞质转运至细胞膜处,并与nephrin形成复合物[68],KIRREL1与nephrin构成不规则的圆形或椭圆形小孔,参与形成动态可调节滤过裂隙膜[69]。KIRREL1的尾部位于胞内,与紧密连接蛋白-1(zonula occludens-1,ZO-1)的PDZ结构域发生特异性结合,KIRREL1酪氨酸残基(Tyr762)发生磷酸化,激活细胞内的信号级联反应,此过程可能参与调节KIRREL1与nephrin结合的稳定性及特异性[70-71]。进一步的研究表明,若利用药物稳定KIRREL1与ZO-1的结合,可以起到保护滤过裂隙膜的作用[72];若Tyr762发生突变(如突变为丙氨酸),KIRREL1将失去与ZO-1的结合能力[71],滤过裂隙膜受损,甚至出现蛋白尿。KIRREL2的表达在细胞分化形成肾小球和肾小管时达到高峰,抑制其表达会导致肾小球的形态异常以及肾小管扩张[73]。此表达过程受到核因子-κB(nuclear factor-κB,NF-κB)、特异性蛋白1(specificity protein 1,Sp1)[74]、转录因子WT1(Wilms’tumour 1,WT1)的调控:肿瘤坏死因子-α(TNF-α)激活NF-κB,NF-κB与Sp1、WT1表现出协同作用,共同作用于启动子,促进基因的转录,上调KIRREL2的表达;KIRREL2的表达受到DNA甲基化的抑制[75]。在人体中,KIRREL2富含脯氨酸残基的结构域中脯氨酸突变为精氨酸,将会导致机体出现足细胞相关疾病以及蛋白尿等严重后果[76]。KIRREL3同样表达于滤过膜处,可以检测到与nephrin体外特异性互作[35]。在健康受试者尿液中可以检测到免疫反应性KIRREL3,这可能是由于金属蛋白酶对KIRREL3胞外区域的水解,在膜性肾小球肾炎患者尿液中KIRREL3蛋白含量更高[35],或许这可以作为膜性肾小球肾炎的一个辅助诊断的指标。
2.5 其他
KIRREL1对常见的胰蛋白酶等金属蛋白酶不敏感,却可以被菱形体蛋白2(rhomboid-like protein 2,RHBDL2)特异性水解。RHBDL2是一种在乳腺癌中高表达,能激活或反向激活表皮生长因子信号通路从而调控细胞的增殖与凋亡的膜内丝氨酸水解蛋白酶,可以将KIRREL1从16/17号氨基酸(Ser16,Gln17)处切割[77],其信号肽被水解。奇怪的是RHBDL2的酶活性部位位于胞内,但KIRREL1被水解的部位位于胞外,这其中存在更复杂的机制。
KIRREL2参与血糖的控制。从啮齿类到灵长类,KIRREL2是高度保守的,在小鼠的胰腺中仅表达于胰岛β细胞,且在敲除KIRREL2的小鼠体内,并未检测到KIRREL1/3的代偿[3,9],其主要作用是参与胰腺的发育以及维持β细胞的功能[3]。胰岛β细胞的一个重要功能就是分泌胰岛素调控血糖处于正常水平。KIRREL2存在于胰岛β细胞表面的细胞连接处,与上皮组织钙黏蛋白(E-cadherin)和连环蛋白(β-catenin)共定位和互作,存在磷酸化、糖基化的翻译后修饰,其酪氨酸(Tyr595,Tyr596,Tyr631,Tyr632,Tyr653)的磷酸化有利于KIRREL2的稳定,参与调节基础胰岛素分泌,在基础状态下对胰岛素的分泌起抑制作用[9]。糖尿病分为Ⅰ型、Ⅱ型和其他特殊类型糖尿病,Ⅰ型糖尿病是胰岛β细胞破坏导致的胰岛素绝对缺乏引起的。非肥胖糖尿病模型小鼠(no obesity diabetes,NOD)的糖尿病发病过程中,细胞中KIRREL2进行性减少[3]。值得注意的是,KIRREL2在胰腺和肾脏足细胞中均存在定位,且在Ⅰ型糖尿病患者体内检测到KIRREL2的自身抗体,因此被破坏的胰岛β细胞释放的KIRREL2可以作为Ⅰ型糖尿病患者体内的自身抗原,刺激机体产生相应的抗体[78]。一方面,这些抗体可能与胰腺的KIRREL2特异性结合,解除KIRREL2对胰岛素分泌的抑制,对Ⅰ型糖尿病的发生起挽救作用,另一方面,这些抗体很有可能与足细胞中的KIRREL2发生特异性结合,介导糖尿病肾病这一严重并发症的发生。
KIRREL3可能参与家禽速发型新城疫病毒(Newcastle disease virus,NDV)的免疫过程[79]。NDV引起的新城病(Newcastle disease,ND)是非洲及亚洲农村地区易发的家禽感染类疾病,严重危害粮食安全。KIRREL3参与了中等滴度NDV侵袭的免疫反应[79],遗传学研究表明可以通过对鸡的选择性育种增强对NDV的抵抗力[80]。
KIRREL家族作用机制总结见图2。
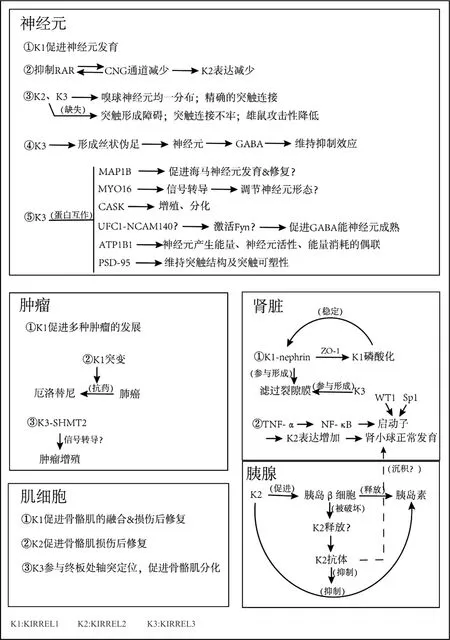
图2 KIRREL家族作用机制图Fig.2 Summary of the functions of KIRREL family
3 总结与展望
KIRREL家族成员主要以细胞粘附分子的角色在细胞间发挥生物学效应。其蛋白质表达水平的高低以及其翻译后修饰调控多种肿瘤发展、神经元发育、肌细胞融合以及肾脏足细胞的滤过作用等多个方面,而且与其它蛋白质存在复杂的相互作用。目前来看,在KIRREL家族的研究中,人们对KIRREL3,尤其是其在促进神经系统发育方面的研究更深入,但对其翻译后修饰以及亚型的关注甚少,关于KIRREL家族的亚型的研究更是寥寥无几,这些亚型的结构以及功能如何,可能成为进一步研究KIRRELs的方向。此外,在细胞外与KIRRELs特异或非特异性结合的受体/配体是什么,调控的通路是什么,涉及到细胞内的哪些信号通路,是如何调控的等等一系列的问题,有待进一步研究。解答这一系列问题,将有助于我们对KIRRELs的细胞生物学功能的理解,以及为深入探讨神经发育障碍等疾病的发病机制提供线索,为相关疾病的诊断和治疗带来新思路。

