N-脱甲基酶催化氧化咖啡因的反应机理
战 鸿 彬, 李 文 志, 王 禹 茜, 王 一
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
咖啡因(1,3,7-三甲基黄嘌呤)及其相关的甲基黄嘌呤广泛存在于多种植物中。咖啡、茶和巧克力等都含有咖啡因成分。在药品中,咖啡因通常被用作心脏、神经和呼吸兴奋剂[1]。相关的甲基黄嘌呤的其他医药应用包括利尿剂和支气管扩张剂,以及用于缓解支气管痉挛和控制哮喘[2]。由于它们在食品和制药工业中的广泛应用,很容易通过加工设施的液体废水和固体废物、咖啡和茶田植物物质的分解以及生活垃圾进入环境。研究表明,土壤中的甲基黄嘌呤能够通过种子萌发,且咖啡因被认为是饮用水废水污染的人为标记物[3]。
咖啡因在生活中几乎无所不在,因此可以从各种自然环境中分离出能够降解咖啡因的微生物[4-6]。微生物通常使用氧化和N-脱甲基化途径来分解咖啡因[7]。Summer等[8-9]首次提出了从恶臭假单胞菌CBB5中纯化的N-脱甲基酶的详细特征。N-脱甲基酶由具有细胞色素C还原酶活性的还原酶组分(Ccr)和两个亚基的N-脱甲基酶组分(Ndm)组成,其中Ndm是由NdmA和NdmB两个亚基组成的可溶性加氧酶,可以通过去甲基化生产黄嘌呤,但是NdmA和NdmB都不能将7-甲基黄嘌呤的N-脱甲基化为黄嘌呤。Summer等[10]于2013年证明了N7去甲基化反应需要一个由NdmC、NdmD和NdmE组成的独特的、紧密结合的蛋白复合物。紧密的NdmCDE络合物作为高度特异的7-甲基黄嘌呤N7-脱甲基酶,一个O2分子消耗的每一个N7-甲基以甲醛的形式被去除。
大量研究结果表明,恶臭假单胞菌CBB5可以利用咖啡因作为唯一碳源和氮源,通过5种酶(NdmA、NdmB、NdmC、NdmD和NdmE)依次催化N-脱甲基化来降解咖啡因。但细菌N-脱甲基酶的结构和生化性质在很大程度上仍不清楚。2019年,Kim等[11]成功得到了NdmA(6ICK)和NdmB(6ICL)及其相关复合物的结构。通过酶分析、荧光标记和小角X射线散射得到了证实:这些酶形成了一个摩尔比为3∶3的独特杂化络合物,以有效地连续降解咖啡因。这些发现虽然拓宽了对细菌降解咖啡因的了解,但是具体的反应机理仍未得到合理的解释。
本研究通过理论计算方法得到N-脱甲基酶与咖啡因的准确作用位点和优势结合方式,以期为研究N-脱甲基酶催化氧化咖啡因机理提供的理论基础。
1 计算方法
使用AutoDock[12]和AutoDock Vina[13]软件,通过分子对接方法进行研究。分子对接是通过蛋白质受体的特征和受体与药物进行相互作用来研究药物设计的方法,是一种简单快捷的理论模拟方法,其中大部分用来检查分子之间的协同作用,然后来提前判断结合方法和关联。最近几年,分子对接逐渐成为新药研发的首要技术[14]。
1.1 软件及构型获取
由官网下载AutoDock 4.0和AutoDock Tools1.5.6(http://autodock.scripps.edu/downloads)。由官网(http://vina.scripps.edu/)下载AutoDock Vina。从官网(https://pymol.org/2/)下载PyMOL软件。从PDB蛋白质结构数据库(https://www.rcsb.org/)下载N-脱甲基酶相关蛋白质:6ICN、6ICK、6ICO、6ICQ。从ZINC官网(http://zinc.docking.org/)下载咖啡因、茶碱及可可碱化合物用于分子对接的结构式。
1.2 受体预处理
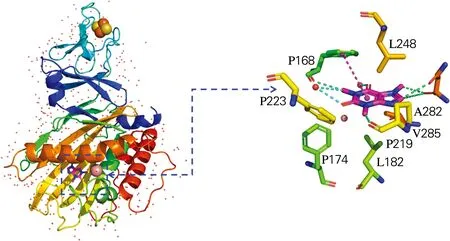
以6ICK蛋白质为例。首先使用PyMOL打开蛋白质,检查蛋白质三维立体结构,如图1(a)所示。该蛋白质分子由A、B、C三条多肽链链组成,且周围存在大量水分子。每条多肽链的α-亚基按功能可以分为两个结构域,分别为N端Rieske型[2Fe-2S]簇域,用于接受来自其他电子转移组分的电子;C端为配体结合域,用于底物的氧化。为了计算方便,在不影响计算结果的前提下,去除水分子和相关配基。完成上述工作后对蛋白质分子进行检查,未出现丢失原子、化学键断裂等情况。蛋白质预处理完成后,使用AutoDock Tools,将.pdb格式的蛋白质转换为.pdbqt格式,即完成受体的预处理工作,如图1(b)所示。

(a) PyMOL处理
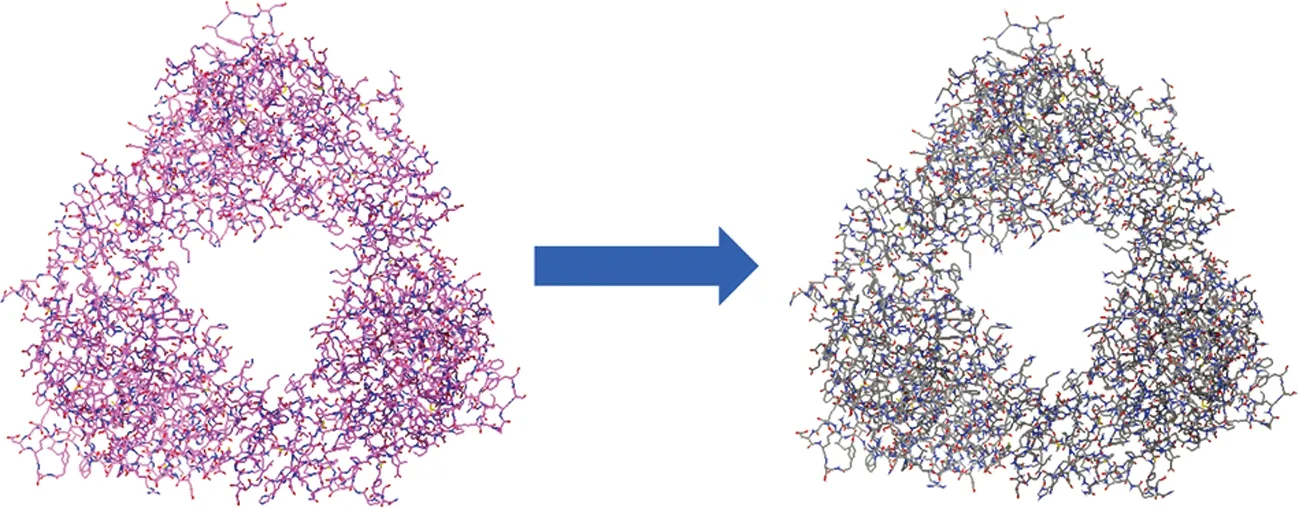
(b) AutoDock Tools处理
1.3 配体预处理
登录ZINC数据库,查找咖啡因(CFF)、茶碱(TEP)、可可碱(37T)小分子配体,并下载保存.mol2 格式。以小分子配体咖啡因(CFF)为例,用AutoDock Tools软件打开小分子配体,设置可旋转键的数量,由于咖啡因是具有双环结构的平面刚性化合物,可旋转键数目为0,接着输出配体的.pdbqt文件即完成小分子配体预处理工作。
2 结果与讨论
2.1 N-脱甲基酶活性中心验证
酶的催化作用是经过其与底物构成复合物(即中间产物)从而降低反应能来实现的。通常情况下,底物并不能与酶分子表面任意部位相结合,底物只能和酶的活性中心结合进而起到催化作用。Kim等[11]的研究结果表明,这两种酶都可以分为两个结构域:N端Rieske型[2Fe-2S]簇域和C端配体结合域。但不同的是,NdmA(6ICN、6ICO)的C端配体结合域为非血红素钴中心,而NdmAQL(6ICQ)的C端配体结合域为非血红素铁中心。结合实验研究结果和C端配体结合域功能,可以确定,蛋白质6ICN、6ICO、6ICQ的活性中心为C端具有非血红素配体附近区域。且由于NdmA和NdmAQL由三条多肽链组成,故将分成A、B、C三条链进行研究。具体活性中心坐标如表1所示。
根据活性中心位点坐标设置对接中心,使用AutoDock Tools进行构象搜索,对接的痕迹如图2所示。
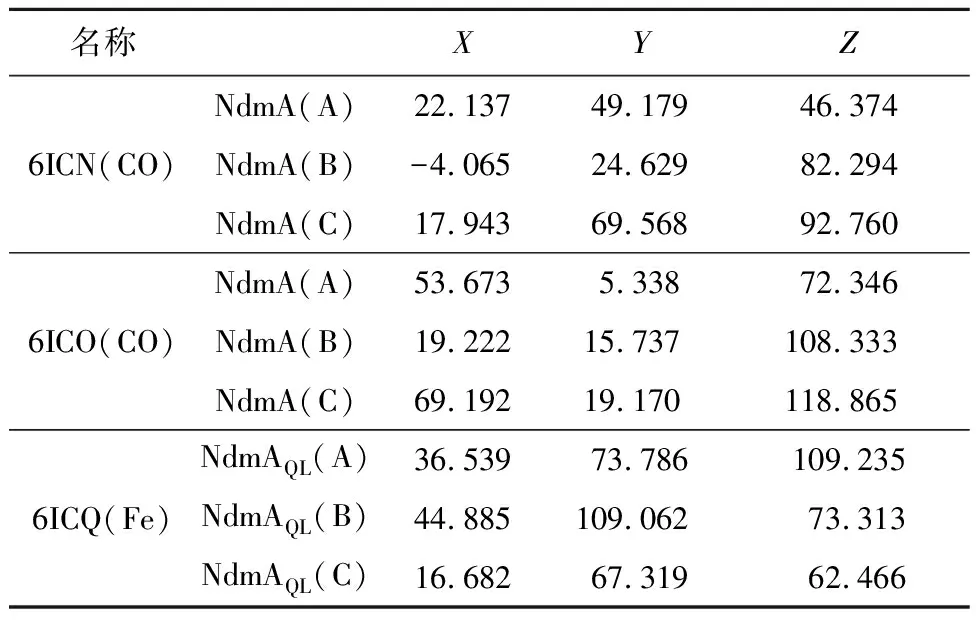
表1 NdmA、NdmAQL活性中心坐标Tab.1 The active center coordinates of NdmAand NdmAQL
(a) NdmA(A)-CFF(b) NdmA(B)-CFF(c) NdmA(C)-CFF(d) NdmA(A)-TEP(e) NdmA(B)-TEP

(f) NdmA(C)-TEP(g) NdmAQL(A)-37T(h) NdmAQL(B)-37T(i) NdmAQL(C)-37T
为了使结果更加清晰直观,将构象结果聚类分析,结果如表2所示。根据小分子配体图像聚集情况及聚类分析结果,可以发现:在NdmA和咖啡因对接结果中,A、B、C三条链聚类数最高组同时也是结合自由能最低组,且分布较集中,可以认为活性中心位置判断正确。在NdmA和茶碱的对接结果中,A、B、C三条链中的聚类结果较为分散,虽然聚类数最高的组不是结合自由能最低的组,但是结合自由能相差较小,综合来看,聚类数最高的构象附近即为活性中心附近。在NdmAQL和可可碱对接结果中,A、B、C三条链聚类数最高的组同时也是结合自由能最低的,且分布较为集中,故可认为活性中心位置判断正确。
2.2 NdmA与咖啡因(CFF)对接结果
结合自由能可以从总能量的角度反应对接成键结合能力的强弱,结合自由能数值通常为负,绝对值越大,键结合能力就越强,同样破坏这个结合情况所需要的能量也就越高[15-17]。当结合自由能为正时,表明此时无法自发形成化学键,即小分子配体与蛋白质无法结合。结合自由能并不是唯一评价小分子化合物与大分子蛋白质对接结果的标准。对于已经给出小分子在蛋白质中位置的复合物,RMSD值也是一项较为重要的评价标准。以复合物中原配体所在位置为参考值,若RMSD值小于2×10-10m,则配体对接结果较为准确,若RMSD值大于2×10-10m,则对接结果准确性较低。因此在对接过程中,结合自由能及RMSD值将成为判断最优构象的主要标准。
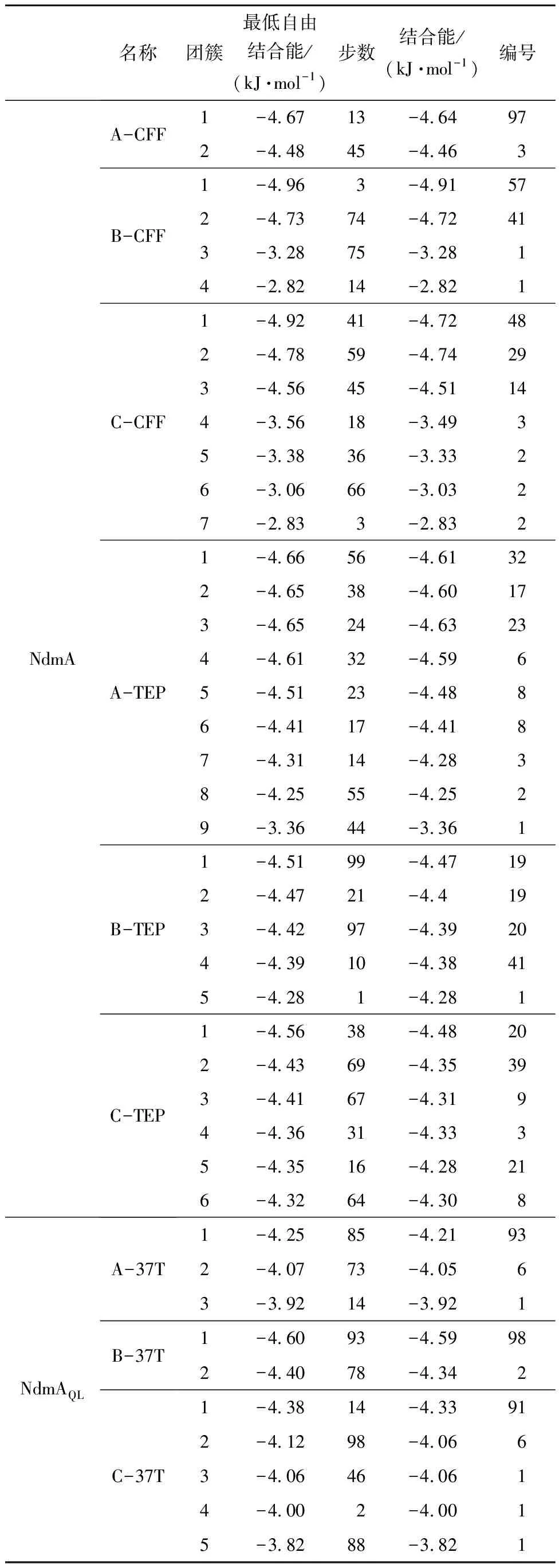
表2 N-脱甲基酶与配体对接结果聚类分析Tab.2 Cluster analysis of docking results betweenN-demethylase and ligands
通过Vina软件得到的NdmA蛋白质与咖啡因对接打分结果如表3所示。从表3可以看出,在A、B、C链中,构象一的结合自由能打分最低,且RMSD值最小,故推测构象一为最优构象。理论上来说,此时咖啡因与NdmA结合最为紧密,催化效率最高。
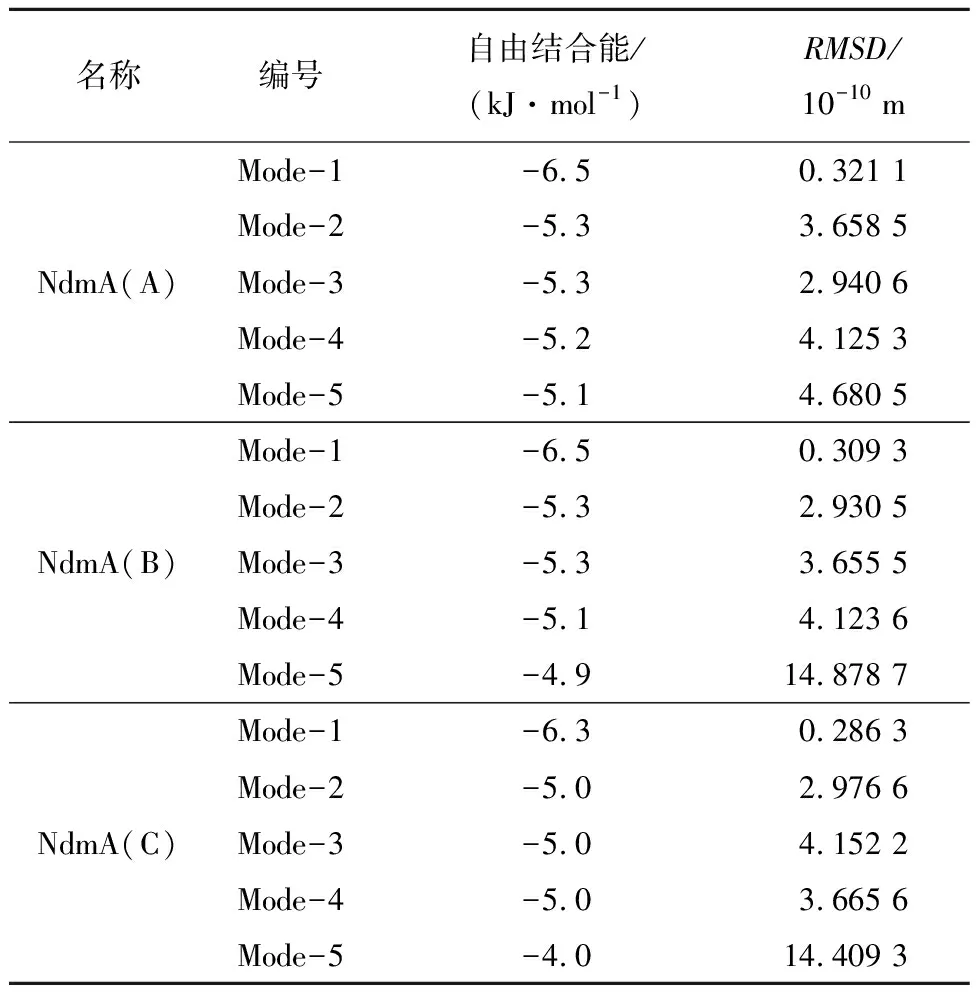
表3 NdmA与咖啡因(CFF)对接结果Tab.3 Docking result of NdmA and caffeine (CFF)
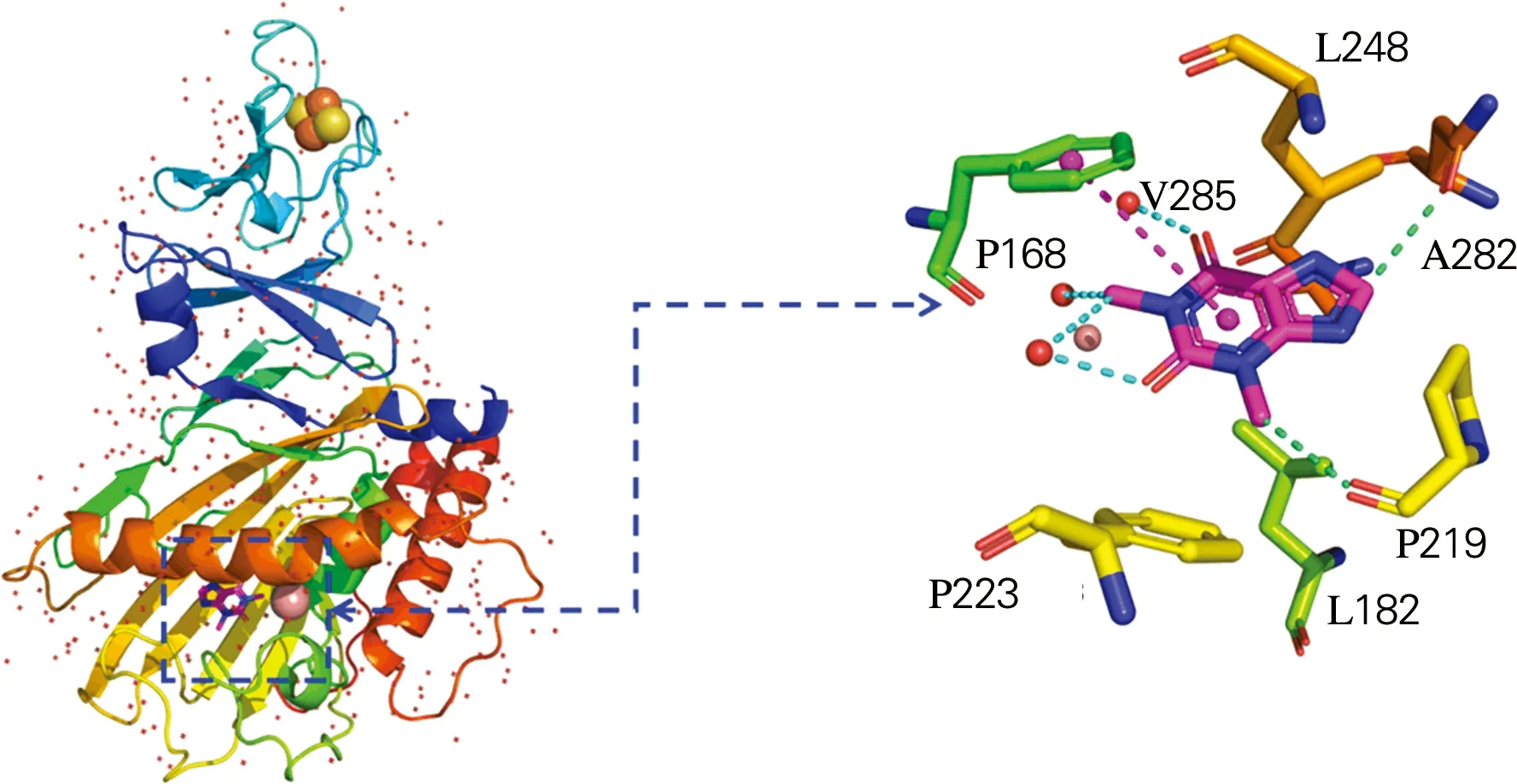
分析配体咖啡因与周围氨基酸相互作用情况,结果如图3所示。可以看出,当咖啡因与NdmA 蛋白质结合发生催化作用时,咖啡因小分子位于A、B、C链的疏水口袋中,与蛋白质接触较为充分。咖啡因周围氨基酸残基分布包括苯丙氨酸、亮氨酸、脯氨酸、天冬酰胺和缬氨酸(F168,F174,L182,P219,F223,L248,N282和V285)。A链中N282、L248和F168与咖啡因之间形成碳氢键且L182、L248和N282参与了和咖啡因之间的的疏水相互作用;B链中N282和P219与咖啡因之间形成碳氢键且L182、L248、V285和P219参与了和咖啡因之间的疏水相互作用;C链中F168、N282和P219与咖啡因之间形成碳氢键且L182、L248、V285、F281和N282参与了和咖啡因之间的疏水相互作用。值得注意的是,三条链中N282皆与咖啡因之间形成碳氢键,因此推测N282可能是NdmA与咖啡因结合的关键氨基酸。且在B链和C链中,F168与咖啡因分子上的嘧啶环形成π-π堆积作用,为化合物提供了强大的范德华力使蛋白质和配体紧密结合。

(a) NdmA(A)

(b) NdmA(B)
(c) NdmA(C)
为了验证F168和N282在NdmA与咖啡因结合过程中的关键性,将其突变为A168和A282,以A链为例再次进行对接,结果如表4所示。从对接结果可以发现,此时的最优构象并不是结合自由能最低的构象,再次证明了F168和N282对咖啡因与NdmA紧密结合起到非常重要的作用。
综上所述,理论上分析咖啡因与NdmA之间的催化反应应具有配体与蛋白质结合紧密,吻合度较高,反应较完全等特点。
2.3 NdmA与茶碱(TEP)对接结果
通过Vina软件得到的NdmA蛋白质与茶碱分析配体茶碱与周围氨基酸相互作用情况,结果如图4所示。从图4中可以看出,茶碱小分子配体皆位于NdmA(A)、NdmA(B)和NdmA(C)的对接口袋中,且与蛋白质接触较为充分。在NdmA(A)中,茶碱周围分布的氨基酸残基包括F168、L182、P219、F223、L248、N282和V285,其中L182和P219与茶碱之间形成碳氢键,F281、L248、N282和V285参与了与茶碱的疏水相互作用。在NdmA(B)中,茶碱周围分布的氨基酸残基包括F168、L182、P219、F223、L248和V285,其中F168和P219与茶碱之间形成碳氢键,F281、L248、P219和L182参与了与茶碱的疏水相互作用。同样的,在NdmA(C)中茶碱周围分布的氨基酸残基包括F168、L182、P219、F223、L248和V285,其中F168和P219与茶碱之间形成碳氢键,且F223、L248、V285、P219、F281和L182参与了与茶碱的疏水相互作用。尽管不同链中茶碱分子周围的相互作用氨基酸残基有所不同,但是无论是在A、B或C链中,F168都与茶碱分子上的嘧啶环形成π-π堆积作用,为化合物提供了强大的范德华力。因此推测,在NdmA中,F168和P219可能是与茶碱结合的关键氨基酸。
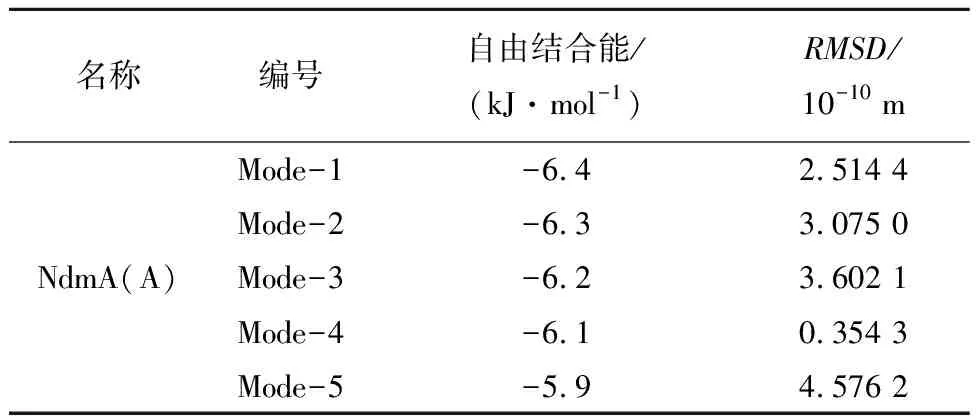
表4 突变后NdmA与咖啡因(CFF)对接结果Tab.4 Docking results of NdmA and caffeine (CFF)after mutation
对接打分结果如表5所示。从表5中结果可以发现,A链中Mode-4的结合自由能虽然不是最低,但是RMSD值最小,与原复合物中构象吻合度较高,故推测Mode-4为计算结果的最优构象。同理,在B链和C链中,Mode-4和Mode-3也应分别为此链对应的计算结果的最优构象。
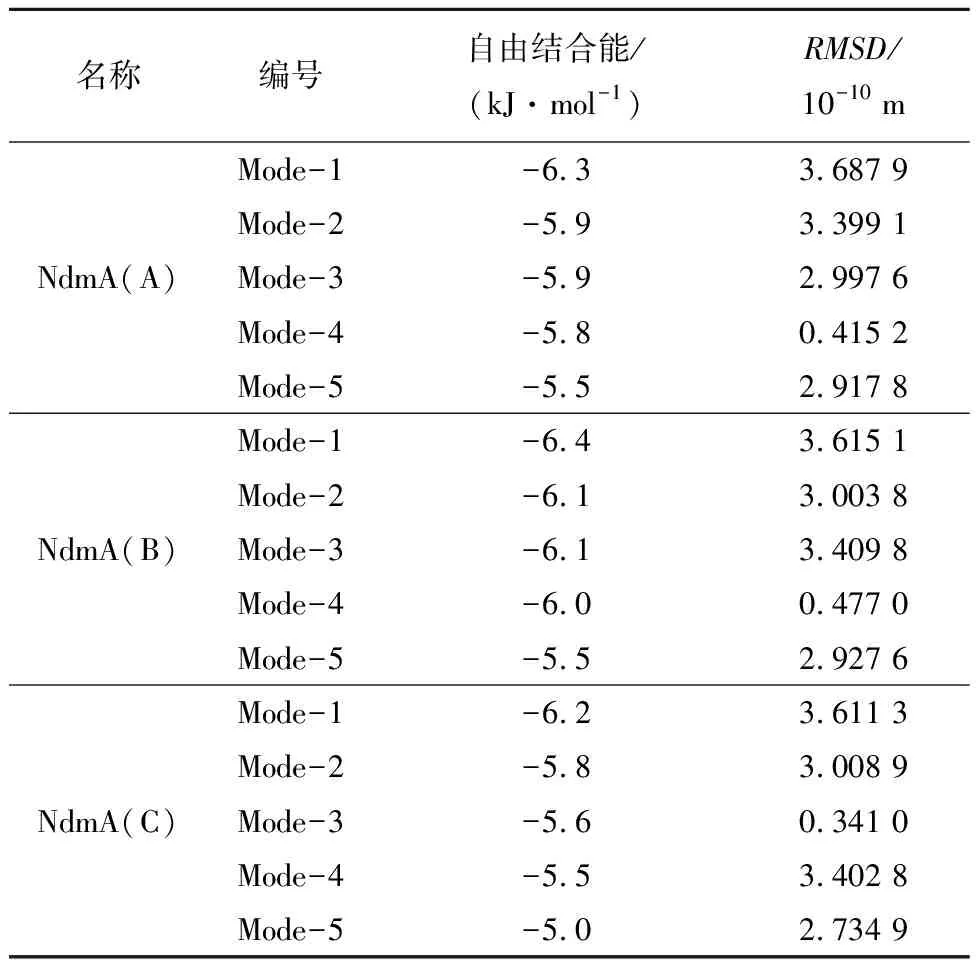
表5 NdmA与茶碱(TEP)对接结果Tab.5 Docking result of NdmA and theophylline (TEP)
(a) NdmA(A)
(b) NdmA(B)
(c) NdmA(C)
图4 茶碱与氨基酸的相互作用
Fig.4 The interaction between theophylline and amino acids
由于茶碱分子皆与NdmA之间形成π-π堆积作用,可认为茶碱与NdmA的结合较为紧密,NdmA可以较好的催化茶碱分子完成脱甲基化。
2.4 NdmAQL与可可碱(37T)对接
通过Vina软件得到的NdmAQL蛋白质与可可碱对接结果,如表6所示。从表6中结果可以发现,根据RMSD值,最优构象仅存在于A链中,在B链和C链中并无最优构象。

表6 NdmAQL与可可碱(37T)对接结果Tab.6 Docking result of NdmAQL and theobromine (37T)
对比NdmAQL(A)中Mode-4与原化合物中可可碱周围氨基酸残基相互作用情况,如图5所示。从图5可以看出,与可可碱发生相互作用的氨基酸残基皆为L248、F168、V285和L182,区别在于原化合物中F168与可可碱分子上的嘧啶环形成π-π堆积作用,由于Mode-4未与F168形成π-π 堆积作用,导致分子对接结果不理想。出现这种结果可能是计算过程所使用的软件不同,不同软件之间在构象搜寻过程中存在一定误差,故未找到最优构象。
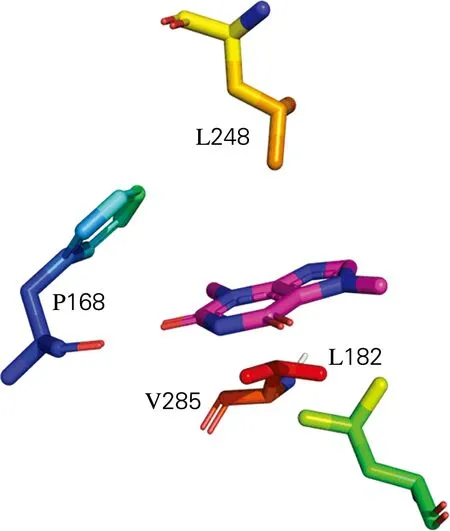
(a) Mode-4(b) 原化合物图5 NdmAQL(A)中可可碱分子对接情况对比Fig.5 Comparison of the docking status of theobrominemolecules in NdmAQL(A)
3 结 论
根据NdmA与咖啡因间的相互作用,推测N282和F168为咖啡因能够紧密结合在蛋白质的疏水空腔内的关键氨基酸残基,可以高效地完成催化氧化作用。NdmA中的F168与茶碱之间存在π-π堆积,这使得配体与蛋白质之间结合较为紧密,故配体与受体的吻合度较高,认为 NdmA对茶碱的催化效果较好。还发现在茶碱与 NdmA之间,L182、F168、P219易与茶碱上的氧原子和氢原子之间形成碳氢键。且通过分析蛋白质与小分子配体间的相互作用,推测P219和F168为茶碱能够紧密结合在蛋白质的疏水空腔内的关键氨基酸残基,可以高效地完成催化氧化作用。NdmAQL与可可碱的对接结果中,只有A链上存在与实验结果较为接近的可可碱构象,但在B链和C链中均未发现,推测可能是由于NdmAQL本身氨基酸的性质导致此结果,且在NdmAQL中,只有A链可以与可可碱结合并进行催化反应,其余部位则可能较为困难。
研究结果表明,N-脱甲基酶主要由NdmA、NdmB、NdmC、NdmD和NdmE 5种蛋白质组成,但是只有NdmA的蛋白质结构得到了较为全面且合理的解释,期待未来相关蛋白质结构能够被全部解析,深入探索咖啡因的降解机理,降低咖啡因等相关甲基黄嘌呤对环境的危害。

