健胃消食片中总黄酮含量测定
李文贵 周清瑶 刘微微
[摘要]目的建立健胃消食片中总黄酮含量测定方法,为提高该产品的质量标准提供方法依据。方法采用无水乙醇提取,聚酰胺粉吸附,甲醇洗脱,利用紫外分光光度法在360 nm波长处测定健胃消食片中总黄酮含量。结果芦丁对照品质量浓度在5.821~29.106 μg/ml范围内与吸光度线性关系良好,回归方程为Y =31.51 649X-0.0 191(r=0.9 999),平均加样回收率为96.9%,RSD=0.7%(n=9),健胃消食片中总黄酮含量测定方法可行。结论该方法操作简便、灵敏度和准确度符合要求,适用于健胃消食片中总黄酮含量测定。
[关键词]健胃消食片;总黄酮;紫外分光光度法;含量测定
[中图分类号]R286.0 [文献标识码]A [文章编号]2095-0616(2022)05-0082-05
Determination of total flavonoids in Jianwei Xiaoshi Tablets
LI Wengui ZHOU Qingyao LIU Weiwei
Quality Inspection Center,Jiangzhong Pharmaceutical Co.,Ltd,Jiangxi,Nanchang 330004,China
[Abstract] Objective To establish a method for the determination of total flavonoids in Jianwei Xiaoshi Tablets,and to provide a method basis for improving the quality standard of the product. Methods Absolute ethanol extraction,polyamide powder adsorption and methanol elution were used. The content of total flavonoids in Jianwei Xiaoshi Tablets was determined by UV spectrophotometry at 360 nm. Results The mass concentration of rutin was 5.821-29.106 μg/ml. There was a good linear relationship with absorbance in the range of the regression equation was Y =31.51 649X-0.0 191 (r=0.9 999). The average recovery was 96.9%,RSD=0.7% (n=9). The method for the determination of total flavonoids in Jianwei Xiaoshi Tablets was feasible. Conclusion The method is simple to operate,sensitive and accurate,and suitable for the determination of total flavonoids in Jianwei Xiaoshi Tablets.
[Key words] Jianwei Xiaoshi Tablet;Total flavonoids;Ultraviolet spectrophotometry;Content determination
健胃消食片由太子參、炒麦芽、山楂、山药、陈皮五味中药组成,具有健胃消食的功能[1]。该产品质量标准由中华人民共和国药典(2020年版)1部收载,标准中对橙皮昔的含量进行了测定。橙皮苷是健胃消食片中陈皮的主要有效成分,仅测定橙皮苷显得比较单一,对太子参、炒麦芽、山楂、山药药材的质量控制有待加强,以更好地控制健胃消食片的产品质量。
橙皮昔是黄酮类化合物[2],并发现太子参、炒麦芽、山楂、山药中均含有黄酮类化合物[3-6]。黄酮类化合物是广泛存在于植物界的一大类天然产物,种类繁多,是目前备受关注的天然活性物质之一[7-9]。黄酮类成分具有止咳、祛痰、平喘、助消化、护肝、抗真菌等作用[10],在医药、保健食品等方面已被广泛应用[11]。以总黄酮作为指标性成分,根据所含黄酮类化合物的结构类型、理化及光谱性质,对其进行含量测定,是中药及其他制剂质量控制的重要研究内容[12-16]。本研究旨在建立健胃消食片中总黄酮的含量测定方法,为提高健胃消食片的质量标准提供方法依据。
1 仪器与试药
UV-2550型紫外分光光度计(日本岛津公司);MS204S型天子天平(瑞士梅特勒-托利多仪器有限公司);HH-2数显恒温水浴锅(常州亿通分析仪器制造有限公司)。
芦丁对照品(中国食品药品检定研究院,纯度为91.7%,批号:100080-20181);乙醇(分析纯,西陇科学);甲醇(分析纯,广东光华科技股份有限公司);石油醚(分析纯,30~60℃,广东光华科技股份有限公司);聚酰胺粉(分析纯,浙江省台州市路桥四甲生化塑料厂);水为蒸馏水;健胃消食片(江中药业股份有限公司,国药准字Z20013220)。
2 方法与结果
2.1 溶液的配制
2.1.1 标准溶液的配制 取芦丁对照品适量,精密称定,加甲醇制成1 ml含50 μg的溶液。分别精密吸取上述溶液0、1.0、2.0、3.0、4.0、5.0 ml于10 ml容量瓶中,加甲醇稀释至刻度,摇匀既得。
2.1.2 供试品溶液的制备 取健胃消食片10片,研细,精密称取约1.5 g至锥形瓶中,精密加入25 ml 无水乙醇溶解,称重。超声提取20 min,补足减失的重量。过滤,精密移取续滤液10 ml于蒸发皿中,加1 g聚酰胺粉充分吸附完全后,于水浴上挥发聚酰胺粉表面乙醇,然后转入层析柱,先用20 ml石油醚(30~60℃)洗涤,弃去洗涤液,然后用甲醇洗脱至25 ml容量瓶中,洗脱速度为4 s/滴,收集液至刻度,摇匀既得。
2.2 测定方法
以标准溶液浓度为X坐标,对应吸光度为Y坐标,求线性回归方程,将测得的供试品溶液吸光度代人回归方程,计算供试品中总黄酮的含量。
2.3 影响因素试验
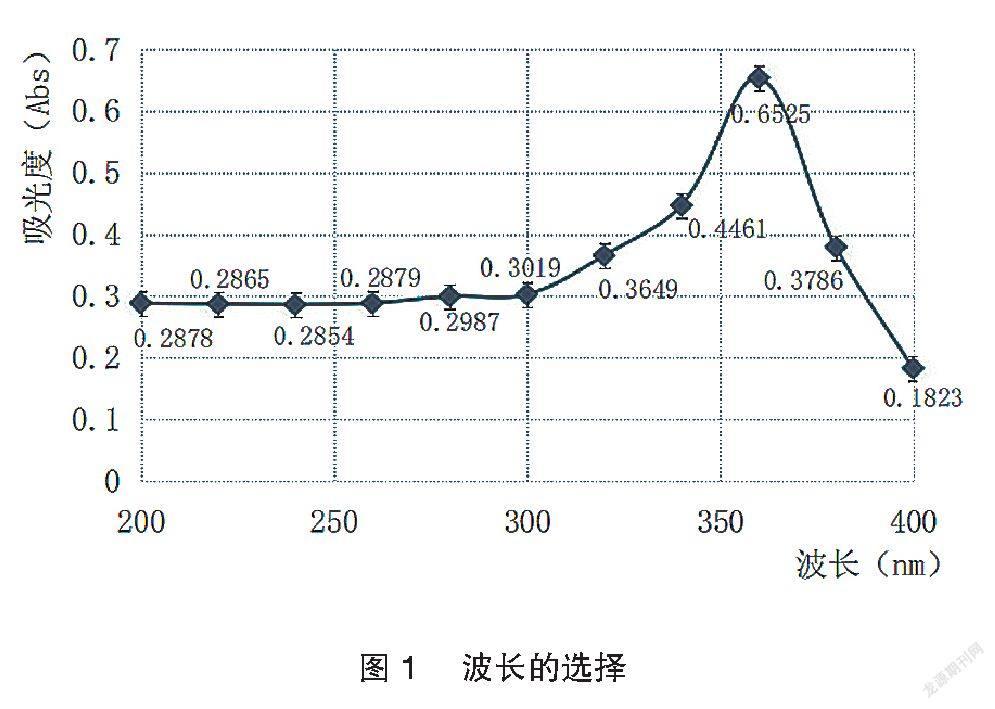
2.3.1 波长的选择 取健胃消食片粉末适量,精密称取约1.5 g至锥形瓶中,精密加入25 ml无水乙醇溶解,称重。超声提取20 min,补足减失的重量。过滤,精密移取续滤液10 ml于蒸发皿中,加1 g聚酰胺粉充分吸附完全后,于水浴上挥发聚酰胺粉表面乙醇,然后转入层析柱,先用20 ml石油醚(30~60℃)洗涤,弃去洗涤液,然后用甲醇洗脱至25 ml容量瓶中,洗脱速度为4 s/滴,收集液至刻度,摇匀既得。将收集液置于1 cm石英比色皿中,在200~400 nm波长范围进行测定,以甲醇做基线扫描。结果显示甲醇洗脱液在360 nm处有最大吸收。见图1。
2.3.2 乙醇浓度的考察 取健胃消食片粉末6份,各精密称取1.5 g至锥形瓶中,分别精密加入25 ml 的50%、60%、70%、80%、95%乙醇、无水乙醇溶解,称重。超声提取20 min,补足减失的重量。过滤,精密移取续滤液10 ml于蒸发皿中,力口1 g聚酰胺粉充分吸附完全后,于水浴上挥发聚酰胺粉表面乙醇,然后转入层析柱,先用20 ml石油醚(30~60℃)洗涤,弃去洗涤液,然后用甲醇洗脱至25 ml容量瓶中,洗脱速度为4 s/滴,收集液至刻度,摇匀既得。结果显示无水乙醇作为提取溶剂时,总黄酮含量已达最佳。见图2。
2.3.3 超声时间的考察 取健胃消食片粉末6份,各精密称取1.5 g至锥形瓶中,精密加入25 ml无水乙醇溶解,称重。分别超声5、10、15、20、25、30 min,补足减失的重量。过滤,精密移取续滤液10 ml于蒸发皿中,加1 g聚酰胺粉充分吸附完全后,于水浴上挥发聚酰胺粉表面乙醇,然后转入层析柱,先用20 ml石油醚(30~60℃)洗涤,弃去洗涤液,然后用甲醇洗脱至25 ml容量瓶中,洗脱速度为4 s/滴,收集液至刻度,摇匀既得。结果显示超声20 min,总黄酮含量已达最佳。见图3。
2.3.4 聚酰胺粉用量的考察 取健胃消食片粉末6份,各精密称取1.5 g至锥形瓶中,精密加入25 ml 无水乙醇溶解,称重。超声20 min,补足减失的重量。过滤,精密移取续滤液10 ml于蒸发皿中,分别加入0.2、0.5、1.0、1.5、2.0 g聚酰胺粉充分吸附完全后,于水浴上挥发聚酰胺粉表面乙醇,然后转入层析柱,先用20 ml石油醚(30~60℃)洗涤,弃去洗涤液,然后用甲醇洗脱至25 ml容量瓶中,洗脱速度为4 s/滴,收集液至刻度,摇匀既得。结果顯示聚酰胺粉用量为1.0 g时,总黄酮含量已达最佳。见图4。
2.3.5 洗脱液流出速度的考察 取健胃消食片粉末6份,各精密称取1.5 g至锥形瓶中,精密加入25 ml无水乙醇溶解,称重。超声20 min,补足减失的重量。过滤,精密移取续滤液10 ml于蒸发皿中,加入1.0 g聚酰胺粉充分吸附完全后,于水浴上挥发聚酰胺粉表面乙醇,然后转入层析柱,先用20 ml石油醚(30~60℃)洗涤,弃去洗涤液,然后用甲醇洗脱,分别以6、5、4、3、2、1 s/滴的速度洗脱至25 ml容量瓶中,收集液至刻度,摇匀既得。结果显示洗脱速度为4 s/滴时,总黄酮含量已达最佳。见图5。
2.3.6 收集液体积的考察 取健胃消食片粉末6份,各精密称取1.5 g至锥形瓶中,精密加入25 ml无水乙醇溶解,称重。超声20 min,补足减失的重量。过滤,精密移取续滤液10 ml于蒸发皿中,加入1.0 g聚酰胺粉充分吸附完全后,于水浴上挥发聚酰胺粉表面乙醇,然后转入层析柱,先用20 ml石油醚(30~60℃)洗涤,弃去洗涤液,然后用甲醇洗脱以4 s/滴的速度洗脱至25 ml容量瓶中,收集液分别收集至5、10、25、50、100 ml,摇匀既得。结果显示收集液收集至25 ml时,总黄酮含量已达最佳。见图6。
2.4 方法学考察
2.4.1 线性关系考察 取芦丁对照品适量,精密称定,加甲醇制成1 ml含50μg的溶液。分别精密吸取上述溶液0、1.0、2.0、3.0、4.0、5.0 ml 于10 ml 容量瓶中,加甲醇稀释至刻度,摇匀既得。以吸光度Y为纵坐标,测定浓度X为横坐标进行线性回归,得芦丁的回归方程为Y=31.51 649X-0.0 191 (r=0.9 999);表明芦丁含量在5.821~29.106μg/ml范围内其质量浓度与吸光度呈良好线性关系。
2.4.2 日内精密度试验 取健胃消食片10片,研细,精密称取约1.5 g至锥形瓶中,精密加入25 ml 无水乙醇溶解,称重。超声提取20 min,补足减失的重量。过滤,精密移取续滤液10 ml于蒸发皿中,加1 g聚酰胺粉充分吸附完全后,于水浴上挥发聚酰胺粉表面乙醇,然后转入层析柱,先用20 ml石油醚(30~60℃)洗涤,弃去洗涤液,然后用甲醇洗脱至25 ml容量瓶中,洗脱速度为4 s/滴,收集液至刻度,摇匀既得,连续测定6次。见表1。
2.4.3 日间精密度试验 取健胃消食片10片,研细,精密称取约1.5 g至锥形瓶中,精密加入25 ml 无水乙醇溶解,称重。超声提取20 min,补足减失的重量。过滤,精密移取续滤液10 ml于蒸发皿中,加1 g聚酰胺粉充分吸附完全后,于水浴上挥发聚酰胺粉表面乙醇,然后转入层析柱,先用20 ml石油醚(30~60℃)洗涤,弃去洗涤液,然后用甲醇洗脱至25 ml容量瓶中,洗脱速度为4 s/滴,收集液至刻度,摇匀既得,分别于第0、4、8、16、24、36、48、60、72 小时进行测定。见表2。
2.4.4 重复性试验 取健胃消食片粉末6份,各精密称取1.5 g至锥形瓶中,精密加入25 ml无水乙醇溶解,称重。超声20 min,补足减失的重量。过滤,精密移取续滤液10 ml于蒸发皿中,加1 g聚酰胺粉充分吸附完全后,于水浴上挥发聚酰胺粉表面乙醇,然后转入层析柱,先用20 ml石油醚(30~60℃)洗涤,弃去洗涤液,然后用甲醇洗脱至25 ml容量瓶中,洗脱速度为4 s/滴,收集液至刻度,摇匀既得,分别重复测定六次。见表3。
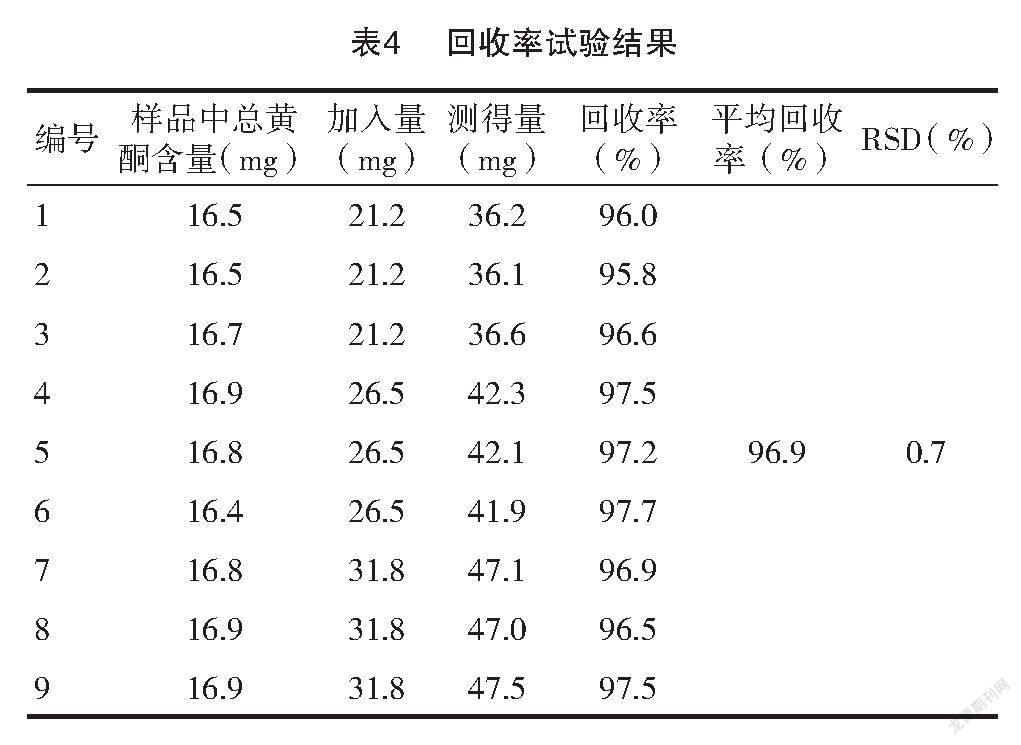
2.4.5 回收率试验 精密称取已知总黄酮含量的健胃消食片粉末约0.6 g,共9份,分别加入21.2、26.5、31.8 mg 3个不同质量的芦丁对照品,每个浓度平分3份,分别至锥形瓶中,精密加入25 ml无水乙醇溶解,称重。超声20 min,补足减失的重量。过滤,精密移取续滤液10 ml于蒸发皿中,力口1 g聚酰胺粉充分吸附完全后,于水浴上挥发聚酰胺粉表面乙醇,然后转入层析柱,先用20 ml石油醚(30~60℃)洗涤,弃去洗涤液,然后用甲醇洗脱至25 ml容量瓶中,洗脱速度为4 s/滴,收集液至刻度,摇匀既得。见表4。
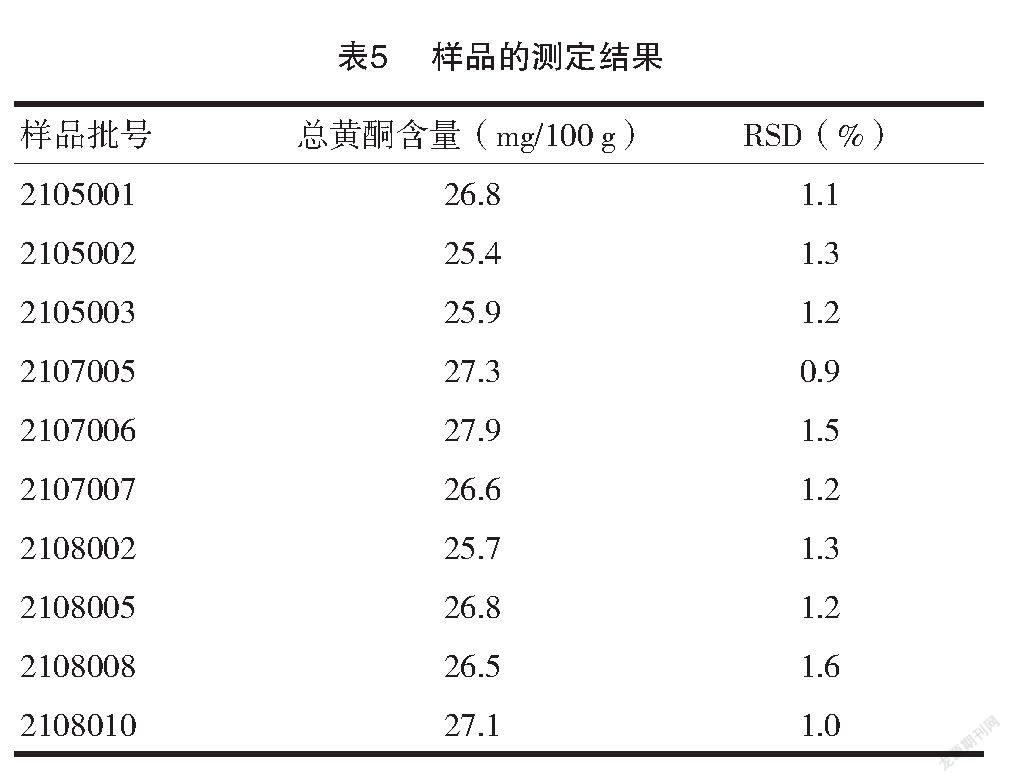
2.4.6 样品测定 取10批次的健胃消食片样品,分别研细,分别精密称取约1.5 g至锥形瓶中,精密加入25 ml无水乙醇溶解,称重。超声提取20 min,补足减失的重量。过滤,精密移取续滤液10 ml于蒸发皿中,力口1 g聚酰胺粉充分吸附完全后,于水浴上挥发聚酰胺粉表面乙醇,然后转入层析柱,先用20 ml石油醚(30~60℃)洗涤,弃去洗涤液,然后用甲醇洗脱至25 ml容量瓶中,洗脱速度为4 s/滴,收集液至刻度,摇匀既得。见表5。
2.5 结果
通过对健胃消食片总黄酮含量测定的各影响因素研究(包括波长的选择、乙醇浓度的考察、超声时间的考察、聚酰胺粉用量的考察、洗脱液流出速度的考察、收集液体积的考察),建立了健胃消食片总黄酮含量测定方法。该方法的精密度、重复性、线性关系、回收率均符合要求,证明该方法稳定可靠,可用于健胃消食片中总黄酮的含量测定。
3 讨论
江中牌健胃消食片是由太子参、山楂、炒麦芽、山药、陈皮药材提取而成的中药制剂,功效显著,口碑良好,在市场上属于畅销产品。为了更好地控制产品质量,本研究建立了总黄酮含量测定方法。
芦丁是典型的黄酮类化合物,在测定总黄酮时,通常以芦丁作为对照品[17-19]。在考察洗脱液流速时,实际操作中由于样品杂质的影响,易出现洗脱液流出越来越慢的现象,应根据实际情况调节层析柱的阀门开关。聚酰胺粉在吸附样品溶液时需充分吸附完全,同时在转移至蒸发皿时应尽可能转移完全,必要时使用甲醇润洗,润洗液在石油醚洗脱后、甲醇洗脱前加入层析柱。本研究还比较了甲醇与乙醇作为提取溶剂时,它们的提取效果是否存在差异。通过实验发现,二者提取效果无显著性差异,考虑到安全及方便易取,因此选择乙醇作为提取溶剂。
从样品测定结果中可以看出,10批次测定结果比较稳定,总黄酮在25.4~27.9 mg/100 g范围内波动,具有一定的特征范围。由于本研究未对市场上不同厂家的健胃消食片进行研究,因此下一步将继续研究。
[参考文献]
[1]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2020:1474-1475.
[2]张风亭,胡坦,潘思轶.橙皮苷生物学活性及其改性技术的研究进展[J].食品工业科技,2021,9 (24):1-13.
[3]滕力庆,周涛,王晓,等.太子参化学成分及其药理作用研究进展[J].食品与药品,2021,23 (1):73-79.
[4]陶佳哈,龚晓云,邹吉利,等.HPLC法同时测定麦芽总碱提取物中生物碱及麦黄酮的含量[J].中药新药与临床药理,2020,31(1):102-103.
[5]张祺嘉钰,赵佩媛,孙静,等.山楂的化学成分及药理作用研究进展[J].西北药学杂志,2021,36 (3):521-522.
[6]林鹏,李银保.山药的化学成分及其生物活性研究进展[J].广东化工,2015,118(23):118-119.
[7]张德馨,王淑华,孙仟,等.山楂叶总黄酮提取工艺与药理作用研究进展[J].食品与药学,2021,23 (4):380-384.
[8]魏磊,王伟,侯理莹,等.葛叶总黄酮的提取工艺优化及抗菌抗氧化能力研究[J].安徽农业科学,2021,49(14):152-156,161.
[9]杨秀华,智慧,艾丹.广枣总黄酮对三氧化二砷诱导心肌细胞损伤的作用[J].中国医药导报,2021,18 (20):25-29.
[10]张敏,李志英.不同中药总黄酮含量测定方法的选择研究[J].湖南师范大学学报,2017,30 (3):307-310.
[11]于村,俞莎,沈向红.保健食品中总黄酮测定方法的研究[J].中国卫生检验杂志,2002,1 (4):401-402.
[12]任珊珊,包保全,毛婷,等.中药中总黄酮的含量测定方法研究进展[J].北方药学,2015,12(3):112-115.
[13]赵超,陈华国,龚小见,等.杠板归的化学成分研究(II)[J].中草药,2010,41(3):365-367.
[14]董玉,王爱民,陈朝军,等.文冠木中总黄酮的含量测定方法研究[J].内蒙古医学院学报,2008,30 (15):364-366.
[15]陈惠红,黄婳,项小甄.鹅不食草总黄酮的含量测定方法研究[J].中国药业,2008,17 (21 ):9-10.
[16]张明,陈国华,赵超,等.杠板归中总黄酮的含量测定研究[J].中国实验方剂学杂志,2012,18(18):70-73.
[17]黄晓霞,张舒,叶栩萌.蒲黄炒炭前后总黄酮的含量变化[J].广东化工,2021,48 (15):57-58.
[18]沈高扬,谭伟.车前草中总黄酮的测定及其抗氧化性能研究[J].粮食与油脂,2020,33 (9):95-97.
[19]黄冬梅,饶冬荣.紫外分光光度法测定健儿清解液中总黃酮的含量[J].广东化工,2021,48 (13):202-203.

