改性多孔淀粉包埋肉桂精油和焦亚硫酸钠微胶囊的制备及性质研究
曹俊英, 徐 超, 章 中*
(1. 宁夏大学 食品与葡萄酒学院,宁夏 银川 750021;2. 宁夏昊王米业集团有限公司,宁夏 银川 750021)
焦亚硫酸钠(Na2S2O5)是一种常见的食品添加剂,通常被用在果蔬的保鲜中,尤其在葡萄的保鲜中较为常见;肉桂精油(CEO)因其具有较强的抑菌效果而得到广泛的使用。 在保鲜行业,通常将单一的焦亚硫酸钠或者肉桂精油应用在果蔬中,二者同时应用鲜少报道。
微胶囊的壁材起着固定和包覆的作用,壁材应具有较好的乳化性及稳定性[1-3],因此微胶囊壁材的选择至关重要。 单一的多孔淀粉也可以用作壁材,但是制备出的微胶囊并不稳定。 目前多项研究表明,两种或两种以上壁材的复合使用有利于提高微胶囊负载量以及稳定性等。 黄原胶是相对长的刚性阴离子多糖,由微生物发酵产生,是一种非吸附性多糖,具有高表观黏度、强剪切稀化特性和强增稠能力[3]。 因此,作者选用改性碎米多孔淀粉与黄原胶复合后,对肉桂精油和焦亚硫酸钠进行包埋形成微胶囊,研究其缓释和抑菌效果,后续可以应用在果蔬的保鲜领域中。
1 材料与方法
1.1 实验材料与试剂
改性多孔淀粉:作者所在实验室自制;黄原胶(AR)、焦亚硫酸钠(AR):上海麦克林生化科技有限公司产品;肉桂精油:吉安市华硕香料油有限公司产品;无水乙醇(AR):天津市大茂化学试剂厂制造;二氧化硫速测盒:广东达元绿洲食品安全科技股份有限公司产品;大肠杆菌、酵母菌、枯草芽孢杆菌:宁夏食品微生物应用技术与安全控制重点实验室提供;一次性培养皿:浙江博美特医用塑料有限公司产品;LB 培养基、YPD 培养基: 北京索莱宝科技有限公司产品。
1.2 实验仪器与设备
TCL-10B 高速离心机:上海安亭科学仪器厂制造;FTIR S2 傅里叶变换红外光谱仪: 美国PERKIN ELMER 公司产品;ZEISS EV018 扫描电镜: 德国卡尔蔡司公司产品;UV-9000S 双光束紫外可见分光光度计:上海元析仪器有限公司产品;JDG-0.2 真空冻干试验机: 兰州科进真空冻干技术有限公司产品;Agilent7890B-5977B 气相色谱质谱联用仪:安捷伦公司产品;BSP-250 生化培养箱: 上海博讯实业有限公司产品医疗设备厂制造;LRH-150-B 生化培养箱: 韶关市泰宏医疗器械有限公司产品;D8 A25型X 射线衍射仪:德国布鲁克有限公司产品;FA25超净工作台: 北京东联哈尔仪器制造有限公司产品;均质机:佛鲁克(上海)有限公司产品;高压灭菌锅:上海申安医疗器械厂制造。
1.3 实验方法
1.3.1 肉桂精油的GC-MS 成分测定 使用气相色谱质谱联用仪测量肉桂精油的成分。 色谱柱为DB-5MS 毛细管柱(30 m×0.25 mm×0.25 μm)。 离子源温度为230 ℃,电离电压为70 eV。 初始柱温50 ℃,保持5 min; 以5 ℃/min 速度升至150 ℃, 并保持2 min;然后以10 ℃/min 升至280 ℃,保持5 min;最后进入质谱进行定性分析[4-7]。
1.3.2 改性碎米多孔淀粉包埋肉桂精油和焦亚硫酸钠微胶囊的制备 根据Li 等的方法[8]做了简单的修改,称取0.25 g 黄原胶放入热水中,同时进行搅拌,黄原胶完溶解后,用高速均质机均质2 min,静置24 h 后冷藏备用。 吸取3.35 mL 肉桂精油加入5.0 g 改性碎米多孔淀粉中,混合均匀,用保鲜膜封口后在冰箱冷藏30 min 后取出,称取多孔淀粉质量1%的焦亚硫酸钠溶解在黄原胶溶液中,再加入改性多孔淀粉和肉桂精油中,温和均质2 min,在磁力搅拌1 h,待溶液冷却至室温后,放入冰箱中冷藏静置24 h,离心后冷冻干燥5 h,将样品放在棕色玻璃瓶中并保存在冰箱(4 ℃)中备用。 其他配制比例微胶囊按上述方法进行制备。
1.3.3 包埋率的测定 焦亚硫酸钠包埋率用二氧化硫试剂盒测定。 肉桂精油包埋率测定:精确称量0.1 g 微胶囊样品并与10 mL 无水乙醇混合,使用涡旋器涡旋分散5 min, 浸泡24 h, 使微胶囊充分释放,将该溶液用无水乙醇定容至50 mL 后,从中取10 mL 液体,以2000 r/min 的速度离心10 min,取上清液1 mL 用无水乙醇定容至10 mL, 使用紫外可见分光光度计测定其在287 nm 处的吸光度, 利用标准曲线计算上清液中肉桂精油的体积[9]。 用以下方程式计算肉桂精油包埋率:
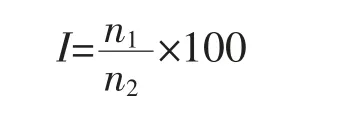
式中:I 为包埋率,%;n1、n2分别代表被包裹入微胶囊的精油总体积和开始加入精油的总体积,mL。
1.3.4 微胶囊的形态表征 在粘贴有导电双面胶带的铝制样品架上均匀地涂覆少许原淀粉、超声处理淀粉和改性多孔淀粉粉末,用金溅射涂布机在真空状态下给样品镀一层薄薄的金层,通过SEM 在3 kV 的加速电压下对淀粉的表面形态特征予以观察。
1.3.5 淀粉颗粒X-晶体射线衍射测定 使用X 射线衍射仪(XRD)分析样品的结晶形态及结晶度。 样品于45 ℃烘箱中烘干处理12 h。 在40 kV 的电压和40 mA 的电流下运用Cu-Kα 辐射 (K-Alpha1=1.540598,K-Alpha2=1.544426,K-Alpha2/K-Alpha1=0.5)。 固定发散狭缝值为0.38 mm,规定5~40°(2θ)扫描范围。
1.3.6 傅里叶变换红外光谱分析 用FTIR S2 傅里叶变换红外光谱仪测定改性碎米多孔淀粉和微胶囊的红外光谱。 将不同样品与固体KBr 粉末混合,并将约40 mg 该混合物颗粒干燥制成片剂进行测定。 在500~4000 cm-1的波数范围内记录透射率。
1.3.7 微胶囊缓释性能测定 肉桂醛累积释放率的测定[10]:选取包埋率最佳的肉桂精油微胶囊、肉桂精油和焦亚硫酸钠微胶囊,分别记作MPS/XG-CEO和MPS/XG-CEO/Na2S2O5,对这2 组微胶囊进行肉桂醛累积释放率的测定。 具体测定方法:挑选2 个相同规格的敞口杯, 用蒸馏水清洗干净烘干后备用,分别称取一定质量的2 种微胶囊放置于杯中,避光、敞口、室温放置,每隔4 d 测定其释放率。
二氧化硫累积释放率的测定:选取包埋率最佳的含有焦亚硫酸钠的微胶囊 (MPS/XG-CEO/Na2S2O5)组进行二氧化硫累积释放率的测定。 具体测定方法:挑选相同规格的带盖保鲜盒,用蒸馏水清洗干净烘干后备用,称取一定质量的微胶囊放置于保鲜盒中,室温封口放置,每隔4 d 用二氧化硫试剂盒测定二氧化硫释放率。
1.3.8 微胶囊的抑菌效果实验 分别制备LB 培养基和YPD 培养基备用。 选取大肠杆菌、枯草芽孢杆菌、酵母菌和霉菌作为供试菌种。 分为3 组:肉桂精油组、MPS/XG-CEO 组和MPS/XG-CEO/Na2S2O5组。利用梯度稀释法将过夜培养的大肠杆菌、枯草芽孢杆菌、 酵母菌和霉菌的菌悬液稀释至一定浓度,取100 μL 用涂布棒均匀涂在平板上,用已灭过菌的滤纸片分别浸泡精油和微胶囊湿囊后平稳置于已接好菌的平板培养基中间, 用无菌水作为对照组,每组设3 个平行,将上述平板分别置于37、28 ℃恒温培养箱中培养,采用十字交叉法测定菌圈直径[11],取平均值。
1.3.9 数据处理 采用Origin 8.0、TBtools 和The Unscrambler X 10.4 软件构建图。
2 结果与分析
2.1 肉桂精油的GC-MS 成分分析
为了探究肉桂精油中起抑菌作用的主要物质,采用GC-MS 对肉桂精油的化学成分进行检测 (见图1),计算结果如表1 所示。由此表可知,共鉴定出21 种肉桂精油化合物, 占肉桂精油总质量的99.99%, 其中相对含量较多的主要成分为醛类(78.85%),在醛类中又主要以肉桂醛(46.17%)和2’-甲氧基肉桂醛(20.09%)为主,此结果和孙凤蕊的结果[12]一致。
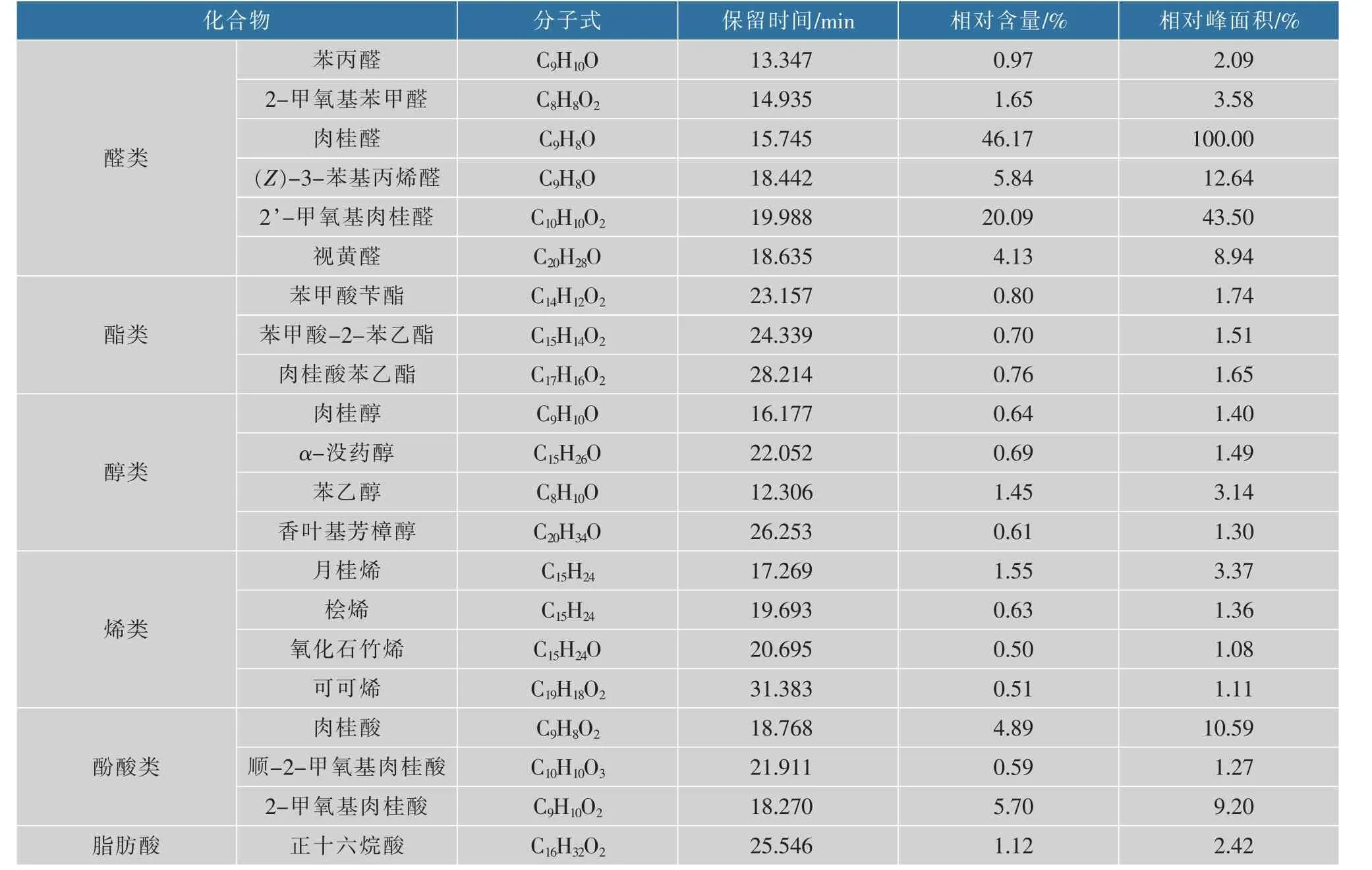
表1 肉桂精油的成分Table 1 Components of cinnamon essential oil
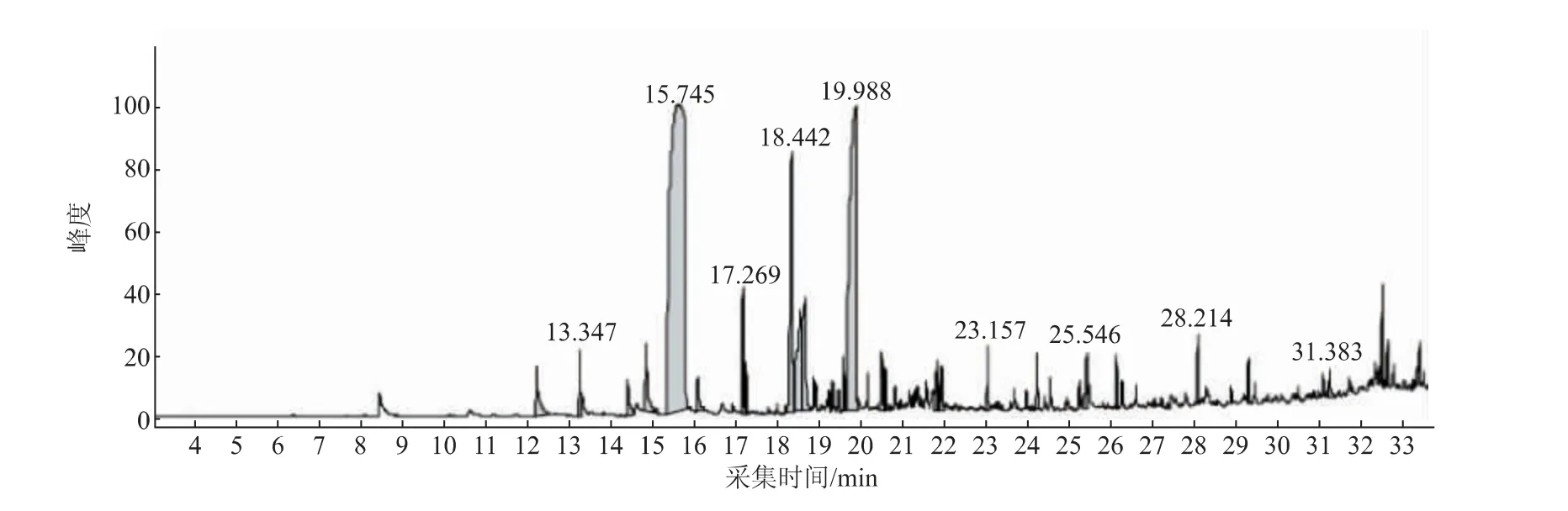
图1 肉桂精油的总离子流图Fig. 1 Total ion flow diagram of cinnamon essential oil
图2 是肉桂精油成分的TBtools 聚类热图分析。 对同种肉桂精油样品成分进行了3 次平行聚类分析,以热图的形式显示结果。 由图2 可以看出,肉桂精油挥发性成分主要分为5 类: 醛类、 酯类、醇类、烯类、酚酸类;醛类中又主要以肉桂醛占比最多(66.26%)。
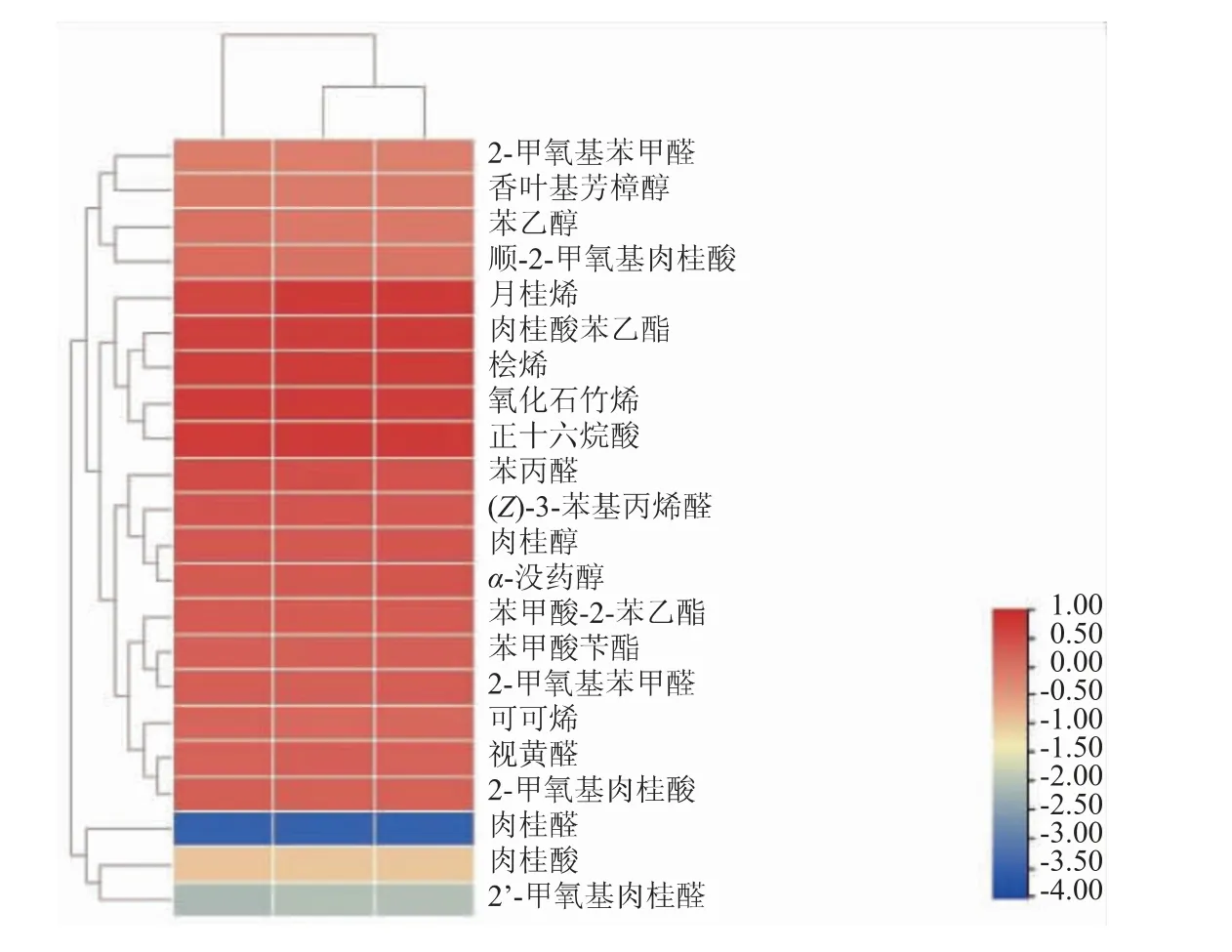
图2 肉桂精油的TBtools 聚类热图分析Fig. 2 TBtools heat map analysis of cinnamon essential oil
由图3 可知,3 次肉桂精油样品点之间的距离较近或重叠, 说明肉桂精油样品的3 次重复性较好,得到的数据较稳定[13];共提取出2 个主要挥发成分, 第一主成分PC-1 肉桂醛对抑菌效果的贡献率为100%, 这和肉桂精油定性化合物鉴定报告结果相同,基本代表了肉桂精油样品的全部特征信息[14],说明肉桂精油中起抑菌作用的主要物质是肉桂醛。该结果和图2 肉桂精油成分的TBtools 聚类热图分析结果相似。

图3 肉桂精油PCA 分析Fig. 3 PCA analysis of cinnamon essential oil
2.2 微胶囊的包埋率计算
用MPS/XG 作为双壁材包埋CEO 和Na2S2O5的多种微胶囊的CEO 包埋率和Na2S2O5包埋率如表2~3 所示。 肉桂精油微胶囊 (MPS/XG-CEO)中CEO 的包埋率随着MPS/XG 质量比减少和肉桂精油的添加量的增多而随之提高, 但影响不显著,可能是由于改性多孔淀粉的黏度到了一定程度后其变化不再显著提高CEO 的包埋率和Na2S2O5的包埋率[15]。芯材中CEO 与MPS 体积质量比为0.67 mL∶1 g 和0.78 mL∶1 g 时肉桂精油的包埋率相差 (1.5±0.5)%,相差范围较小,考虑到肉桂精油的成本,选取肉桂精油添加量为0.67 mL/g(以改性多孔淀粉质量计); 肉桂精油和焦亚硫酸钠微胶囊 (MPS/XGCEO/Na2S2O5)中CEO 的包埋率和Na2S2O5的包埋率有着同样的现象。 因此,制备肉桂精油微胶囊(MPS/XG-CEO)的最适条件是m(MPS)∶m(XG)=20∶1、V (CEO)∶m (MPS)=0.67 mL∶1 g,CEO 的包埋率为69.75%; 制备肉桂精油和焦亚硫酸钠微胶囊(MPS/XG-CEO/Na2S2O5)的最适条件是m(MPS)∶m(XG)=20∶1、V(CEO)∶m(MPS)=0.67 mL∶1 g,m(Na2S2O5)∶m(MPS)=1∶100,CEO 的包埋率为68.73%,Na2S2O5的包埋率为72.42%;总体而言,改性多孔淀粉和黄原胶作壁材具有良好的负载肉桂精油和焦亚硫酸钠的潜力。
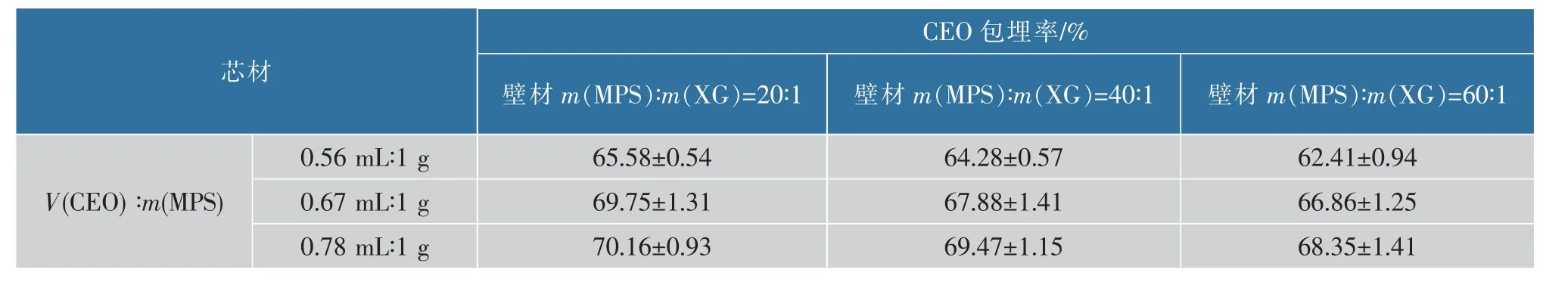
表2 肉桂精油微胶囊的包埋率Table 2 Embedding rate of CEO microcapsules
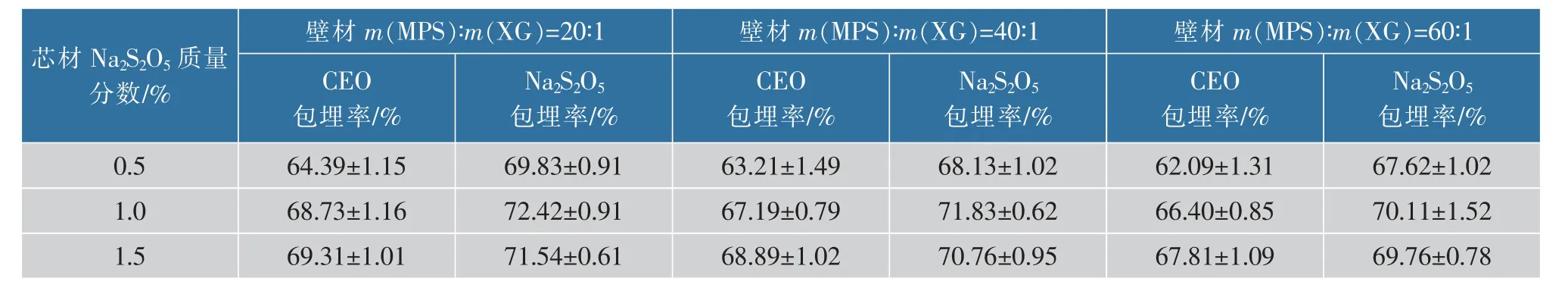
表3 肉桂精油和焦亚硫酸钠微胶囊的包埋率Table 3 Embedding rate of CEO and Na2S2O5 microcapsules
2.3 微胶囊的形态表征
通过图4 发现,经冷冻干燥后的微胶囊在外观上和改性多孔淀粉相似, 因内部吸附了肉桂精油、焦亚硫酸钠,壁材添加了黄原胶的原因,微胶囊球的棱角略减弱,表面略光滑,说明黄原胶的加入可能使得通过非共价键结合的多孔改性淀粉和肉桂精油结合更加牢固[16]。

图4 微胶囊和改性多孔淀粉的SEM 图像Fig. 4 SEM images of microcapsules and MPS
2.4 微胶囊的XRD 分析
为了研究包埋对肉桂精油和焦亚硫酸钠结晶度的影响, 进行了XRD 测定。 MPS、Na2S2O5、XG、MPS/XG-CEO、MPS/XG-CEO/Na2S2O5、MPS/XG 的XRD 光谱图在2θ 为5~40°的特征衍射峰如图5 所示。原始Na2S2O5在19、20、21、22、32、34、37°处显示特征峰。 但观察图5 中的MPS/XG-CEO/Na2S2O5曲线发现, 当焦亚硫酸钠被包埋在MPS/XG 中时,焦亚硫酸钠的以上特征峰消失,这说明焦亚硫酸钠已被成功包埋[17]。MPS/XG-CEO 微胶囊的XRD 图谱与普通MPS/XG 的XRD 图谱不同。 MPS/XG-CEO 和MPS/XG-CEO/Na2S2O5微胶囊的图谱均显示4 个主要峰,分别位于2θ 为15.9、17.02、17.36、22.9°,以及2θ 为15.1、16.86、17.01、22.6°, 与MPS、MPS/XG 相比,微胶囊的特征峰都发生了向左偏移。 MPS 光谱峰变化 表 明,MPS/XG-CEO 和MPS/XG-CEO/Na2S2O5的络合是成功的。 Munhuweyi 等也报道了对于肉桂精油在微胶囊中的包封[16],与本文中结论类似。

图5 MPS、Na2S2O5、XG、MPS/XG-CEO、MPS/XG-CEO/Na2S2O5、MPS/XG 的X 晶体衍射图Fig. 5 X crystal diffraction pattern of MPS、Na2S2O5、XG、MPS/XG-CEO、MPS/XG-CEO/Na2S2O5、MPS/XG
2.5 微胶囊的FTIR 分析
将肉桂精油和焦亚硫酸钠及改性多孔淀粉和黄原胶的FTIR 光谱与MPS/XG、MPS/XG-CEO、MPS/XG-CEO/Na2S2O5进行了比较(见图6),以确定壁材(MPS/XG)和芯材(肉桂精油和焦亚硫酸钠)直接的相互作用。 肉桂精油在1626 cm-1和1677 cm-1处显示特征峰, 对应于苯环的拉伸吸收和醛基的C=O 的拉伸[18];肉桂精油在748 cm-1和682 cm-1处的明显吸附峰分别归因于苯环和烯烃的C—H 振动。 傅里叶变换红外光谱分析表明,在将肉桂精油包含到改性多孔淀粉和黄原胶基质中时,微胶囊的特定波段位置存在差异。 由于在微胶囊形成过程中客体分子失去振动和弯曲, 对于MPS/XG-CEO 和MPS/XG-CEO/Na2S2O5的红外光谱, 两个FTIR 波段几乎完全被非常强烈和宽广的MPS 波段所掩盖。所制备的微胶囊在3430-1和3438 cm-1处的—OH 基团的吸收带经历了光谱的显著展宽, 并且峰向较低频率3390 cm-1移动。 微囊化后FTIR 的变化表明肉桂精油、焦亚硫酸钠和改性多孔淀粉之间通过氢键发生了相互作用, 此外,MPS/XG-CEO、MPS/XG-CEO/Na2S2O5的微胶囊中CEO 的吸收在748 cm-1处消失,在1124 cm-1处的吸收减弱,在2927 cm-1处的吸收加强;MPS/XG-CEO/Na2S2O5的微胶囊中Na2S2O5的吸收在651 cm-1处消失,在1185 cm-1处的吸收减弱,在1630 cm-1处的吸收加强。红外光谱吸收的变化表明肉桂精油和Na2S2O5与改性多孔淀粉和黄原胶相互作用形成了MPS/XG-CEO、MPS/XG-CEO/Na2S2O5, 与Yang 等 的 研 究 结 果[15]类似。

图6 肉桂精油、 改性多孔淀粉、Na2S2O5、 XG、MPS/XGCEO、MPS/XG-CEO/Na2S2O5、 MPS/XG 的傅里叶变换红外光谱图Fig. 6 Fourier infrared spectra of cinnamon essential oil,MPS,Na2S2O5,XG,MPS/XG-CEO,MPS/XGCEO/Na2S2O5,MPS/XG
2.6 微胶囊的缓释性能分析
如图7 所示,常温贮藏期间,2 组微胶囊包埋的肉桂精油中主要成分肉桂醛的累积释放率逐步增加,说明肉桂醛在被改性多孔淀粉和黄原胶包埋后能够逐步释放到环境中,结果证实了以改性多孔淀粉和黄原胶为壁材制备的微胶囊能够有效控制肉桂精油的释放,减少肉桂精油损失[18]。 2 组微胶囊在前3 天的释放速率都明显较快,这是因为刚开始的时候微胶囊内部含有较多的肉桂精油,较大的内外压力差造成的[19]。 经过24 d 的释放后,MPS/XGCEO 和MPS/XG-CEO/Na2S2O5的累积释放率分别为73.00%、77.88%,释放速率相当。
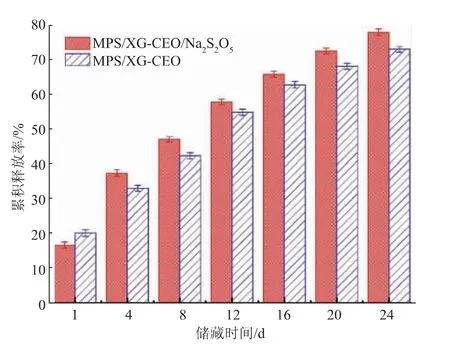
图7 室温24 d 内微胶囊中肉桂醛累积释放率Fig. 7 Cumulative release rate of cinnamaldehyde in microcapsules within 24 days at room temperature
改性多孔淀粉和黄原胶包埋肉桂精油和焦亚硫酸钠后,焦亚硫酸钠通过与散布在微胶囊周围的水蒸气反应,生成二氧化硫,再通过改性多孔淀粉上的孔洞来扩散和释放[20]。 如图8 所示,贮藏期间,MPS/XG-CEO/Na2S2O5中二氧化硫累积释放率逐步增加,前期和后期释放速率缓慢,中间释放速率稍快,可能是储藏中期保鲜盒中的水蒸气增多,导致湿度增多,二氧化硫的释放率变快,说明焦亚硫酸钠在被改性多孔淀粉和黄原胶包埋后能够生成二氧化硫并逐步释放到环境中。 结果证实了以改性多孔淀粉和黄原胶为壁材制备的焦亚硫酸钠微胶囊能够有效控制二氧化硫的释放。

图8 24 d 内微胶囊中二氧化硫累积释放率Fig. 8 Cumulative release rate of sulfur dioxide in microcapsules within 24 days
2.7 微胶囊的抑菌效果分析
肉桂精油和其微胶囊对大肠杆菌、枯草芽孢杆菌、酵母菌和霉菌的抑制效果如表4 所示。 由表中可以看出,在对大肠杆菌的抑制实验中:第1 天时,肉桂精油组、MPS/XG-CEO 组和MPS/XG-CEO/Na2S2O5组的抑菌圈直径分别是19.68、14.12、15.89 mm,第2 天时分别为9.63、12.19、13.48 mm,可见第1 天肉桂精油的抑菌圈直径大于两组微胶囊的抑菌圈直径,但是在第2 天快速下降,而两组微胶囊的抑菌圈直径下降速度平缓;第3 天时,肉桂精油组的抑菌圈直径下降至5.26 mm,MPS/XG-CEO 和MPS/XG-CEO/Na2S2O5两组微胶囊的抑菌圈直径分别为10.27、11.24 mm。

表4 肉桂精油和微胶囊对大肠杆菌、枯草芽孢杆菌、酵母菌和霉菌的抑菌效果Table 4 Antibacterial effect of cinnamon essential oil and its microcapsules on E. coli,Bacillus subtilis, yeast and mold
在对枯草芽孢杆菌的抑制实验中: 第1 天时,肉桂精油组、MPS/XG-CEO 组和 MPS/XG-CEO/Na2S2O5组的抑菌圈直径分别是21.86、18.36、19.63 mm,第2 天时分别为9.32、16.35、18.26 mm,可见第1 天肉桂精油的抑菌圈直径大于两组微胶囊的抑菌圈直径,但是在第2 天快速下降,而两组微胶囊的抑菌圈直径下降速度平缓;第3 天时,肉桂精油的抑菌圈直径下降至6.37 mm,MPS/XG-CEO 和MPS/XG-CEO/Na2S2O5两组微胶囊的抑菌圈直径分别为13.65、15.39 mm。
在对酵母菌的抑制实验中:第1 天时,肉桂精油 组、MPS/XG-CEO 组 和MPS/XG-CEO/Na2S2O5组的抑菌圈直径分别是41.02、32.25、36.59 mm, 第2天时分别为28.36、29.59、35.24 mm, 可见第1 天肉桂精油的抑菌圈直径大于两组微胶囊的抑菌圈直径,但是在第2 天快速下降,而两组微胶囊的抑菌圈直径下降速度平缓;第3 天时,肉桂精油的抑菌圈直径下降至14.23 mm,MPS/XG-CEO 和MPS/XG-CEO/Na2S2O5两组微胶囊的抑菌圈直径分别为27.65、33.56 mm。
在对霉菌的抑制实验中:第1 天时,肉桂精油组、MPS/XG-CEO 组和MPS/XG-CEO/Na2S2O5组的抑菌圈直径分别是44.38、42.41、43.30 mm, 第2 天时分别为29.31、35.24、39.53 mm, 可见第1 天肉桂精油的抑菌圈直径大于两组微胶囊的抑菌圈直径,但是在第2 天快速下降,而两组微胶囊的抑菌圈直径下降速度平缓;第3 天时,肉桂精油的抑菌圈直径下降至15.61 mm,MPS/XG-CEO 和MPS/XGCEO/Na2S2O5两组微胶囊的抑菌圈直径分别为30.28、36.56 mm。
实验结果表明肉桂精油和其微胶囊对大肠杆菌、枯草芽孢杆菌、酵母菌和霉菌的抑制效果存在共同的特点(见图9)。随着实验时间的增加,纯肉桂精油及其微胶囊的抗菌活性随之减弱,微胶囊表现出比纯肉桂精油更持久的抗菌性能[12]。 培养24 h后,纯肉桂精油及其微胶囊对大肠杆菌、枯草芽孢杆菌、酵母菌和霉菌都具有明显的抑制作用,且纯肉桂精油的抑菌圈直径最大,但当培养时间延长至48~72 h 时,纯肉桂精油的抑菌效果明显降低,反而微胶囊的抑菌效果较好。 这是由于肉桂精油极其不稳定,极易挥发,在第1 天就大量释放出来,而微胶囊里的改性多孔淀粉和黄原胶可以良好地保护肉桂精油,降低其不稳定性,使得抑菌物质慢慢释放,延长肉桂精油的抑菌作用发挥时间[21-22]。 另外,对比表4 和图9 可知,肉桂精油及其微胶囊对霉菌和酵母菌的抑制作用强于枯草芽孢杆菌和大肠杆菌,且在抑制效果的持久力方面,肉桂精油和焦亚硫酸钠微胶囊(MPS/XG-CEO/Na2S2O5)的抑菌时间最长,肉桂精油微胶囊(MPS/XG-CEO)次之,纯肉桂精油最差。 肉桂精油中的肉桂醛等物质会使细胞内含物向外渗透,阻碍细胞正常代谢最终导致死亡[23],霉菌和酵母菌的化学组成相对简单,而大肠杆菌和枯草芽孢杆菌的结构较为丰富,这类型结构对细胞有一定程度的保护效果[24]。将肉桂精油微胶囊化后,肉桂精油的挥发性成分受到保护,并且这些挥发性成分在微胶囊化后损失缓慢且较少。 因此,微胶囊中肉桂精油强大的抗菌性能得以长期保留[12]。
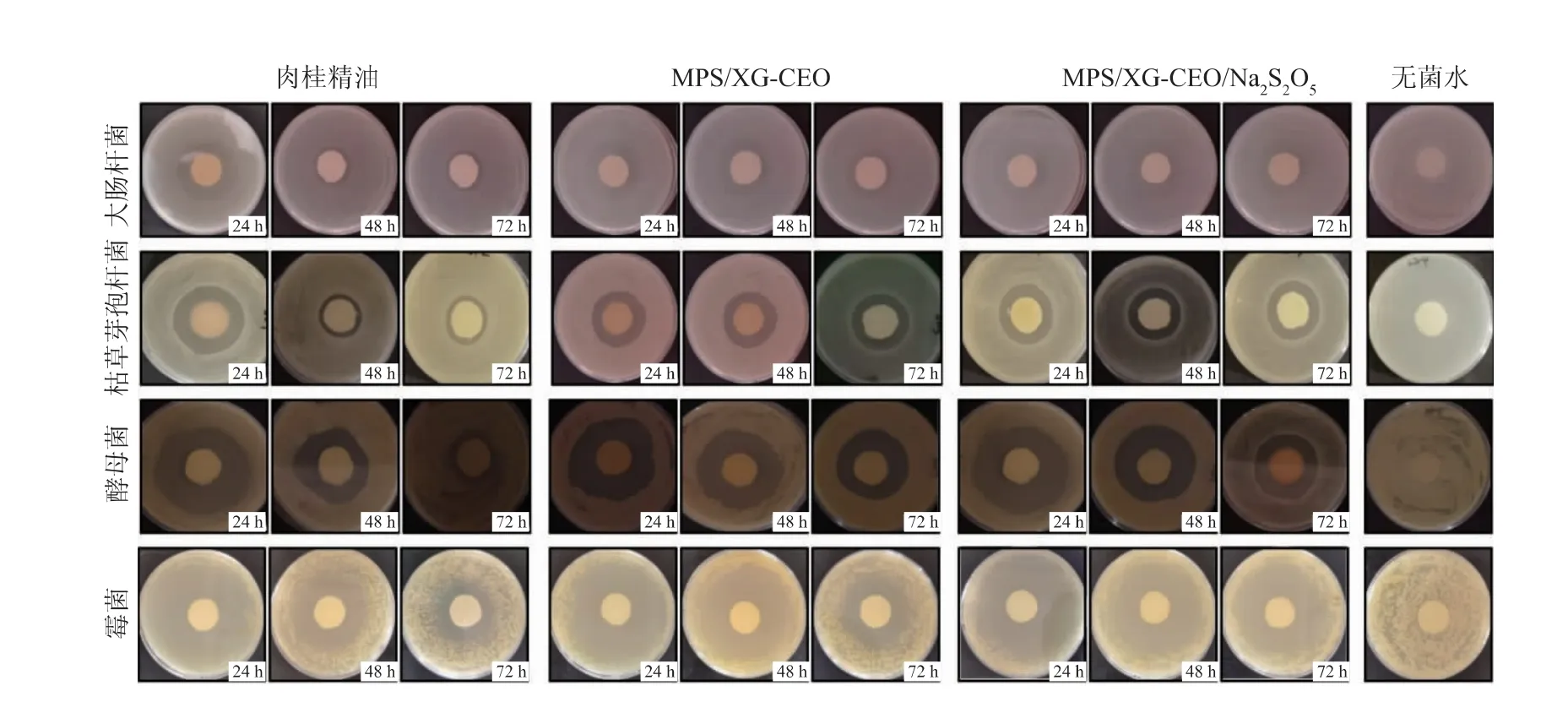
图9 肉桂精油和其微胶囊对大肠杆菌、枯草芽孢杆菌、酵母菌和霉菌的抑菌效果Fig. 9 Antibacterial effect of cinnamon essential oil and its microcapsules on E. coli, Bacillus subtilis, yeast and mold
3 结语
在常温环境中,两组微胶囊包埋的肉桂醛的累积释放率逐步增加,证实了以改性多孔淀粉和黄原胶为壁材制备的微胶囊能够有效控制肉桂精油的释放,减少精油挥发;储藏期间,肉桂精油和焦亚硫酸钠微胶囊(MPS/XG-CEO/Na2S2O5)中的二氧化硫的累积释放率也逐步增加;通过滤纸片法分析了肉桂精油及其两组微胶囊对大肠杆菌、 枯草芽孢杆菌、酵母菌和霉菌的抑菌效果,结果表明对4 种菌均有明显的抑制效果,且根据敏感指数大小,4 种菌的排序为霉菌>酵母菌>枯草芽孢杆菌>大肠杆菌。上述结论表明,肉桂精油和焦亚硫酸钠被微胶囊化后,其稳定性得到了显著提高,为植物精油和焦亚硫酸钠的应用拓宽了范围,因此可以更好地将两种类型物质微胶囊应用在保鲜领域中。

