黄原胶对大麦种子萌发和幼苗生长的影响
肖 俐, 罗 秋 颖, 刘 春 晓, 陶 虹 宇, 李 宪 臻, 俞 志 敏
( 大连工业大学 生物工程学院, 辽宁 大连 116034 )
0 引 言
黄原胶(Xanthan)是一种由黄单胞菌属细菌产生的胞外多糖[1],具有很高黏度和分子质量的天然多糖,黄原胶易溶于水,抗水解能力优于很多其他水溶性多糖或者多聚体[2]。黄原胶对酸碱也有较好的耐受能力,在pH 1~13,黄原胶的黏性不受影响[3]。黄原胶还被广泛用作食品添加剂[4],不仅能够提高微生物的稳定性,也可以作为农用化学品或植物保护剂的载体,以促进它们的黏附并保留在植物叶子中,甚至黄原胶及其衍生物作为植物启动子、诱导子或刺激物参与植物生长调节[5]。
以往的研究发现黄原胶具有一定的生理活性[5],但是对于黄原胶促进植物生长方面鲜有报道。本实验在大麦种子萌发和幼苗生长阶段通过不同方式添加不同浓度的黄原胶溶液,研究其对种子萌发和幼苗生长的影响,以期筛选最佳施用方式和最佳施用浓度。
1 材料与方法
1.1 材 料
大麦(HordeumvulgareL.),中粮麦芽(大连)有限公司;黄原胶,山东阜丰发酵有限公司;霍格兰营养液,上海钰博生物科技有限公司。
1.2 方 法
1.2.1 种子处理
选取颗粒饱满的大麦种子15份,每份100粒,置于烧杯中,加入50 mL 3%的次氯酸钠浸泡种子10 min,用50 mL去离子水清洗3遍。将大麦分别浸入50 mL去离子水(CK)、1 mg/L(A)、10 mg/L(B)、100 mg/L(C)、200 mg/L(D)的黄原胶溶液中,环境温度保持20 ℃,浸泡24 h。每个处理100粒,3组平行。之后用去离子水冲洗去除种子表面黄原胶溶液,冲洗干净的种子置于铺有滤纸的培养皿中,加入10 mL去离子水。大麦种子于恒温恒湿培养箱中避光发芽3 d,发芽温度22 ℃,湿度95%,在发芽过程中保持大麦种子表面湿润,使大麦发芽充分。第3天统计发芽势,第7天统计发芽率、发芽指数和活力指数。
1.2.2 幼苗处理
将发芽结束的幼苗从培养箱中移出,采用霍格兰营养液进行水培,待大麦幼苗长至两叶一心时对叶片进行表面喷施处理,并在营养液中添加体积分数10%的黄原胶溶液。实验共设15个处理组,分别为CK1(仅去离子水浸种)、CK2(去离子水浸种,喷施1 mg/L黄原胶)、CK3(去离子水浸种,营养液添加10% 1 mg/L黄原胶);A1(1 mg/L 黄原胶浸种)、A2(1 mg/L黄原胶浸种,喷施1 mg/L黄原胶)、A3(1 mg/L黄原胶浸种,营养液添加10% 1 mg/L黄原胶);B1(10 mg/L黄原胶浸种)、B2(10 mg/L黄原胶浸种,喷施10 mg/L 黄原胶)、B3(10 mg/L黄原胶浸种,营养液添加10% 10 mg/L黄原胶);C1(100 mg/L黄原胶浸种)、C2(100 mg/L黄原胶浸种,喷施100 mg/L 黄原胶)、C3(100 mg/L黄原胶浸种,营养液添加10%、100 mg/L黄原胶);D1(200 mg/L黄原胶浸种)、D2(200 mg/L黄原胶浸种,喷施200 mg/L黄原胶)、D3(200 mg/L黄原胶浸种,营养液添加10% 200 mg/L黄原胶)。每个处理设2组平行实验,每组50株幼苗。
1.2.3 发芽相关指标测定
发芽势(Gp)=n/N×100%
式中:n为规定天数内发芽种子数,N为种子总数。
发芽率(Gv)=no/No×100%
式中:no为结束发芽时发芽种子数,No为种子总数。
发芽指数(Gi)=∑Gt/t
式中:Gt为第t天的发芽数,t为时间,d。
活力指数(Vi)=GiS
式中:S为最后1 d的幼苗生长势(根干重)。
1.2.4 幼苗相关指标测定
大麦幼苗处理21 d后,测定各处理组大麦幼苗生理指标(株高、根长、湿重)、叶绿素含量、抗氧化酶活性(POD、CAT、SOD)、膜脂抗氧化程度(丙二醛(MDA)含量)、几丁质酶和β-1,3-葡聚糖酶活性[6]。
1.2.4.1 生理指标
测量大麦幼苗株高和根长,称重。
1.2.4.2 叶绿素含量的测定
取大麦叶片0.5 g于研钵中,加入少量石英石及碳酸钙粉,加入80%丙酮2~3 mL,研磨成匀浆,用80%丙酮冲洗研钵并转移至25 mL棕色容量瓶,定容。摇匀后,3 000 r/min离心10 min,取上清液在波长663、645、652和440 nm下测定吸光度(以80%丙酮为空白)。计算叶绿素a、叶绿素b及总叶绿素含量[7]。
ca=12.21A663-2.81A645
cb=20.13A645-5.03A663
1.2.4.3 抗氧化酶活性
POD活性的测定[8]:取大麦叶片0.5 g于研钵中,加入20 mmol/L的KH2PO4溶液25 mL研磨,10 000 r/min离心10 min,上清液冷藏,残渣用25 mL KH2PO4再提取一次,合并上清液。取两只比色皿,一只加入反应液3 mL和KH2PO41 mL为对照,另一只加入反应混合液3 mL 和酶液1 mL(活性过高可稀释)。470 nm波长下测吸光度,每30 s读数一次。以每分钟吸光度的变化值表示酶活性。
CAT活性的测定[8]:取大麦叶片1.0 g于预冷的研钵中,加入50 mol/L pH 7.8磷酸缓冲液(PBS)8 mL,研磨成匀浆,转入离心管中,4 ℃、12 000 r/min离心20 min,上清液即为酶液。PBS(0.15 mmol/L pH 7.0)取200 mL加入0.309 2 mL 30% H2O2溶液混合均匀为反应液。取3 mL反应液加0.1 mL酶液,以PBS为对照,240 nm波长下测定40 s内OD值的变化。以每分钟OD降低0.01为一个酶活性单位。
SOD活性的测定[8]:取大麦叶片2.5 g于研钵中,加入pH 7.8磷酸缓冲溶液冰浴研磨成匀浆,定容至25 mL,12 000 r/min冷冻离心20 min。取质地相同的比色管,两只对照,一只避光保存,与其他各比色管同时置于4 000 lx光照下反应30 min,反应温度25~35 ℃,以避光的比色管为空白对照,在560 nm下比色,计算SOD活性。

式中:A0为对照管吸光度;As为样品管吸光度;Vt为样品液总体积,mL;V1为测定时样品用量,mL;mf为样品鲜重,g。
1.2.5 膜脂抗氧化程度
取大麦叶片1.0 g于研钵中,加入10%三氯乙酸(TCA)2 mL和少量石英石,研磨匀浆,再加入8 mL TCA进一步研磨,转移至离心管中,4 ℃下4 000 r/min离心10 min,吸取上清液2 mL(对照加2 mL去离子水)加入2 mL 0.67%硫代巴比妥酸(TBA),充分混匀后沸水浴15 min。迅速冷却离心,取上清液测532、600、450 nm下吸光度。
MDA质量摩尔浓度=6.45(A532-A600)-0.56A450
1.2.6 几丁质酶和β-1,3-葡聚糖酶活性
几丁质酶活性的测定[9-10]:称取大麦叶片1.0 g于预冷的研钵中,加0.1 mol/L的乙酸缓冲液(pH 5.0)5 mL冰浴研磨,12 000 r/min离心10 min,上清液在12 000 r/min下再离心10 min,上清液置于冰箱保存。取酶液0.4 mL,加入40 mL 1%蜗牛酶,37 ℃水浴反应30 min后加入0.2 mL饱和硼砂,放在沸水浴中7 min,冷却后加入2 mL冰醋酸和1 mL 1%对二甲氨基苯甲醛(DMAB),37 ℃保温15 min,585 nm下测定吸光度。酶活性单位(U)定义:每克植物材料产生1 mmol N-乙酰氨基葡萄糖所需的酶量。
β-1,3-葡聚糖酶活性的测定[11]:称取大麦叶片0.5 g于预冷的研钵中,加0.05 mol/L的醋酸钠缓冲液(pH 5.0)3 mL和聚乙烯吡咯烷酮(PVP)0.0 5 g,在冰浴中充分研磨,4 ℃下12 000 r/min 离心15 min,上清液在12 000 r/min下再离心10 min,所得上清液即为粗酶液,放于冰箱保存。取1 mg/mL的昆布多糖(溶于醋酸钠缓冲液)0.4 mL,加入0.1 mL酶液,于37 ℃保温15 min,立即加入0.5 mL铜试剂混匀,并于100 ℃ 水浴10 min,置冷水中冷却,再加入砷钼酸试剂0.5 mL,呈现蓝色后加去离子水3.5 mL,摇匀,660 nm波长下测定其吸光度,根据葡萄糖标准曲线得到样品液的还原糖含量。一个酶活性单位(U)定义:每克植物材料产生1 μmol还原糖所需的酶量。
2 结果与讨论
2.1 黄原胶施用质量浓度对大麦种子发芽的影响
从表1中可以看出,施用黄原胶浸种能够显著影响大麦种子发芽,A、B两个处理组发芽率均显著提升,其中处理A(1 mg/L黄原胶浸种)与CK(去离子水浸种)相比发芽率提升了10%,处理B(10 mg/L黄原胶)与CK相比发芽率提升了4%,处理C(100 mg/L黄原胶)和处理D(200 mg/L 黄原胶)发芽率有所下降,这可能是黄原胶浓度过高引起的。低浓度的黄原胶溶液能够显著地促进大麦种子发芽率的提高。从发芽势、发芽指数和活力指数来看,处理A和B显著优于CK,说明低浓度的黄原胶溶液能够显著促进大麦种子发芽,最适质量浓度为1 mg/L,高质量浓度的黄原胶则有一定的抑制作用。

表1 黄原胶施用浓度对大麦种子发芽的影响
2.2 黄原胶施用方式及质量浓度对大麦幼苗生长的影响
从表2中可以看出,黄原胶能够显著影响大麦幼苗的生长。从平均湿重看,处理B显著优于其他各处理组,处理A和处理C相比于CK也有明显提高。从株高看,处理B和处理C的株高显著高于对照。从根长看,各处理组根长基本持平且略低于对照组。同时可以看到,在叶面喷施黄原胶对株高的影响更为显著,在营养液中添加黄原胶对根长有较大的影响,而且仅浸种处理的大麦幼苗相对于其他两种方式处理的大麦幼苗并没有特别明显的差距,说明仅仅在浸种阶段添加黄原胶已经能够有效的促进大麦种子的发芽。
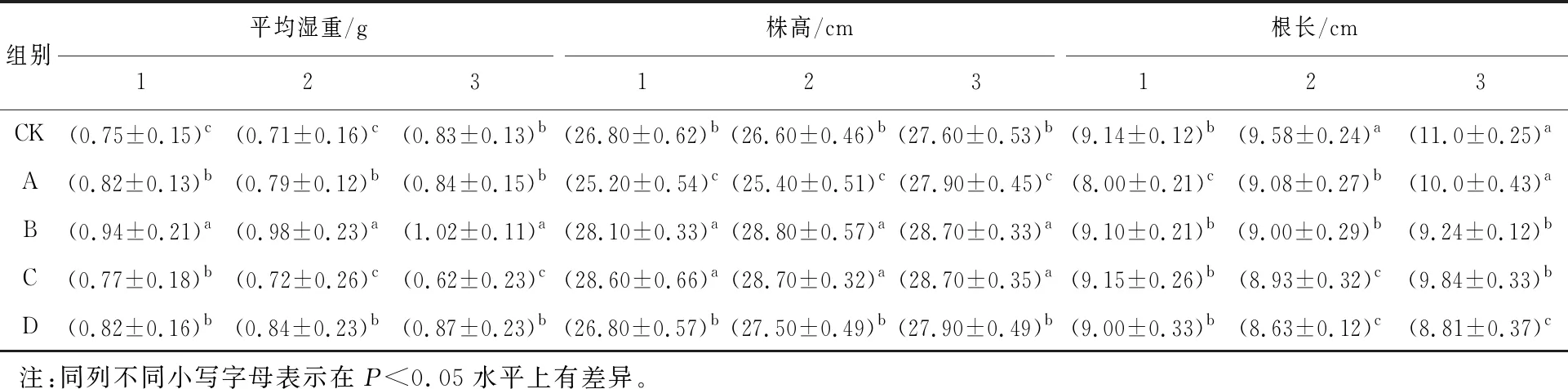
表2 黄原胶施用方式及质量浓度对大麦幼苗生长的影响
2.3 黄原胶施用方式及质量浓度对大麦幼苗叶绿素含量的影响
从图1中可以看出,经过黄原胶处理的大麦幼苗嫩叶中叶绿素a、叶绿素b和叶绿素总量与对照相比变化并不显著,而通过叶面喷施黄原胶能够有效提高叶绿素质量浓度。当黄原胶质量浓度为1 mg/L时,在叶面喷施黄原胶溶液相比于仅浸种处理的大麦幼苗,叶绿素质量浓度提升了18%。另外,黄原胶对叶绿素a的影响更大,而对叶绿素b影响相对较小。
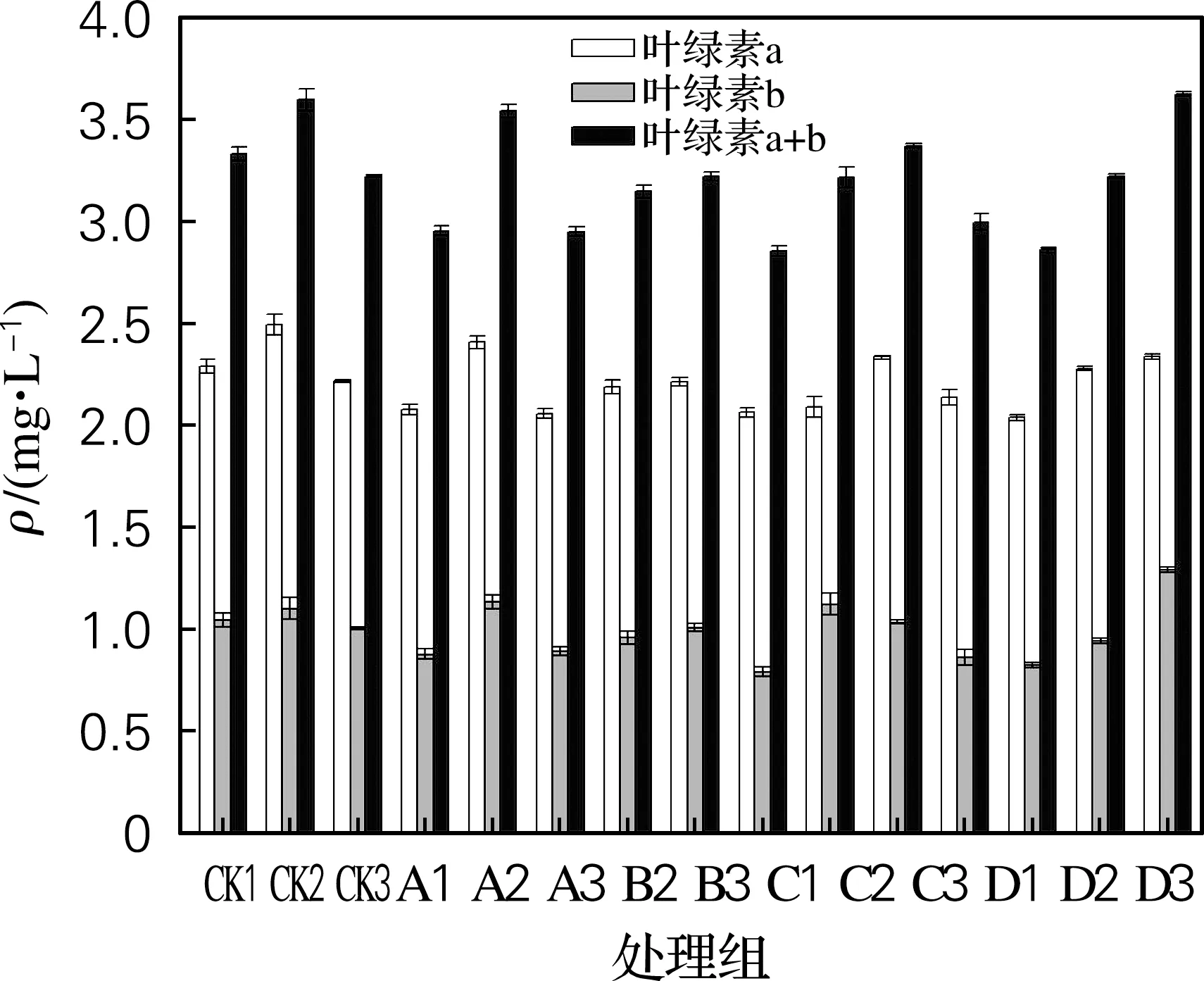
图1 黄原胶施用方式及质量浓度对大麦幼苗叶绿素质量浓度的影响
2.4 黄原胶施用方式及质量浓度对大麦幼苗抗氧化酶活性的影响
2.4.1 对POD活性的影响
从图2可以看出,黄原胶能够显著提升大麦幼苗中POD活性,提升的幅度随黄原胶质量浓度呈现先增加后减少的趋势,当黄原胶质量浓度为1 mg/L 时相比于空白POD活性增加了20%。在叶片表面施用黄原胶溶液更能有效提升POD酶活性,当黄原胶质量浓度为1和10 mg/L时,相对于空白POD酶活性分别提升了19.5%和20.7%。在营养液中添加黄原胶对POD酶活性并没有显著影响。
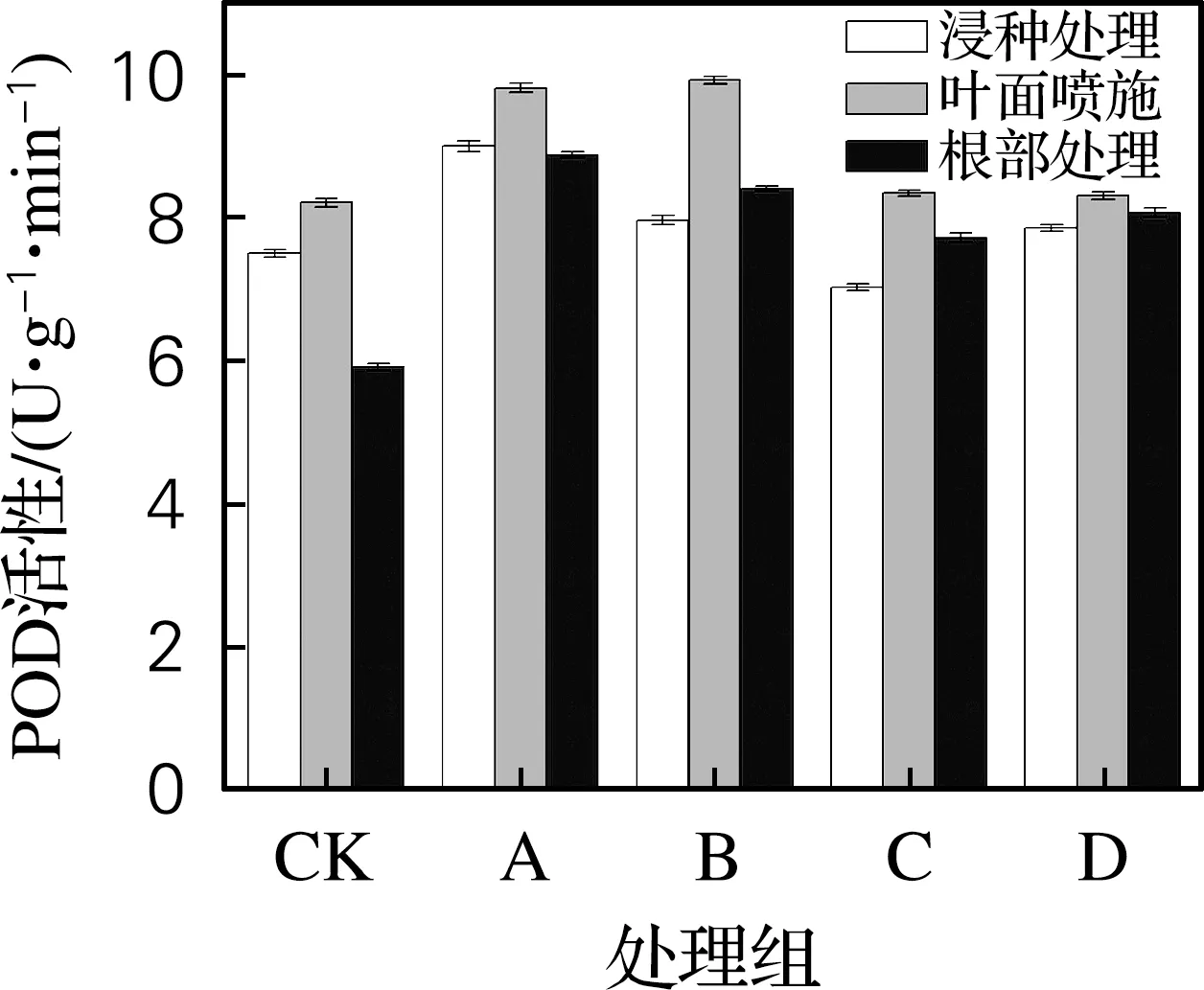
图2 黄原胶施用方式及质量浓度对大麦幼苗POD活性的影响
2.4.2 CAT活性的影响
从图3可以看出,低浓度的黄原胶溶液能够有效提升CAT酶的活性,高浓度黄原胶对CAT酶活性稍有抑制。黄原胶质量浓度为1和10 mg/L 时影响最为显著,分别提升了34.7%和41.5%。叶面喷施的效果优于在营养液中添加黄原胶。其中10 mg/L的黄原胶溶液在叶面喷施时CAT酶活力最高,为0.993 U/(g·min);10 mg/L 的黄原胶溶液在营养液中添加的CAT酶活力为0.940 U/(g·min)。
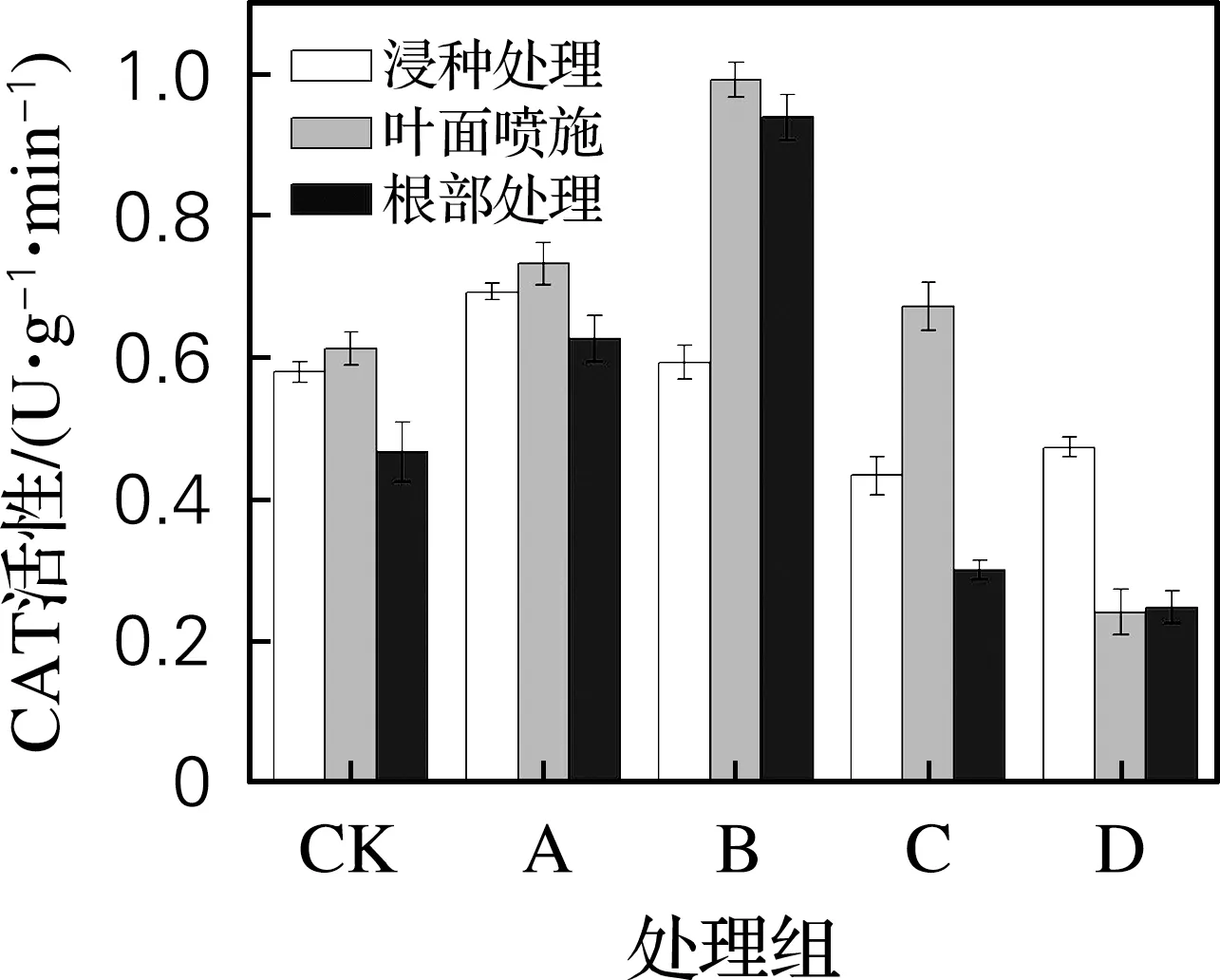
图3 黄原胶施用方式及质量浓度对大麦幼苗CAT活性的影响
2.4.3 对SOD活性的影响
从图4可以看出,用黄原胶处理大麦幼苗能够提升SOD的酶活力,低浓度黄原胶效果更好,1、10、100和200 mg/L分别提升了15.6%、22.2%、13.2%和5.0%。在大麦幼苗叶片表面喷施黄原胶效果最好,黄原胶质量浓度为10 mg/L时SOD酶活力最高,为215.32 U/(g·h)。结果表明,低浓度的黄原胶能够提升SOD酶活力,随着黄原胶浓度的升高而逐渐失去作用。
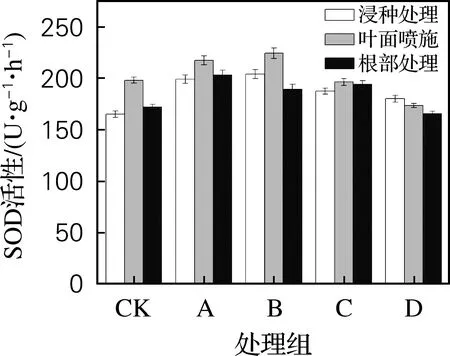
图4 黄原胶施用方式及质量浓度对大麦幼苗SOD的影响
2.5 黄原胶施用方式及质量浓度对膜脂抗氧化程度的影响
由图5可以看出,低浓度的黄原胶能够有效降低大麦叶片的膜脂氧化程度,与对照相比1 mg/L 的黄原胶MDA质量摩尔浓度降低了8%,10 mg/L的黄原胶MDA质量摩尔浓度降低了28%。而高浓度的黄原胶溶液反而加剧了膜脂过氧化程度。就施加方式而言,在叶面喷施黄原胶溶液比在营养液中添加黄原胶溶液更能够避免膜脂的过氧化程度,质量浓度为10 mg/L的黄原胶浸种且叶面喷施黄原胶的大麦幼苗MDA质量摩尔浓度最低,为3.28 mmol/g。
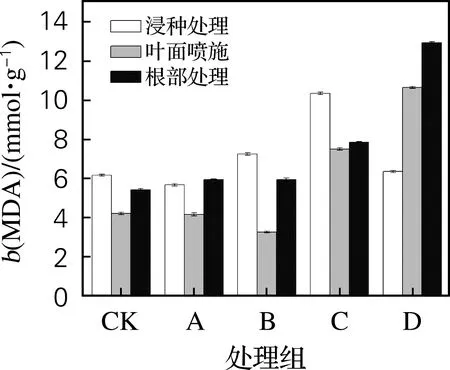
图5 黄原胶施用方式及质量浓度对大麦幼苗叶膜脂抗氧化程度的影响
2.6 黄原胶施用方式及质量浓度对几丁质酶和β-1,3-葡聚糖酶活力的影响
2.6.1 对几丁质酶活力的影响
从图6可以看出来,仅用黄原胶浸种对大麦幼苗叶片的几丁质酶活力影响不大,但是通过在叶面表面施用黄原胶溶液能有效提高几丁质酶活力,而在营养液中添加黄原胶溶液,在浓度低的情况下也能提升几丁质酶活力,高浓度的黄原胶则影响不大。其中叶片表面喷洒1 mg/L黄原胶时几丁质酶活力最大,为6.81 U/g,其次是在营养液中添加1 mg/L黄原胶,几丁质酶活力为6.30 U/g。

图6 黄原胶施用方式及质量浓度对大麦幼苗几丁质酶活力的影响
2.6.2 对β-1,3-葡聚糖酶活力的影响
从图7中可以看出,无论是哪种施加方式,黄原胶都能够提升大麦幼苗叶片中β-1,3-葡聚糖酶的活性。而在营养液中添加黄原胶,低浓度有促进作用,2个高浓度处理反而降低了大麦幼苗叶片中β-1,3-葡聚糖酶活力。
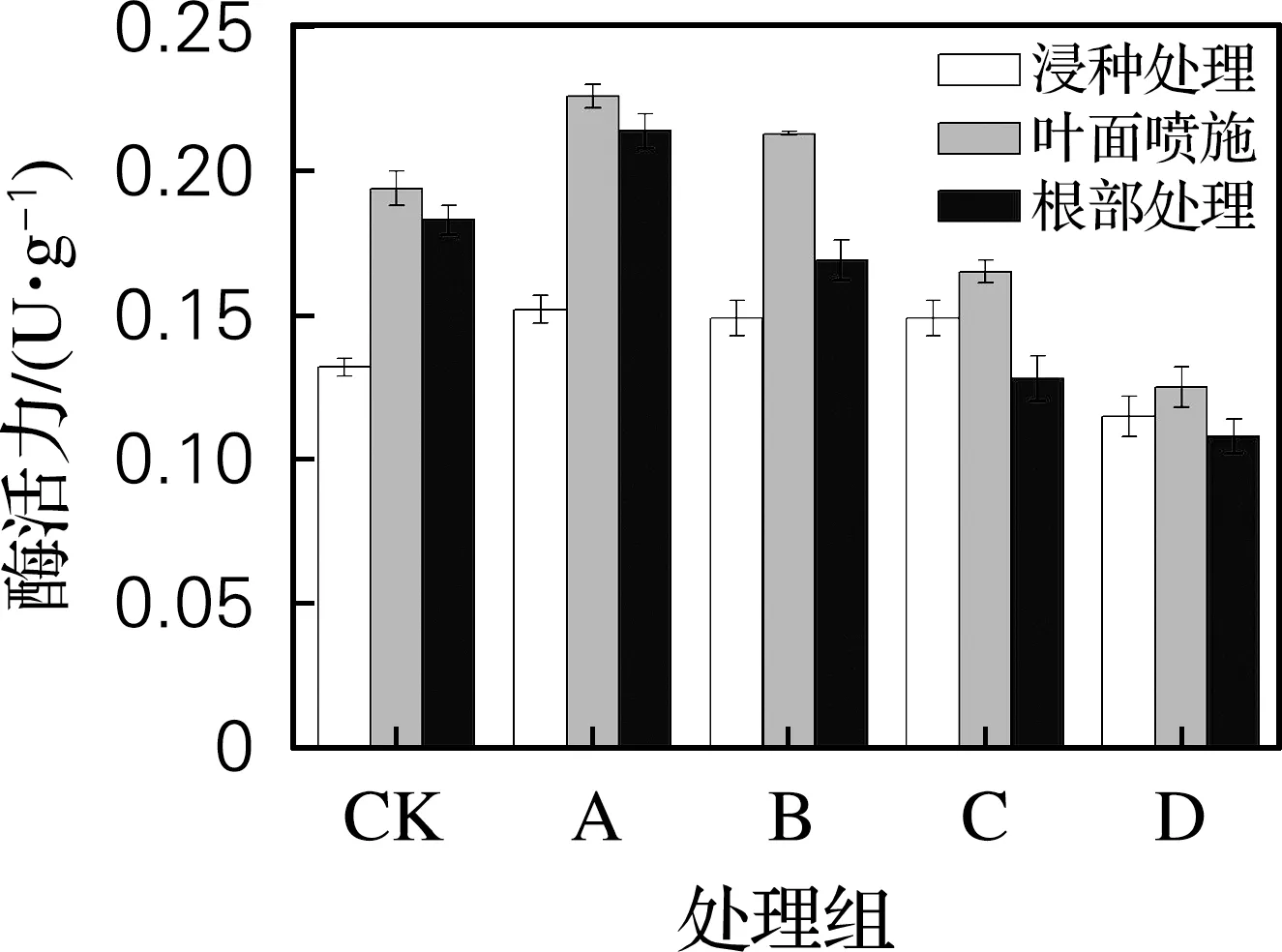
图7 黄原胶施用方式及质量浓度对大麦幼苗β-1,3-葡聚糖酶活力的影响
3 结 论
黄原胶能够对大麦种子萌发及幼苗生长起到促进作用,提升大麦幼苗品质。结果表明,黄原胶能够促进大麦种子萌发,黄原胶溶液质量浓度为1 mg/L对大麦种子发芽的促进效果最为显著。低浓度的黄原胶通过叶面喷施的方式处理大麦幼苗可有效提升大麦幼苗品质。当叶面喷施质量浓度为1 mg/L的黄原胶溶液时,叶绿素质量浓度提升了18%,POD活性提高了20%,同时幼苗的膜脂氧化程度也降低;当喷施的黄原胶质量浓度为10 mg/L时,CAT活性和SOD活性分别提升了41.5%和22.2%。黄原胶还能提升几丁质酶和β-1,3-葡聚糖酶活力,从而提升大麦幼苗的抗病能力。

