维氏气单胞菌来源几丁质酶的克隆表达及应用
鲁梦唯, 陈 晟, 吴 敬*
(1. 江南大学 生物工程学院,江苏 无锡 214122;2. 食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122)
丰年虾(Artemia salina L.),俗称卤虫,是一种小型甲壳类动物,常见于高盐度水域,物种多样性低且结构较为简单[1]。 其繁殖能力和休眠卵抗逆性强[2],孵化时间短,18~30 h 即可孵化成无节幼虫[3]。孵化后的幼虫含有丰富的蛋白质,常用作水产动物的饵料[4],而孵化残留的卵壳属于废弃物。 研究表明,丰年虾卵壳含有丰富的蛋白质和几丁质[5-6],以丰年虾卵壳为原料制备几丁寡糖, 不仅成本低廉,还能废物利用,具有极大的应用价值。
几丁寡糖是几丁质酶(EC 3.2.1.14)通过断裂几丁质链中的α-1,4-糖苷键生成的产物,不仅能作为一种天然食品防腐剂来抑制腐败菌滋生,还具有较好的抗氧化性和保湿性,能有效延缓衰老,在功能性食品领域具有极大的应用潜力[7-9]。 孙文敏等利用化学法以丰年虾卵壳为原料制备几丁寡糖[1];黄晓燕采用酸碱法,以丰年虾卵壳为原料制得了食品级几丁质[10]。Yosefali 等采用将丰年虾卵壳和多种细菌共培养的方法提取几丁寡糖,能获得较高的产率和纯度[11]。
鉴于传统化学法存在环境污染严重且成本较高等缺点[12-13],以丰年虾卵壳为原料,采用生物酶法制备几丁寡糖具有极大的应用潜力。 丰年虾卵壳的主要成分为蛋白质和几丁质,其中卵壳几丁质因受到蛋白质包裹导致其暴露在外的结合位点较少,因此添加中性蛋白酶对丰年虾卵壳进行蛋白质脱除处理后再使用几丁质酶水解,理论上能获得较高的几丁寡糖的回收率[14]。 作者采用高效且环境友好的生物酶法,以丰年虾卵壳为原料有效制备出具有抗氧化性能的几丁寡糖。
1 材料与方法
1.1 材料与试剂
携带几丁质酶ChiB565 基因的质粒pPIC9KChiB565:苏州金唯智生物科技有限公司合成;菌株Pichia pastoris GS115:作者所在实验室前期保藏;丰年虾卵壳:山东省潍坊市浩海水产饲料有限公司产品;酵母粉、蛋白胨:英国Oxoid 公司产品;中性蛋白酶:北京夏盛生物技术有限公司产品;DPPH、ABTS:上海阿拉丁试剂有限公司产品;其他国产分析纯试剂均购于国药集团。
YPD 培养基(g/L):葡萄糖20,酵母提取物10,胰蛋白胨20。
MD 培养基(g/L):葡萄糖20,YNB 13.4,生物素4×10-4,琼脂粉15。
BMMY 培养基(g/L):酵母提取物 10,YNB 13.4,胰蛋白胨20,生物素4×10-4。
BMGY培养基(g/L):酵母提取物 10,YNB 13.4,胰蛋白胨20,甘油10,生物素4×10-4。
种子培养基(g/L):甘油30,酵母提取物10,胰蛋白胨20,YNB 13.4。
BSM 培养基:甘油40 g/L,MgSO4·7H2O 14.9 g/L,CaSO4·2H2O 0.94 g/L,KOH 0.83 g/L,K2SO418.2 g/L,KH2PO46 g/L,PTM 4.32 mL/L。
补料培养基:甘油500 g/L,PTM 5 mL/L。
诱导培养基:甲醇,PTM 12 mL/L。
PTM 培 养 基 (g/L): 生 物 素0.2,ZnCl220,FeSO4·7H2O 65,CuSO4·5H2O 6,MnSO4·H2O 3,CoCl20.5,KI 0.08,Na2MoO3·2H2O 0.2,H3BO30.02,H2SO45。
1.2 仪器与设备
小型高速离心机:德国Eppendorf 公司产品;分析电子天平:瑞士Mettler-Toledo 公司产品;烘箱和恒温振荡培养箱: 上海知楚仪器有限公司产品;凝胶成像系统、Mini Protein 3 蛋白电泳系统: 美国Bio-Rad 公司产品;3 L 全自动发酵罐: 荷兰Applicon 公司产品; 紫外可见分光光度计: 日本Shimadzu 公司产品;色谱柱:安捷伦科技有限公司产品;Waters e2695 系统:Waters 科技(上海)有限公司产品。
1.3 实验方法
1.3.1 重组菌P. pastoris GS115/pPIC9K-ChiB565的构建及高拷贝转化子筛选 将合成得到的质粒pPIC9K-ChiB565 经Sac I 线性化后, 在1500 V 条件下电击转化进入已制备好的P. pastoris GS115 感受态细胞,迅速加入1 mL 1 mol/L 的山梨醇,吹吸混匀后于30 ℃复苏2 h。 随后取200 μL 菌液均匀涂布到MD 培养基,30 ℃培养至长出可见的单菌落。 挑取单菌落经抗性平板筛选、摇瓶筛选后测定菌液的OD600和上清液的几丁质酶活性,OD600和几丁质酶活性较高的即为毕赤酵母的高拷贝转化子。
1.3.2 重组菌P. pastoris GS115/pPIC9K-ChiB565 的培养方法
1)摇瓶发酵 将重组菌P. pastoris GS115/pPIC9K-ChiB565 的高拷贝转化子菌液以体积分数0.2%的接种率接入10 mL YPD 培养基中,30 ℃、200 r/min 培养24 h。 再以体积分数0.2%的接种率接入100 mL BMGY 培养基中,30 ℃、200 r/min 培养24 h。 随后将菌液在4 ℃、5000 g 离心10 min后,弃去上清液,用50 mL BMMY 培养基复溶,同时添加375 μL 纯甲醇诱导。 菌液于30 ℃继续培养,且每24 h 补加250 μL 的纯甲醇诱导,共培养4~6 d。
2)种子培养 取保藏于-80 ℃的甘油管在YPD培养基上划线活化,挑取生长良好的单菌落接种于100 mL 的种子培养基中, 在30 ℃、200 r/min 的条件下培养24 h 获得种子液。
3)3 L 罐发酵 将培养24 h 的种子液全部接入已灭菌的0.9 L 发酵培养基中, 通过流加体积分数为30%氨水调节发酵罐内的pH,使发酵过程pH稳定在5.0 左右; 同时设置搅拌转速与通气进行结合, 使发酵过程的溶氧维持在不超过30%; 待第1次溶氧反弹后,开始流加补料培养基。 继续补料培养12~14 h 后,停止补料,饥饿处理1 h,此时取样测量, 控制OD600在130 左右或湿菌质量分数达到30%,并调节发酵罐温度至28 ℃;待溶氧明显回升且温度稳定后,开始甲醇诱导,按菌体实际生长状况逐渐提高甲醇流量;甲醇诱导阶段可每12 h 间歇停止补加甲醇,观察溶氧反弹情况以确保甲醇并未过量,待发酵酶活不再上升时终止发酵。 其中甲醇诱导速度采用分阶段恒流补加甲醇的方法。
1.3.3 重组几丁质酶ChiB565 的酶学性质研究
1)最适温度 在pH 5.0 下,分别测定等量重组酶液在不同温度(20~70 ℃)条件下的酶活,定义最高酶活为100%, 计算不同温度条件下的相对酶活(残留酶活)。
2)温度稳定性 将重组酶液放置于37、50、60 ℃中,定时取样测其酶活。定义0 h 的酶活为100%,计算相对酶活(残留酶活)。
3)最适pH 分别在不同pH 条件下(pH 3.0~9.0)测定酶活,定义最高点酶活为100%,计算相对酶活(残留酶活)。
4)pH 稳定性 在50 ℃条件下, 将一定量的重组酶液分别于pH 3.0~9.0 的缓冲液中孵育2 h 后测定酶活(残留酶活)。
1.3.4 重组几丁质酶ChiB565 的活性检测 几丁质酶活性采用DNS 法[15]进行测定。 在50 ℃、pH 5.0条件下,以250 μL 的10 g/L 胶体几丁质为底物,添加100 μL 的重组几丁质酶粗酶液和150 μL 的20 mmol/L 磷酸柠檬酸盐缓冲液,精准反应1 h,再添加2 mL 的DNS 终止反应, 随后立即煮沸5 min 再冷却至室温,在12000 g 下离心5 min,测量上清液于540 nm 的吸光度。 根据乙酰氨基葡萄糖(GlcNAc)的DNS 显色标准曲线计算酶活。几丁质酶活性的定义为在50 ℃条件下, 每小时释放出1 μmol 的GlcNAc 所需的酶量,即为一个单位酶活。
1.3.5 丰年虾卵壳成分分析 取足量丰年虾卵壳充分研磨压碎并过50 目筛得到卵壳粉末。 卵壳水分质量分数测定参照 《饲料水分的测定方法》(GB 6435—86)中方法,在90 ℃下卵壳粉末干燥2 h 后准确称质量进行测定;卵壳灰分按照《饲料中粗灰分的测定》(GB 6438—2007)中燃烧法测定;准确称量1.00 g 卵壳粉末在20 mL 1 mol/L 的NaOH 中于40 ℃充分搅拌3 h,运用《油料粗蛋白质的测定法》(GB/T 14489.2—1993)中凯氏定氮法测量上清液中蛋白质质量分数来确定卵壳蛋白质质量分数;将上一步残留的沉淀置于20 mL 1 mol/L 的HCl 在25 ℃下充分搅拌3 h, 去除上清液并充分洗涤干燥残余沉淀并称质量,记录为卵壳几丁质质量。
1.3.6 丰年虾卵壳蛋白质的脱除
1)中性蛋白酶加酶量优化 在1.3.5 研磨得到的卵壳粉末中加入50 mmol/L 磷酸缓冲液配置成10 g/dL 的反应底物,设置中性蛋白酶加酶量为10、20、30、40、50、60 mg/g(以底物质量计),在50 ℃、pH 5.0 条件下振荡培养3 h,反应结束后在12000 g 下离心5 min,保留沉淀并称质量。
2)水解时间优化 将反应底物置于最适中性蛋白酶加酶量下相同条件反应1、2、3、4、5、6 h 后与上一步相同条件离心,保留沉淀并称质量。

式中:I 为蛋白质脱除率,%,A1为卵壳粉底物质量,g;A2为残留沉淀质量,g;A0为底物卵壳粉中蛋白质质量,g。
1.3.7 丰年虾卵壳几丁质的水解
1)重组几丁质酶ChiB565 加酶量优化 将1.3.6 得到的沉淀加入50 mmol/L 磷酸缓冲液配置成10 g/dL 的反应底物,设置重组几丁质酶ChiB565加 酶 量 为10、20、30、40、50、60 U/g (以 底 物 质 量计),在50 ℃、pH 5.0 条件下振荡培养3 h,反应结束后在12000 g 离心5 min,保留沉淀并称质量。
2)水解时间优化 将反应底物置于最适重组几丁质酶ChiB565 加酶量下相同条件反应1、2、3、4、5、6 h 后离心对沉淀称质量, 同时保留上清液以备后续检测。
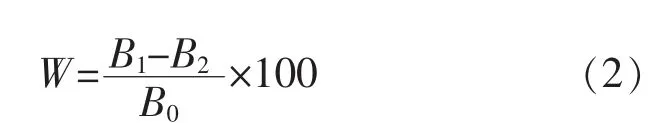
式中:W 为几丁质回收率,%;B1为沉淀底物质量,g;B2为残留沉淀质量,g;B0为沉淀底物中几丁质质量,g。
1.3.8 丰年虾卵壳水解产物成分测定 1.3.7 所得上清液即为丰年虾卵壳几丁质水解产物,通过DNS法测定水解产物的总还原糖。 水解产物中组成成分通过HPLC 测定。 将水解产物用乙腈稀释并过滤膜(0.22 μm)得到样品,以体积分数为75%乙腈为流动相,在30 ℃和0.8 mL/min 流量下,将样品进样于HPLC 系统(Separations module),采用Hypersil APS色谱柱(250 mm×4.6 mm)进行产物分析。
1.3.9 丰年虾卵壳水解产物抗氧化性测定 DPPH自由基清除能力的测定参照文献[16],ABTS 自由基清除能力的测定参照文献[17]。
2 结果与分析
2.1 丰年虾卵壳水解酶的选择
对丰年虾卵壳的成分进行分析,经检测丰年虾卵壳中蛋白质质量分数为58.92%,几丁质质量分数为24.18%,灰分质量分数为2.44%,水分质量分数为2.51%。 鉴于丰年虾卵壳中蛋白质和几丁质质量分数较高,因此选择以中性蛋白酶和几丁质酶协同处理对丰年虾卵壳进行水解以获得几丁寡糖。 由于中性蛋白酶商品化程度较高,且具有较为广泛的底物亲和性和较高的比酶活,因此选用商品中性蛋白酶进行处理。
丰年虾卵壳中存在的天然几丁质一般以结晶形式存在。 研究表明, 几丁质结合域CBD(Chitin binding domain)的存在能高效促进几丁质酶对晶体几丁质的水解[18]。相关研究表明,几丁质酶水解几丁质生成产物大多为几丁四糖以下的寡糖[19-20],而聚合度较高的几丁寡糖具有更好的生物活性。 因此,选择维氏气单胞菌来源的几丁质酶ChiB565, 其具备GH18 家族典型的催化结构域和CBD 结构域[21],对晶体几丁质催化效率高,且同时具有内切和外切活性,水解速度快;其水解虾壳几丁质产物为几丁二糖到几丁六糖,无论是从水解效率还是水解产物分布角度,理论上都应对丰年虾卵壳具有较好的水解效果。
2.2 重组几丁质酶ChiB565 在P. pastoris 中的克隆表达及酶学性质
将合成得到的质粒pPIC9K-ChiB565 电击转化进入P. pastoris GS115 的感受态细胞中, 经过抗性平板筛选和摇瓶筛选对重组菌进行高拷贝转化子筛选,结果显示,重组几丁质酶ChiB565 水解胶体几丁质的酶活为3.40 U/mL。 通过SDS-PAGE 分析(见图1), 重组几丁质酶ChiB565 的蛋白质相对分子质量大小约为114800。

图1 重组菌P. pastoris GS115/pPIC9K-ChiB565 转化子的SDS-PAGE 分析Fig. 1 SDS -PAGE analysis of recombinant strain P.pastoris GS115/pPIC9K-ChiB565 transformant
如图2(a)和(b)所示,在20~70 ℃条件下,重组几丁质酶ChiB565 最适温度为50 ℃。 在37 ℃条件下孵育90 min,重组几丁质酶ChiB565 的相对酶活(残留酶活)仍有90%;在50 ℃孵育90 min,重组几丁质酶ChiB565 的相对酶活为70%; 而当在60 ℃孵育10 min 时,重组几丁质酶ChiB565 相对酶活迅速降低至40%,孵育90 min 后相对酶活仅为20%。如图2(c)和(d)所示,在pH 3.0~9.0 条件下,重组几丁质酶ChiB565 的最适pH 为5.0。 在pH 5.0 条件下,孵育2 h 后相对酶活最高,在pH 4.0~7.0 孵育2 h 后残留酶活都不低于最高值的80%,pH 稳定性较好。


图2 重组几丁质酶ChiB565 的酶学性质Fig. 2 Enzymatic properties of recombinant chitinase ChiB565
2.3 重组菌P. pastoris GS115/pPIC9K-ChiB565的发酵优化
2.3.1 发酵培养基的氮源优化 在BSM 培养基中添加40 g/L 的无机氮源(NH4)2HPO4,进行3 L 罐发酵,菌体湿菌质量分数和发酵上清液的酶活曲线如图3 所示。 结果显示整个发酵周期内,添加无机氮源组的菌体湿菌质量分数均高于未添加无机氮源组,并且发酵酶活也均高于未添加无机氮源组。 其中在诱导120 h 时, 添加无机氮源组的最高酶活为11.8 U/mL, 是未添加无机氮源组最高酶活的1.37倍。 上述结果表明,添加无机氮源能有效促进菌体生长,提高重组菌的发酵酶活。

图3 培养基中氮源对菌体生长及酶活的影响Fig. 3 Effect of nitrogen source in medium on P. pastoris growth and enzyme activity
2.3.2 诱导温度优化 由于P. pastoris 的最适生长温度在28~30 ℃, 同时低温条件有益于蛋白质折叠,因此设置20、25、28 ℃温度梯度进行上罐优化。发酵过程菌体生长湿菌质量分数和发酵上清液酶活曲线如图4 所示。 在诱导0~24 h 阶段,3 个温度下菌体湿菌质量分数无明显差别; 在诱导24 h 后,菌体进入快速生长阶段,菌体湿菌质量分数随诱导温度的升高而升高。 发酵酶活结果显示,随着诱导温度的升高,重组几丁质酶活性也随之升高。 当诱导温度为28 ℃时, 诱导120 h 后酶活达到最高,为11.9 U/mL,是摇瓶酶活的3.5 倍;当诱导温度为20 ℃时,同期发酵酶活始终低于28 ℃,且诱导96 h 酶活开始下降。
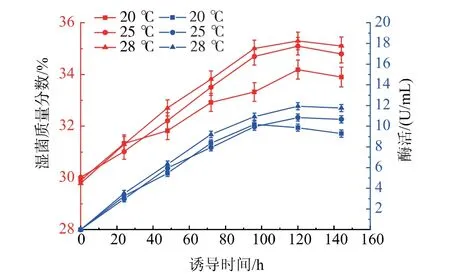
图4 20、25、28 ℃诱导温度下重组菌生长及重组几丁质酶ChiB565 表达情况Fig. 4 Growth of recombinant bacteria and expression of recombinant chitinase ChiB565 at induction temperature of 20,25,28 ℃
由上述结果分析可知, 虽然在20 ℃低温条件下有益于蛋白质折叠, 但此时菌体生长速率也较缓,同时重组几丁质酶ChiB565 的积累会破坏菌体细胞壁,限制菌体生长,进而影响蛋白质的表达,最终导致菌体量较少,酶活较低;而28 ℃诱导时,菌体生长速率较快,在发酵前、中期受到甲醇细胞毒性的影响较小,菌体得以快速积累,更利于其在发酵后期减小甲醇毒性以及重组几丁质酶ChiB565对菌体的降解,从而提高酶活。 结果表明,诱导温度设置为28 ℃将有利于前期菌体的生长和后期蛋白质的表达。
2.3.3 诱导补料条件优化 P. pastoris 在诱导阶段以甲醇作为生长碳源,生长速率较低,相关研究表明此阶段使用复合碳源补料可以提高菌体生长速率,并减小甲醇对菌体生长造成的影响。 本研究中选择在诱导中期48 h 开始以甲醇诱导速度的10%进行甘油补料,在诱导温度28 ℃条件下,发酵过程菌体生长及发酵酶活曲线如图5 所示。 湿菌质量分数结果显示, 在诱导48 h 前由于均未添加甘油,湿菌质量分数无较大差异, 当48 h 后添加甘油补料后,菌体湿菌质量分数均高于对照组(不添加甘油补料)。 酶活结果显示,当不添加甘油补料时,酶活在诱导120 h 达到最高,为11.9 U/mL;添加甘油补料后,酶活在132 h 达到最高,为13.2 U/mL,是不添加甘油补料组最高酶活的1.11 倍, 是摇瓶酶活的3.88 倍。 发酵上清液的SDS-PAGE 如图6 所示。 由上述结果分析可知,发酵中期添加甘油补料可以缓解菌体受细胞毒性的影响, 从而促进菌体生长,延长发酵周期,同时还能促进蛋白质的表达,提高发酵液酶活。 结果表明,诱导阶段进行甘油补料能有效促进菌体生长和蛋白质表达。
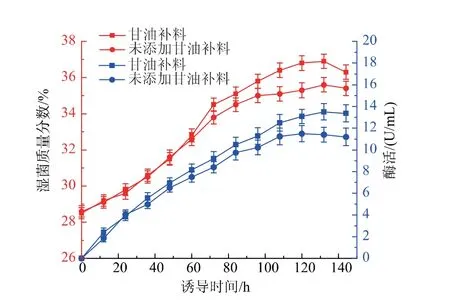
图5 诱导阶段补加甘油对重组几丁质酶ChiB565 表达的影响Fig. 5 Effect of supplementation of glycerol on recombinant chitinase ChiB565 expression in the induction phase
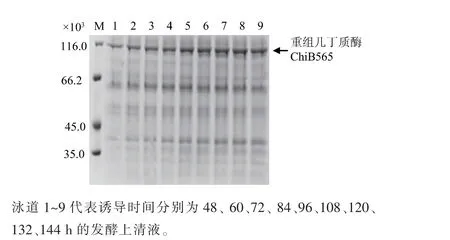
图6 重组几丁质酶ChiB565 发酵表达的SDS-PAGE 分析Fig. 6 SDS -PAGE analysis of recombinant chitinase ChiB565 expression
2.4 重组几丁质酶ChiB565 在制备几丁寡糖中的应用
2.4.1 中性蛋白酶脱除丰年虾卵壳蛋白质的加酶量和水解时间优化 为充分脱除卵壳中的蛋白质,选择以蛋白质脱除率为指标对中性蛋白酶加酶量和水解时间进行优化。 中性蛋白酶加酶量优化结果如图7(a)所示,随着中性蛋白酶加酶量增加,蛋白质脱除率不断上升,当中性蛋白酶加酶量为30 mg/g时,蛋白质脱除率达到峰值,约为41.75%,且此时当加酶量继续增加时,蛋白质脱除率不再上升。 中性蛋白酶水解时间优化结果如图7(b)所示,随着水解时间延长,蛋白质脱除率不断上升,当水解时间为4 h 时,蛋白质脱除率达到峰值,约为50.13%,且此时当水解时间继续增加时,蛋白质脱除率不再上升。因此选择30 mg/g 加酶量和4 h 水解时间来脱除蛋白质。

图7 中性蛋白酶脱除卵壳蛋白质的条件优化Fig. 7 Optimization of conditions for removing eggshell protein by protease
以丰年虾卵壳为底物制备几丁寡糖的研究,卵壳蛋白质的脱除通常采用酸碱法,其蛋白质脱除率能达80%以上,但环境污染严重且作用时间长[10]。而全酶法脱除蛋白质尚未见报道,作者采用中性蛋白酶处理丰年虾卵壳, 较优条件下蛋白质脱除率为50.13%, 理论上能打开几丁质-蛋白质的复合物结构,在后续处理中能提高几丁质酶和卵壳几丁质的结合效率,从而获得更高几丁质回收率。
2.4.2 重组几丁质酶ChiB565 水解丰年虾卵壳的加酶量和水解时间优化 为获得更多的几丁寡糖,选择以几丁质回收率为指标对重组几丁质酶ChiB565 加酶量和水解时间进行优化。 加酶量优化结果如图8(a)所示,随着加酶量增加,几丁质回收率不断上升,当加酶量为40 U/g 时,几丁质回收率达到峰值,为42.01%,且此时当加酶量继续增加时,几丁质回收率不再上升。 水解时间优化结果如图8(b)所示,随着水解时间延长,几丁质回收率不断上升,当水解时间为5 h 时,几丁质回收率达到峰值,约为60.17%,且此时当水解时间继续增加时,几丁质回收率不再上升。 因此选择40 U/g 加酶量和5 h水解时间来回收几丁质。
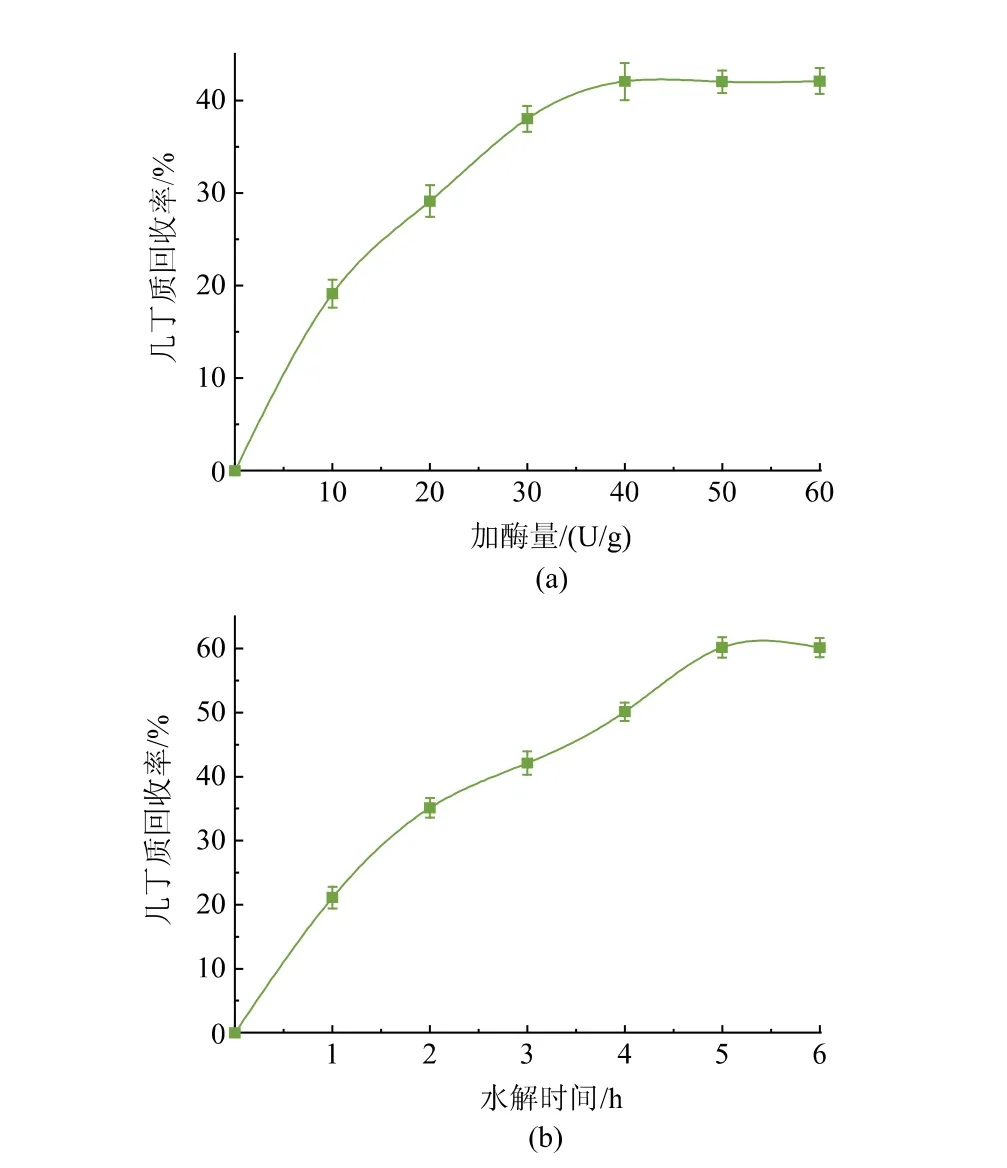
图8 重组几丁质酶ChiB565 回收卵壳几丁质的条件优化Fig. 8 Optimization of recovering conditions for eggshell chitin by recombinant chitinase ChiB565
在最适条件下,丰年虾卵壳制备几丁质的回收率为60.17%,结果表明大多数丰年虾卵壳被转化为可溶性几丁寡糖。 几丁质水解产物中总还原糖质量浓度为14.26 g/L,占虾壳几丁质的58.97%,与几丁质回收率相近。
传统酸碱法制备几丁寡糖, 酸碱法分步处理6.5 h 后几丁质回收率为15%,当引入微波提取和乙醇浸泡分步处理2 h 后,几丁质回收率能达到60%[10]。作者采用全酶法处理丰年虾卵壳, 处理5 h 时几丁质得率为60.17%,与传统方法处于同一水平,处理过程环境污染较少,处理时间更短。
2.4.3 丰年虾卵壳水解产物的成分测定及抗氧化性分析 丰年虾卵壳水解产物的HPLC 结果如图9所示,共观察到3 个较为明显的特征峰1、2、3,分别对应几丁二糖、几丁三糖和几丁四糖,同时还观察到4 个较小的特征峰4、5、6、7, 其中特征峰4、5 分别对应几丁五糖和几丁六糖;由于市面上无法买到六糖以上的几丁寡糖标准品,所以无法确定特征峰6、7 为何种产物。 结果表明丰年虾卵壳水解主产物为几丁二糖到几丁四糖,同时伴随少量几丁五糖和几丁六糖。
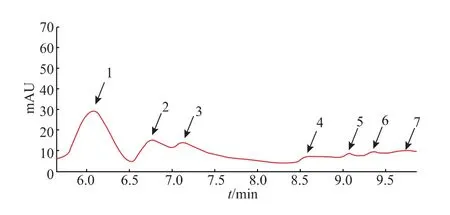
图9 丰年虾卵壳水解产物的HPLC 分析Fig. 9 HPLC analysis of the hydrolysate of Artemia salina eggshells
几丁寡糖因具有抗氧化能力,在食品保鲜领域中有巨大的应用价值。 丰年虾卵壳几丁质水解的产物对DPPH 自由基和ABTS 自由基清除率分别为59.94%和53.15%。这是由于水解生成的不同聚合度壳聚糖产物中的羟基和氨基均可与羟自由基发生水合反应, 另外其氨基可与羟自由基发生电子置换,进而生成稳定的电子对复合物。 同时,张振婷等的研究表明低相对分子质量的壳聚糖对DPPH 自由基具有较强的清除能力[22],本研究水解产物中存在大量的几丁二糖,这可能是导致其对DPPH 自由基的清除率略高于ABTS 自由基的原因。
3 结语
作者首先在P. pastoris 中重组表达了几丁质酶ChiB565,研究了其酶学性质并完成了高密度发酵,随后以中性蛋白酶和重组几丁质酶ChiB565 协同处理丰年虾卵壳,以制备几丁寡糖。 结果显示当先用中性蛋白酶以30 mg/g 的加酶量和4 h 水解时间处理丰年虾卵壳以脱除蛋白质,再用重组几丁质酶ChiB565 以40 U/g 加酶量和5 h 水解时间来水解几丁质时, 水解产物主要为几丁二糖到几丁四糖,伴随少量几丁五糖和几丁六糖; 同时水解产物对DPPH 自由基和ABTS 自由基清除率分别为59.94%和53.15%。结果表明该生物酶法以丰年虾卵壳为底物制备几丁寡糖相较于传统化学法回收率相当,且污染较少,处理时间更短。 该研究采用生物酶法以丰年虾卵壳为原料有效制备几丁寡糖,为几丁寡糖的工业化制备提供依据和参考。

