BoNT/A和倍他米松对骨关节炎模型大鼠镇痛效果比较
杨慧,王琳,万慧伟,周雯雯,李铁山
(青岛大学附属医院康复二科,山东 青岛 266003)
骨关节炎疼痛是最常见的慢性疼痛之一[1],虽止痛治疗办法多,但多存在效果差、持续时间短、副作用大等缺陷[2],因此需寻求新的镇痛药物。近年来A型肉毒毒素(BoNT/A)的镇痛作用受到了人们越来越多的关注[3-5],其具有单次给药、镇痛作用时间长、副作用少等优点。本研究拟观察关节腔注射BoNT/A对大鼠骨关节炎疼痛的镇痛作用,并与常用关节腔注射药物倍他米松进行比较,以进一步评估BoNT/A对骨关节炎疼痛的治疗效果,并探讨BoNT/A可能的镇痛机制。
1 材料与方法
1.1 实验材料
雄性SD大鼠60只,体质量170~200 g,由青岛大学实验动物中心提供。所有大鼠均饲养在青岛大学实验动物中心,分笼饲养,每笼5只,大鼠可以自由获得食物和水。室内温度维持在22 ℃,明暗交替12 h/12 h。适应喂养7 d后用于实验。纤毛机械痛刺激仪(美国North Coast公司);通道式鼠足支撑力测量仪(济南益延科技有限公司);凝胶成像分析系统(美国UVP公司)。BoNT/A(美国Allergan公司);复方倍他米松(浓度为7 g/L,杭州默沙东制药有限公司),单碘乙酸钠(MIA,购自美国Sigma公司),兔抗大鼠P2X4嘌呤受体(P2X4R)抗体、FITC标记山羊抗兔 IgG(BiossAntibodies公司)。
1.2 动物模型制备及分组
参照HAVELIN等[6]方法建立大鼠踝关节骨关节炎疼痛模型。消毒大鼠踝关节周围的皮肤,按住大鼠左腿,定位腓骨外踝窝,用28号针垂直插入皮肤,然后插入左胫骨跗骨关节腔,向关节腔内注射80 g/L的MIA 50 μL构建骨关节炎模型。同时随机选取12只大鼠向关节腔内注射50 μL生理盐水作为对照组。21 d后测量大鼠造模侧及对侧后爪的机械刺激撤足阈值(PWT)及负重情况,测量3次,将出现PWT及负重较对测后肢明显下降的行为学表现稳定者纳入实验并作为模型组。造模21 d后,将模型组SD大鼠随机分为生理盐水组(A组)、倍他米松组(B组)、BoNT/A组(C组),每组15只,分别向关节腔内注射25 μL生理盐水、25 μL复方倍他米松以及5 U的BoNT/A(25 μL)。
1.3 疼痛行为学测试
分别于造模前1 d,造模后21 d及给药后0、1、3、7、14、21 d,从各组中随机抽取6只大鼠进行疼痛行为学测定。①PWT测定:将大鼠放置在一个底部为网格的特殊树脂玻璃格子(26 cm×20 cm×14 cm)中适应20 min后,应用一系列强度递增的纤毛(0.4、0.6、1.4、2.0、4.0、6.0、8.0、15.0 g)按up and down的方法[7]从2.0 g开始垂直刺激大鼠左侧足底部皮肤,每次刺激足底时间维持5 s,若在规定时间内大鼠出现缩足、舔脚等阳性反应时更换相邻小一级的纤毛测试,若无反应则更换大一级的纤毛测试,每次刺激间隔为5 min,测试上限和下限的纤毛强度分别为15.0 g和0.4 g。计算50%缩足反应的阈值,以此结果作为PWT评估指标。②后肢支撑力百分比测定:训练大鼠通过隧道爬到一个有角度的树脂玻璃室的平台,使大鼠的后肢分开放置在两个称量梯架上,安静稳定停留5 s后,使用仪器分别计算双下肢的支撑力,测量3次取平均值,数据结果规范化为左/(左+右)的百分比,正常值为50%表明双侧后肢重量分布是相等的。
1.4 蛋白印迹法检测P2X4R蛋白表达
分别于造模21 d及给药后7、14、21 d,各组随机取3只大鼠,用100 g/L水合氯醛(3 mL/kg)麻醉后处死动物,迅速分离大鼠L4~L6脊髓节段,研磨成匀浆,制成蛋白悬液,取等量的组织蛋白样品(含组织蛋白40 μg)加到聚丙烯酰胺凝胶电泳槽中,浓缩胶恒压80 V约30 min,质量浓度为150 g/L分离胶恒压100 V 约90 min,采用湿转法将蛋白转至聚偏二氟乙烯膜(PVDF),恒流200 mA电转移 90 min,于50 g/L脱脂奶粉封闭液中室温下摇床封闭 2 h,加入山羊抗大鼠P2X4R和GAPDH抗体孵育过夜,使用TBST漂洗后,将FITC标记山羊抗兔IgG室温摇床孵育2 h,使用TBST漂洗后滴加发光液显色成像,通过Image J 1.36软件分析目标条带灰度值。以P2X4R/GAPDH的灰度比值表示P2X4R的相对表达量。
1.5 统计学处理
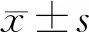
2 结 果
2.1 各组大鼠不同时间PWT比较
造模前,各组大鼠注射侧后足PWT差异无统计学意义(P>0.05)。关节腔内MIA 注射21 d后,对照组、模型组大鼠注射侧后足的PWT值分别为(18.67±5.68)、(0.70±0.64)g,两组比较差异有统计学意义(t=7.699,P<0.01)。重复测量双因素方差分析显示,大鼠PWT不同组别、时间及组别与时间交互作用差异均有显著意义(F时间=7.96,F组别=22.55,F时间×组别=3.73,P<0.01)。组内比较,倍他米松组及BoNT/A组大鼠各时间点PWT比较差异有显著性(F=3.58、17.02,P<0.05),其中倍他米松组大鼠PWT在给药后逐渐上升,7 d时达到高峰,随后逐渐下降;而BoNT/A组大鼠PWT在给药后逐渐上升,21 d时达到峰值,且有继续上升的趋势; 生理盐水组大鼠给药后各时间点PWT差异无统计学意义(P>0.05)。组间不同时间点比较,倍他米松组大鼠给药后3 d和7 d 时PWT较生理盐水组改善明显,差异均有统计学意义(F=2.74、3.14,P<0.05),而14 d和21 d差异无显著性(P>0.05);BoNT/A组大鼠给药后14、21 d时PWT较生理盐水组改善明显(F=11.90、13.25,P<0.01)。见表1。
2.2 各组大鼠不同时间后肢支撑力百分比比较
造模前,各组大鼠左侧后肢支撑力百分比差异无统计学意义(P>0.05)。关节腔内MIA注射21 d后,对照组、模型组大鼠左侧后肢支撑力百分比分别为(51.27±5.22)%、(35.03±1.67)%,两组比较差异有统计学意义(t=7.261,P<0.001)。重复测量双因素方差分析显示,后肢支撑力百分比不同组别、时间及组别与时间交互作用差异均有显著性(F时间=102.89,F组别=25.63,F时间×组别=5.15,P<0.01)。组内比较,各组大鼠给药后后肢支撑力百分比随给药时间逐渐变化,差异有显著性(F=8.21~150.55,P<0.01)。组间比较,各时间点倍他米松组大鼠后肢支撑力百分比与生理盐水组相比,差异均无统计学意义(P>0.05);BoNT/A组给药后7、14、21 d大鼠后足支撑力百分比均较生理盐水组改善明显(F=2.80~127.02,P<0.05)。见表2。
2.3 各组P2X4R表达比较
关节腔内MIA注射21 d,对照组、模型组大鼠脊髓背角内P2X4R蛋白表达量分别为0.68±0.26、1.20±0.11,两组比较差异有显著性(t=-3.178,P<0.05)。与生理盐水组相比,给药后7、14、21 d时BoNT/A组大鼠脊髓背角内P2X4R蛋白表达减少,差异有统计学意义(F=43.04~150.36,P<0.05);而各时间点倍他米松组与生理盐水组比较,脊髓背角内P2X4R的蛋白表达差异均无统计学意义(P>0.05)。见表3。
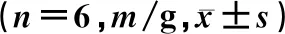
表1 给药后不同时间各组大鼠PWT比较

表2 给药后不同时间各组大鼠左侧后肢支撑力百分比比较

表3 给药后各组P2X4R蛋白表达比较
3 讨 论
骨关节炎是一种常见的关节退行性疾病,疼痛是其最主要的症状,严重影响了病人的日常生活。目前对骨关节炎疼痛的治疗主要包括药物及非药物治疗,药物治疗包括口服(非甾体类抗炎药、骨关节炎慢作用药、软骨保护剂及阿片类药物等)、关节腔注射(糖皮质激素(激素)、透明质酸等),非药物治疗包括卫生宣教、体育锻炼、减肥和针灸等[8]。虽然治疗方法比较多,但存在疼痛缓解不足、药物副作用大等问题。对骨关节炎疼痛的治疗仍是一个急需解决的问题。
本文研究采用踝关节腔内注射MIA方法诱导大鼠骨关节炎疼痛,结果显示,MIA能够导致大鼠PWT及后肢支撑力百分比明显下降,这与相关研究结果相一致[9];关节腔内注射倍他米松在给药后早期(3、7 d)能明显改善大鼠患侧后肢PWT(评估诱发性疼痛指标),但对大鼠后肢支撑力的变化(评估非诱发性疼痛指标)无明显影响;但关节腔内注射BoNT/A对大鼠PWT及后肢支撑力均有改善作用,并且这种作用可持续至给药后21 d,甚至更久,但其起效时间较倍他米松晚(7 d以后)。本文结果还显示,BoNT/A组大鼠注射侧后肢PWT及支撑力百分比明显高于倍他米松组。以上结果表明,倍他米松与BoNT/A对骨关节炎疼痛均具有镇痛作用,相较于倍他米松,虽然BoNT/A治疗骨关节炎疼痛起效时间较慢,但其镇痛作用持续时间更长、效果更明显。
倍他米松是关节腔内注射治疗最常用的激素之一,其能抑制炎症递质IL-6和IL-8等的表达,从而消除关节内炎症,减轻组织水肿而迅速发挥镇痛作用[10],这可能与倍他米松注射早期即可改善大鼠患侧后肢PWT有关。但骨关节炎并不是单纯的炎症性疼痛,许多临床及前临床试验证实骨关节炎中还存在神经病理性疼痛[11-13];本实验所使用的MIA诱导的动物模型同样被证实存在关节周围神经的损伤[6,14-15]。而倍他米松缺乏对神经病理性痛的调节作用,这可能是其对后肢支撑力(更能反映神经病理性痛中自发性疼痛特点)的变化无明显影响的原因。P2X4R是一种主要表达于脊髓小胶质细胞上、与神经病理性痛产生和维持密切相关的嘌呤受体。当周围神经损伤后,脊髓背角内小胶质细胞上的P2X4R表达明显上调,与脊髓背角内增多的ATP相结合后诱导脊髓小胶质细胞活化,活化的脊髓小胶质细胞释放神经源性营养因子BDNF,作用于中间抑制神经元上的TRK-B受体,使中间抑制神经元超极化,产生去抑制作用,从而使神经元兴奋性增高,产生痛觉过敏及痛觉超敏[16-17]。抑制P2X4R或敲除大鼠P2X4R基因能使坐骨结扎大鼠疼痛行为缺失[17-18]。本实验同样显示关节腔内注射MIA 21 d后L4~L6脊髓节段内P2X4R的表达上调,表明MIA诱导的骨性关节炎中可能存在神经病理性痛;而关节腔内注射BoNT/A能明显逆转这种MIA诱导的P2X4R蛋白表达的升高,表明BoNT/A有可能通过影响P2X4R蛋白的表达而对骨关节炎的神经病理性痛产生镇痛作用。而BoNT/A如何影响P2X4R蛋白水平,是否能对其产生直接的作用仍需进一步的研究。有研究显示,BoNT/A不仅能在注射部位发挥作用,还能通过逆向轴浆运输到达背根神经节,影响TRPV1的表达产生镇痛效果[19]。更有实验发现,关节腔内注射BoNT/A可逆向轴浆运输至脊髓背角内[20]。既往研究表明,BoNT/A不仅能作用于神经元细胞,还能作用于脊髓小胶质细胞,调节两者之间的相互作用而对神经病理性痛产生镇痛作用[21]。已有体外实验结果显示,BoNT/A能够逆转Lipopolysaccharide诱导的脊髓小胶质细胞的激活[22],说明BoNT/A对小胶质细胞有直接作用。我们小组既往研究结果显示,BoNT/A在分子构型上与P2X4R有很强的亲和力[23]。提示BoNT/A有可能通过逆向轴浆运输到脊髓内对P2X4R产生直接的调节作用。此外,我们前期研究也显示,在CFA诱导的难治性关节炎大鼠模型中,关节腔内注射BoNT/A能通过抑制踝关节腔滑膜内炎症递质IL-1β的释放,减轻局部滑膜炎症,从而缓解大鼠疼痛相关行为[24],表明BoNT/A还存在抗炎作用。也就是说BoNT/A不仅能对骨关节炎大鼠的炎症性疼痛产生镇痛作用,还能对骨关节炎大鼠的神经病理性痛进行调节,这可能是BoNT/A镇痛作用优于倍他米松的原因。但BoNT/A关节腔注射后需要经神经末梢吸收发挥作用,BoNT/A是一种大分子蛋白,经神经末梢吸收缓慢,这可能是其镇痛作用相较于倍他米松滞后的原因。
综上所述,倍他米松以及BoNT/A均能缓解MIA诱导的骨关节炎大鼠的疼痛行为;但相较于倍他米松,BoNT/A治疗的镇痛作用更明显,作用时间更长,并且在实验过程中未观察到明显不良反应。倍他米松的镇痛作用更多依赖于其抗炎作用,随着抗炎效果的消退,其镇痛作用也逐渐减退。BoNT/A不仅具有抗炎作用,还能通过调节脊髓背角内P2X4R蛋白的表达而缓解骨关节炎的神经病理性痛,而且BoNT/A在体内神经元中的活性可持续长达5个月[25],可对脊髓背角内P2X4R蛋白的表达产生持久的调节作用,这可能是BoNT/A相较于倍他米松具有更持续镇痛效果的原因。因此,就骨关节炎治疗远期效果而言,关节腔内注射BoNT/A优于倍他米松。

