亮氨酸通过上调糖氧剥夺损伤皮质神经元HIF-1α表达发挥神经保护作用
姚旭进,任近阳,孔祥一,孙江东,林韬,万芪
(青岛大学神经再生与康复研究院,山东 青岛 266071)
缺血性脑卒中是一种高发病率、高致残率、高致死率的脑血管疾病[1]。大脑局部的血液供应不足或停滞,会使相应部位的神经元周围形成低氧状态。低氧诱导因子-1α(HIF-1α)将在低氧条件下表达积累。作为一种转录因子,HIF-1α通过对其下游靶基因的调控,在血管再生、炎症、细胞增殖分化及肿瘤生长等方面均起到重要的调节作用。研究结果表明,稳定HIF-1α具有一定的神经保护作用[2]。亮氨酸(Leu)作为一种支链氨基酸发挥着重要作用,已有研究表明,Leu能促进颅脑损伤病人认知功能的康复以及营养水平的提高[3],但其在脑缺血中的研究甚少。本研究利用糖氧剥夺(OGD)处理的皮质神经元作为体外脑缺血模型,探究Leu对OGD损伤皮质神经元的神经保护作用,以及Leu对HIF-1α水平的调节作用。现将结果报告如下。
1 材料与方法
1.1 实验材料
1.1.1实验动物 SPF级、孕18 d的健康SD大鼠购自济南朋悦实验动物繁育有限公司,动物合格证号SCXK(鲁)2014007,饲养于青岛大学医学部实验动物中心。
1.1.2主要试剂 细胞培养试剂neurobasal me-dium、B-27 Supplement、DMEM-H-Glucose、Trypsin-EDTA、HEPES、glutaMax 100×、青霉素-链霉素(100×)均购自Gibico公司;胎牛血清购自四季青公司;抗HIF-1α兔单克隆抗体、抗β-actin兔单克隆抗体、抗MAP2小鼠单克隆抗体购自Cell Signaling Technology公司;台盼蓝、抗荧光衰减封片剂(含有DAPI)、二甲基亚砜(DMSO,细胞培养级)、DMOG购自CSNpharm公司;PMSF(0.1 mol/L)、蛋白磷酸酶抑制剂混合物(All-in-one,100×)购自北京索莱宝科技有限公司;多聚赖氨酸购自美国Sigma公司;BAY87-2243、RIPA裂解液以及乳酸脱氢酶(LDH)细胞毒性检测试剂盒购自上海碧云天生物技术有限公司;增强型CCK-8试剂盒购自北京博奥森生物技术有限公司。
1.2 实验方法
1.2.1原代神经元培养 取孕18 d的健康SD大鼠,用异氟烷气体麻醉后脱颈处死,取出胎鼠,用体积分数0.75的乙醇消毒后置于冰上。在光学显微镜下剥离颅骨、脑膜,机械分离大脑皮质,暂时存放于DMEM培养液中。以900 r/min离心5 min,弃上清,加入0.5 g/L胰蛋白酶消化20 min,加入胎牛血清终止消化。以900 r/min离心5 min,弃上清,加入无血清培养液(neurobasal medium 50 mL,含有B-27 Supplement 1 mL、glutaMax 100×0.5 mL、青霉素-链霉素(100×)0.5 mL),反复缓慢吹打,滤布过滤。将细胞以1.2×105/cm2的密度接种于多聚赖氨酸包被的培养皿和孔板中,此后每3 d更换无血清培养液1次。
1.2.2OGD/再灌注损伤模型制备 原代神经元培养7 d后,以磷酸盐缓冲液(PBS)轻轻冲洗 2 次,Sham组加入有糖细胞外液,OGD组加入无糖细胞外液。然后将OGD组神经元置于 37 ℃厌氧箱中低氧处理1 h(气体参数设置为体积分数0.01 O2+体积分数0.94 N2+体积分数0.05 CO2),将Sham组神经元置于正常培养箱中。氧处理结束后,将各组培养液换为等体积无血清培养液。
1.2.3实验分组 为了探讨Leu对OGD损伤神经元存活的作用,实验分为Control组、OGD 3 h组、OGD 3 h+Leu组、OGD 6 h组、OGD 6 h+Leu组。为了探讨Leu对正常皮质神经元HIF-1α蛋白表达的作用,实验分为Control组、Leu组。为了探讨OGD损伤神经元HIF-1α蛋白表达的变化,实验分为Control组、Sham 3 h组、OGD 3 h组、Sham 6 h组和OGD 6 h组。为了探讨Leu对OGD损伤皮质神经元HIF-1α蛋白表达的作用,实验分为Control组、OGD组和OGD+Leu组。为了探讨HIF-1α水平对Leu调节的损伤神经元存活的影响,实验分为Control组(A组)、OGD组(B组)、OGD+Leu组(C组)、OGD+Leu+DMOG组(D组)、OGD+Leu+BAY87-2243组(E组)。50 μmol/L Leu在复氧时加入;100 μmol/L DMOG和BAY87-2243在复氧开始时加入。后面两个实验蛋白质含量及免疫荧光检测均在OGD后3 h进行。
1.2.4HIF-1α蛋白的免疫印迹法(Western blot)检测 相应各组在复氧 3、6 h时提取蛋白质。用RIPA裂解液在冰上裂解细胞,离心后取上清,提取各组神经元细胞蛋白,用BCA法检测蛋白浓度。配制相应的分离胶和浓缩胶,按每孔10 μg 蛋白计算上样量,电泳后转移至PDVF膜上。以含50 g/L脱脂奶粉的TBST溶液室温封闭1 h,再分别加入抗HIF-1α兔单克隆抗体、抗β-actin兔单克隆抗体(均1∶1 000稀释),4 ℃孵育过夜。以TBST溶液清洗PDVF膜3次,每次10 min,然后加入相应的辣根过氧化物酶标记的二抗(1∶10 000稀释)室温孵育1 h。以TBST溶液清洗PDVF膜3次,每次10 min,用ECL发光剂显影。采用Image J 软件对蛋白条带进行半定量分析,以HIF-1α和β-actin条带灰度值的比值表示蛋白表达水平。实验重复 3 次,取平均值。
1.2.5神经元存活检测 分别采用免疫荧光染色法、CCK-8比色法、LDH释放实验、台盼蓝染色法检测神经元存活变化。
1.2.5.1免疫荧光染色法 用PBS漂洗细胞片3次,每次5 min,每孔加入40 g/L细胞组织固定液200 μL,室温固定20 min;以PBS漂洗细胞片3次,每次5 min,每孔加入含有2.5 g/L Triton X-100、30 g/L牛血清清蛋白(BSA)的封闭液200 μL,室温封闭1 h;每孔加封闭液200 μL并加入抗MAP2小鼠单克隆抗体(1∶500稀释), 4 ℃孵育过夜。次日于室温下以PBST 漂洗3次,每次5 min;每孔加入约 200 μL 荧光二抗避光室温孵育2 h后,以PBS漂洗 3次,每次5 min。封片,在荧光显微镜下观察并采集图像。
1.2.5.2CCK-8比色法 在复氧24 h后检测神经元存活率。更换新培养液后,每孔加入CCK-8溶液(避免气泡产生)10 μL,将培养板置于培养箱中孵育4 h。用酶标仪测定450 nm波长处的吸光度,计算细胞存活率。
1.2.5.3LDH释放实验 在复氧24 h后检测神经元LDH释放率。更换新培养液后,每孔加入 10 μL的LDH释放剂,摇匀,继续放回细胞培养箱中孵育。1 h后将细胞培养板用多孔离心机离心 5 min,分别取上清120 μL,加入到一新的96孔板相应孔中,随即进行样品测定,判断细胞死亡变化。
1.2.5.4台盼蓝染色法 在复氧24 h后检测神经元台盼蓝染色阳性率。皮质神经元经台盼蓝染色后,死亡细胞被染成蓝色,未着色细胞为存活细胞。随机计数15个细胞视野,计算台盼蓝染色阳性率。台盼蓝染色阳性率=(蓝色细胞数/细胞总数)×100%。
1.3 统计学分析
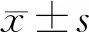
2 结 果
2.1 Leu对OGD损伤神经元存活的影响
OGD损伤及加入Leu后,培养神经元的存活变化见图1。各组神经元存活率、LDH释放率、台盼蓝染色阳性率比较差异均有显著性(F=76.69~236.30,P<0.01)。OGD 3 h+Leu组与OGD 3 h组相比较,细胞存活率增加(t=14.82,P<0.05),LDH释放率和台盼蓝染色阳性率降低(t=5.31、4.54,P<0.05)。OGD 6 h+Leu组与OGD 6 h组相比,细胞存活率增加(t=5.78,P<0.05),LDH释放率和台盼蓝染色阳性率降低(t=3.64、3.07,P<0.05)。见表1。

A:MAP2免疫荧光标记的各组皮质神经元;B:台盼蓝染色标记的各组皮质神经元。
2.2 Leu对正常神经元HIF-1α表达的影响
Control组和Leu组正常皮质神经元的HIF-1α蛋白表达水平分别为0.27±0.05和0.66±0.07(n=6),Leu组HIF-1α蛋白表达水平较Control组明显上升(t=11.03,P<0.05)。见图2。
2.3 OGD损伤神经元内HIF-1α水平变化
Western blot检测结果显示,各组皮质神经元HIF-1α蛋白的表达水平比较差异有显著性(n=6,F=183.40,P<0.01)。OGD 3 h组(0.97±0.14)与Sham 3 h组(0.23±0.04)相比,HIF-1α蛋白表达明显上升(t=13.74,P<0.05);OGD 6 h组(1.35±0.13)与Sham 6 h组(0.27±0.05)相比, HIF-1α蛋白表达也明显上升(t=20.03,P<0.05)。见图3。

表1 Leu对OGD损伤皮质神经元存活的影响

图2 Leu对正常皮质神经元HIF-1α蛋白表达影响的Western blot检测

图3 OGD损伤皮质神经元HIF-1α蛋白表达变化的Western blot检测
2.4 Leu对OGD损伤神经元HIF-1α表达的影响
Western blot检测结果显示,各组皮质神经元HIF-1α蛋白的表达水平比较差异有显著性(n=6,F=241.80,P<0.01)。在OGD 3 h后,OGD+Leu组的HIF-1α蛋白表达水平(1.52±0.104)与OGD组(1.09±0.15)相比明显上升(t=5.84,P<0.05)。见图4。

图4 Leu对OGD损伤皮质神经元HIF-1α蛋白表达影响的Western blot检测
2.5 HIF-1α水平对Leu调节的损伤神经元存活的影响
利用DMOG、BAY87-2243作为HIF-1α的激动剂和抑制剂分别激动和抑制HIF-1α,检测Leu保护作用的变化[4-5]。各组培养神经元的存活变化见图5。各组神经元存活率、LDH释放率、台盼蓝染色阳性率比较差异有显著性(F=84.30~320.70,P<0.01)。与OGD+Leu 组相比较,OGD+Leu+DMOG组的细胞存活率升高(t=6.37,P<0.05),LDH释放率和台盼蓝染色阳性率均明显降低(t=3.56、3.84,P<0.05);OGD+Leu+BAY87-2243组细胞存活率进一步降低(t=18.22,P<0.05),LDH释放率和台盼蓝染色阳性率增高(t=5.67、7.15,P<0.05)。见表2。

A:MAP2免疫荧光标记的各组皮质神经元;B:台盼蓝染色标记的各组皮质神经元。
3 讨 论
缺血性脑卒中是一种极易致残、致死的脑血管疾病[1]。一直以来,虽有大量的研究,但该病仍未有理想的治疗方案。目前,除了静脉溶栓、血管内介入外,神经保护治疗也取得很大的进展[6]。
Leu是人体必需的支链氨基酸。食物补充的Leu能通过血-脑脊液屏障进入中枢神经系统[7]。在中枢神经系统里,Leu通过调节谷氨酸/谷氨酰胺的氮质传递,参与神经递质的合成。有研究表明,血液中水平升高的Leu会通过激活下丘脑区域的神经元内的mTOR通路,调控食欲与摄食[8-9]。持续补充Leu可以提高骨骼肌细胞内的合成代谢,并提高肌肉质量。临床研究发现,高Leu营养补充有助于癌症病人运动能力的改善[10-12]。在C2C12细胞内,Leu通过SIRT1-AMPK通路促进线粒体内的生物合成。已知Leu能有效干预脑缺血损伤后的自噬病变[13-14]。Leu作为mTOR信号通路的重要调控因子,在小肠表皮细胞中能降低活性氧(ROS)水平,并通过mTOR-HIF-1α通路使氧化磷酸化转向糖酵解[15-17]。

表2 HIF-1α水平对Leu调节的损伤神经元存活的影响
在正常情况下,HIF的α亚基可被脯氨酰-羟化酶快速羟基化[18],进而进一步被降解。因此,正常状态下HIF-1α的含量低[19]。在低氧条件下,HIF-1α降解受阻,可在细胞核内调节各种下游靶基因转录。HIF-1α神经细胞特定缺陷的小鼠常伴有脑积水、记忆衰退等症状[20]。在肿瘤中,HIF-1α可通过调节血管内皮生长因子(VEGF)的表达,引起肿瘤血管的生长,促进肿瘤细胞的侵袭与转移[21]。在颅脑损伤中,低氧预处理可通过上调HIF-1α的表达,提高脑组织对低氧耐受能力及血管内皮细胞功能活化,进而减轻损伤[22-23]。有实验结果表明,低氧适应通过激活上调HIF-1α表达,明显降低OGD导致的SH-SY5Y细胞凋亡,具有保护作用[24]。总之,在损伤早期,HIF-1α被认为具有保护作用[25]。
本研究通过培养原代皮质神经元,采用OGD/再灌注建立体外模型,证实了Leu对缺血性脑损伤神经元的作用及其靶点。OGD损伤后,神经元中HIF-1α蛋白水平随时间延长而增加。Leu处理进一步上调了HIF-1α表达水平,使神经元存活率上升。并且利用HIF-1α抑制剂和激动剂证明了Leu通过HIF-1α发挥神经保护作用。已知Leu具有促进蛋白质合成和抑制蛋白质降解的功能,它可能通过激活mTOR,进一步促进HIF-1α的转录[26],上调HIF-1α的表达水平。蓄积的HIF-1α能够触发与糖酵解、葡萄糖代谢、线粒体功能、细胞生存等相关的基因的表达。还有研究表明,HIF-1α可以促进红细胞生成素(Epo)和VEGF的表达[27],而Epo、VEGF已知对缺血性脑损伤具有明显的神经保护作用,能减少细胞凋亡,促进细胞存活,缩小脑梗死体积。另一种可能是,上调的HIF-1α通过抑制P53介导的细胞凋亡减少OGD引起的神经元死亡[28]。补充Leu也可能通过促进mTOR、减弱LC3-Ⅱ的表达,对自噬起一定抑制作用,从而发挥神经保护作用[29]。Leu还有许多其他作用,例如作为一种特殊的生酮氨基酸,Leu会被代谢成乙酰辅酶A,而后者是一种直接供应三羧酸循环的能源物质。乙酰辅酶A是组蛋白乙酰化中乙酰基的来源,因此,Leu也可能通过影响细胞表观遗传对OGD损伤后的神经元产生作用[30]。
综上所述,本实验表明Leu通过上调HIF-1α表达对OGD/再灌注损伤的皮质神经元发挥了神经保护作用。Leu作为人体必需的氨基酸,广泛存在于各种蛋白类食物中,并且是术后肠外营养的必要成分之一。深入研究Leu对缺血性脑损伤的作用及潜在机制对该病病人的早期药物治疗以及营养补充具有重要意义。但是本研究仅在细胞层面初步探究了Leu对脑缺血后神经元的作用及可能机制,其具体作用机制以及动物实验还有待进一步研究。

