降钙素基因相关肽对LPS并ATP诱导小胶质细胞NLRP3炎症小体激活影响
郭蜜,向建琴,张健,李忠正,邱继文,崔银洁
(1 天津中医药大学实验针灸学研究中心,天津 301600; 2 重庆市陆军军医大学第一附属医院健康管理科)
小胶质细胞在中枢神经系统的免疫调节过程中发挥核心作用[1]。研究发现,小胶质细胞中NOD样受体热蛋白结构域相关蛋白3(NLRP3)在人类轻度认知障碍和阿尔兹海默病(AD)等神经变性疾病中发挥着重要的作用[2-3]。NLRP3作为最具有特色的炎症小体,是胞浆内识别受体NOD样受体家族的一员,当细胞受到感染、组织损伤等刺激时,被激活的NLRP3能够通过结合凋亡相关的斑点样蛋白(ASC)招募半胱氨酸天冬氨酸蛋白酶-1(caspase-1)前体形成NLRP3炎症小体,从而促进caspase-1前体激活成为caspase-1,诱导白细胞介素1β(IL-1β)和白细胞介素18(IL-18)的成熟[4]。降钙素基因相关肽(CGRP)是一种神经肽类物质,可以直接作用于巨噬细胞和树突状细胞,抑制IL-1β的生成与释放[5-7]。本团队前期研究显示,CGRP可以改善脊髓损伤大鼠的运动功能,抑制半胱氨酸天冬氨酸蛋白酶-3(caspase-3)的表达,具有神经保护作用,但其分子机制仍不清楚[8]。NLRP3炎症小体的激活能够促进大量IL-1β的产生,而CGRP可以抑制IL-1β的生理功能,CGRP与NLRP3炎症小体之间可能存在着一定的联系。为了进一步探明二者关系,本研究采用脂多糖(LPS)与三磷酸腺苷(ATP)诱导的BV2小胶质细胞炎症小体激活模型,从NLRP3炎症小体途径探讨CGRP的神经保护机制。
1 材料与方法
1.1 实验材料
BV2小胶质细胞,购自Santa Cruz Biotechno-logy公司。胎牛血清(Cell Signaling Technology);LPS(爱必信);ATP(FERMRNTAS);β-actin(Santa Cruz Biotechnology);CGRP抗体(北京义翘神州科技有限公司);ASC、caspase-1和NLRP3抗体(abcam);酶联免疫吸附试验(ELISA)检测试剂盒(南京建成生物工程研究所);BCA蛋白定量试剂盒(博士德生物工程有限公司);ECL显影液和PVDF膜(Millipore);HRP标记二抗(Sigma)。全波长酶标仪(Bio-tek,ELX 800);垂直电泳装置(北京市六一仪器厂,DYCZ-24DN);CO2恒温培养箱(ThermoForma,form 1341);LabWorksTM凝胶成像及分析系统(美国UVP公司,GelDoc-It310)。
1.2 实验方法
1.2.1细胞培养与传代 BV2小胶质细胞置于含体积分数0.10胎牛血清和10 g/L双抗的RPMI 1640培养液中,放于37 ℃的CO2细胞培养箱中,待细胞生长融合率80%时传代,隔2 d传代1次,传代3次后且细胞状态良好时用于后续实验。
1.2.2LPS联合ATP激活小胶质细胞最佳模型确定及CGRP最佳剂量筛选 将细胞分为6组,依据有关文献确定两种细胞模型处理条件[9-11]。对照组细胞用含体积分数0.10胎牛血清的DMEM/F12培养液培养;模型1组细胞先加入100 μg/L的LPS作用12 h,然后再加入5 mmol/L的ATP继续作用45 min;模型2组细胞先加入100 μg/L的LPS作用4 h,然后再加入5 mmol/L的ATP继续作用45 min;CGRP1、CGRP10、CGRP100组细胞先分别用1、10、100 μg/L的CGRP预处理1 h,然后加入100 μg/L的LPS作用12 h,再加入5 mmol/L的ATP继续作用45 min。根据NLRP3蛋白含量筛选出最佳模型和CGRP的最佳作用浓度进行后续实验。
1.2.3细胞NLRP3、capase-1、ASC蛋白表达的检测 采用蛋白免疫印迹法检测对照组(A组)、模型组(按筛选出的最佳模型制备方法进行处理,B组)、CGRP组(按筛选出的最佳作用浓度的CGRP进行处理,C组)细胞中NLRP3、capase-1和ASC的含量。样品裂解后提取蛋白,采用BCA蛋白定量试剂盒检测蛋白浓度。蛋白经SDS-PAGE凝胶电泳分离后,浸入脱脂奶粉封闭液中,室温下于摇床上轻轻摇动2 h;然后分别加入兔抗人单克隆NLRP3抗体(1∶100)、ASC抗体(1∶50)、capase-1(1∶200)抗体以及兔抗人多克隆GAPDH抗体(1∶500)4 ℃孵育过夜。TBS-T洗膜后,将膜于含对应二抗(HRP标记二抗)的脱脂奶粉溶液中,室温作用1.5 h,用ECL显影液显影,用LabWorksTM凝胶成像及分析系统摄像,分析条带的光密度值。
1.2.4细胞IL-1β表达的ELISA检测 收集对照组、模型组和CGRP组的细胞培养上清液,严格按照IL-1β检测试剂盒的说明进行检测。反应终止后使用全波长酶标仪于450 nm波长处检测吸光度值,根据标准品浓度和吸光度值做标准曲线,计算各组样本吸光度值对应的浓度值。
1.3 统计学分析
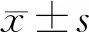
2 结 果
2.1 最佳模型与CGRP最佳作用浓度
对照组、模型1组、模型2组以及CGRP1、CGRP10、CGRP100组NLRP3蛋白表达量分别为0.215±0.003、0.394±0.006、0.303±0.002、0.054±0.000、0.036±0.000、0.047±0.000(n=3)。对照组、模型1组、模型2组NLRP3表达量比较差异有统计学意义(H=7.200,P<0.05),其中模型1组NLRP3蛋白表达量最高,因此选择模型1为最佳模型进行后续实验。对照组、模型1组以及CGRP1、CGRP10、CGRP100组NLRP3表达量比较差异有统计学意义(H=13.573,P<0.05),其中CGRP10组NLRP3蛋白表达量最低,因此选择10 μg/L的CGRP进行后续实验。见图1。
2.2 CGRP对NLRP3、ASC、capase-1和IL-1β蛋白表达的影响
模型组细胞NLRP3、ASC、caspase-1、IL-1β的蛋白表达较对照组明显升高,CGRP组细胞上述蛋白表达较模型组明显降低,差异均有显著意义(F=7.261~151.232,P<0.05)。表明CGRP可以抑制炎症小体NLRP3的激活从而减轻炎症反应。见图2和表1。

图1 以NLRP3蛋白表达为标准确定最佳模型与CGRP最佳作用浓度
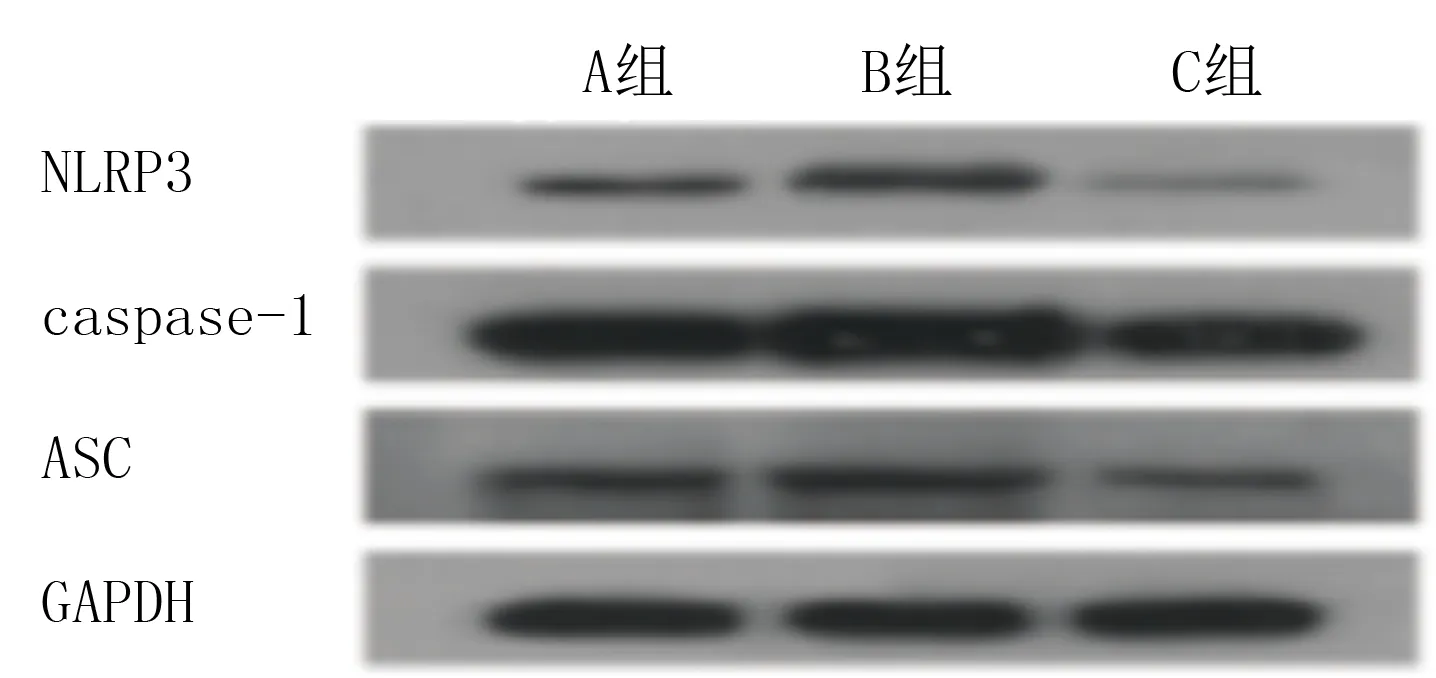
图2 各组细胞NLRP3、caspase-1和ASC表达的蛋白免疫印迹检测

表1 各组细胞NLRP3、caspase-1、ASC和IL-1β蛋白表达的比较
3 讨 论
NLRP3炎症小体异常活化产生的过度炎症反应与人类多种疾病密切相关,其中包括AD、脊髓损伤等神经系统疾病[12-13]。已有实验研究结果表明,在AD模型中,NLRP3基因敲除的小鼠空间记忆能力显著提升,运动功能障碍与多巴胺能神经元退行性病变得以改善[14];在脊髓损伤模型中,小胶质细胞内的NLRP3炎症小体活化,并进一步激活核转录因子κB(NF-κB)信号通路,形成级联式炎症反应,加速神经元的死亡[15]。因此,抑制NLRP3炎症小体的过度激活可能是预防或治疗神经炎性疾病的关键。
研究发现,体外NLRP3炎症小体的激活需要两个信号:信号1是指当细胞受到LPS的刺激时,Toll样受体4(TLR4)迅速识别,激活NF-κB通路,导致pro-IL-1β和NLRP3蛋白水平的上调;信号2是指高浓度ATP刺激P2X7,导致K+外流,促进ASC和caspase-1的集合,从而导致NLRP3炎症小体的激活[16]。有研究表明,将ATP与LPS联合激活NLRP3炎症小体,可以缩短作用时间,并且刺激效果更显著[17]。但文献中未报道LPS联合ATP激活BV2小胶质细胞NLRP3炎症小体的具体浓度与反应时间。因此,本研究首先通过实验确定LPS联合ATP激活BV2小胶质细胞NLRP3炎症小体的最佳模型,结果表明,先以100 μg/L的LPS作用12 h,然后再以5 mmol/L的ATP继续作用45 min,小胶质细胞中炎症小体的激活最为显著,因此选用该浓度和反应时间建立体外小胶质细胞NLRP3激活模型。
CGRP为一种由37个氨基酸构成的多功能神经肽,是目前已知最强的扩血管物质,尤其对脑血管扩张具有极强的作用[18]。在免疫炎症方面,CGRP具有抗炎和促炎双向调节作用。例如,注射CGRP后,烟曲霉感染的真菌性角膜炎小鼠角膜组织中的IL-1β水平明显降低,角膜炎症状随之减轻,CGRP发挥了抗炎作用[19];而在偏头痛模型中,CGRP则通过一系列反应参与三叉神经血管系统信号转导,促进神经源性炎症从而引发偏头痛[20]。为了进一步了解CGRP在炎症中的作用,本研究将不同浓度的CGRP作用于BV2小胶质细胞,结果表明CGRP可以显著抑制NLRP3炎症小体的激活,但该作用并不呈浓度依赖性。因此我们推测,CGRP发挥抗炎和促炎的不同作用可能与其组织特性有关。既往有研究还表明,CGRP具有神经保护作用,该作用可能与CGRP抑制低氧海马神经元c-fos的表达,降低高阈值钙电流,抑制低氧时细胞外钙离子内流有关[21],但其具体机制尚不很清楚。本团队在研究CGRP与炎症关系时显示,CGRP和NLRP3炎症小体之间存在着千丝万缕的关系:CGRP可以抑制IL-1β和抗原呈递细胞,而NLRP3炎症小体的激活则可以促进IL-1β的表达[22];对比CGRP与NLRP3细胞内激活与传递途径显示,二者存在共同的信号通路cAMP/PKA[23-24]。因此,我们推测CGRP与NLRP3之间可能存在一定的调控关系,故而设计了本次实验。本文结果表明,CGRP可以降低LPS联合ATP诱导的BV2小胶质细胞中NLRP3、ASC和caspase-1的蛋白含量,减少细胞中IL-1β的表达,提示CGRP可以抑制小胶质细胞中NLRP3炎症小体的激活。本研究揭示了CGRP神经保护的又一作用机制,为临床上CGRP治疗神经炎性疾病提供了实验依据。

