氯化锌控根处理对榉树容器苗生长及生理特性的影响
刘泽茂,晏 昕,吴 文,张于卉,喻方圆
(1.南京林业大学 a.南方现代林业协同创新中心;b.林学院,江苏 南京 210037;2.高邮市林业技术指导站,江苏 高邮 225600;3.上海市林业总站,上海 200040)
榉树Zelkova serrata为榆科Ulmaceae 榉属Zelkova落叶乔木,是我国的特有种,其树形优美,冠幅庞大,叶色季相变化丰富,是重要的硬阔叶用材树种和园林绿化景观树种[1-3]。近年来,随着我国经济和城市绿化的发展,市场对于优质榉树苗的需求量在持续增加。然而,榉树种子萌发率较低,自然更新速度慢,再加上大规模砍伐和气候变化等原因,榉树的数量越来越少,分布范围变窄成为了濒危树种,已被列为我国Ⅱ级保护植物和国际自然保护联盟(IUCN)的濒危物种红色名录[4-5]。改进育苗技术,尽快培育优质榉树苗木以满足日益增长的市场需求已迫在眉睫[4]。使用容器育苗的方法,有利于通过机械化模式提高育苗的质量和效率。根系是容器苗培育的重点,而根系畸形对于容器幼苗的培育则是一个持续的挑战[6]。由于育苗容器内部空间有限,苗木侧根常会沿着容器壁不断向下生长,使得根的活跃生长点聚集在容器下部,导致根系在容器下部缠绕成团[7-8]。根系畸形会使得苗木侧根数量减少,影响根系构型,减弱根系功能,使得苗木对非生物胁迫等更敏感,严重影响其移栽后的成活率和田间表现[8-11]。
为了解决根系畸形的问题,在容器苗培育的过程中常采用一些控根技术,按其原理可分为:空气控根、物理控根和化学控根。其目的均为在根系顶端去除生长点以实现对根系的修剪[9]。采用空气控根和物理控根的容器,不仅其制作工艺较难,使得容器的造价相对较高,且空气控根时必须将容器架空放置才能获得好的效果[9],并且架空放置一方面提高了育苗成本,另一方面还加速了基质中水分和养分的流失[12]。而化学控根工艺简单,价格相对便宜,对育苗环境要求也相对较低,在世界范围内应用广泛[13-14]。
榉树的根系较发达且根系水平延伸距离较大[15],在其容器育苗时易因根系缠绕盘旋而出现根系畸形。但目前关于榉树容器苗控根方面的研究鲜有报道。本试验以榉树为试验对象,研究不同浓度氯化锌试剂对其容器苗根系形态及生理状况的影响,以期解决榉树容器苗培育中的根系畸形问题,从而为榉树优质苗木培育提供理论依据和实践参考。
1 材料与方法
1.1 试验材料
试验地点位于上海市宝山区森林植被种质资源基地(121°28′48′′E,31°24′36′′N)。该地区属于亚热带季风气候,四季分明;年日照时数约为1 900 h;年降水量约为1 142 mm;年平均气温15.3℃,无霜期约230 d,适宜榉树的生长。
在2019年4月上旬,将2018年11月中旬采集于江苏新沂的榉树种子经过NaOH处理后洗净,在穴盘中进行播种。待苗高长至约为5 cm 时,取正常生长、长势一致的幼苗,将其移栽至白色无纺布容器(12 cm×18 cm,直径×高)中。事先按照试验设计要求(见1.2),在容器内壁及底部均匀地涂上不同浓度的氯化锌试剂,且涂层的厚度不超过0.5 mm。使用的育苗基质为泥炭∶珍珠岩∶有机肥=7∶2∶1(体积比)。
1.2 试验设计
本试验为单因素随机区组试验设计。氯化锌试剂设置4 个水平,分别为0、60、120、180 g/L,共3 个处理组和1 个对照。每个处理设置3 个重复,每个重复30 株幼苗。试验于2019年6月中旬开始,至11月中下旬结束。
1.3 苗木形态指标测定
1.3.1 苗高、地径
11月苗木生长停止后,测量所有榉树容器苗的苗高和地径。用卷尺测量苗高,精度为0.1 cm;用游标卡尺测量地径,精度为0.01 mm,并计算高径比。
1.3.2 根系指标
11月苗木生长停止后,于每小区随机抽取5株榉树容器苗。用水将根系清洗干净后,将每小区的5 株榉树容器苗分别单独置于EPSON 扫描仪下扫描获得透射图像,再用WinRHIZO PRO 2007 软件分析根系的图像。测定的根系指标包括根系总长、根表面积和根系总体积。通过观察得出直径大于1 mm 的一级侧根数(主根上的细根不包括在内)。
1.3.3 生物量
在进行根系扫描后,将上述每小区5 株榉树容器苗分别按地上部分、地下部分分开,地下部分中的细根(直径≤2 mm)也被单独分开,装入牛皮纸信封,放入烘箱中烘干,先于105℃杀青30 min,再于70℃烘至恒质量,使用电子天平(精度为0.001 g)称质量,最后将细根的生物量纳入地下部分的生物量。
1.4 苗木生理指标测定
在根系扫描后、生物量测定前,从1.3.3 每小区5 株榉树容器苗中取出少量新鲜侧根混合后进行可溶性糖含量、淀粉含量、可溶性蛋白含量、过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量的测定。具体方法为:从每一小区的混合样品中各随机取1 份0.2 g 的新鲜根系,采用蒽酮比色法测定可溶性糖含量和淀粉含量[16],采用考马斯亮蓝B-250 法测定可溶性蛋白含量[17],采用愈创木酚比色法测定过氧化物酶(POD)活性[18],采用氮蓝四唑法(NBT 法)测定超氧化物歧化酶(SOD)活性[18],采用巴比妥酸显色法(TBA 法)测定MDA 含量[18]。
1.5 数据处理
所有测定结果以平均值±标准差显示。采用Excel 2010 软件进行数据处理。用SPSS 23.0 软件进行方差分析及Duncan 多重比较。
2 结果与分析
2.1 氯化锌控根对榉树容器苗生长状况的影响
2.1.1 氯化锌控根对榉树容器苗苗高、地径、高径比的影响
氯化锌处理对榉树容器苗苗高、地径、高径比的影响如表1所示。苗高由大到小依次为T2、T1>T3>CK,各处理与对照差异显著,T2、T1、T3处理下苗高分别比对照提高了34.39%、30.62%和17.86%。。地径由大到小依次为T2>T3、T1>CK,各处理与对照差异显著,T2、T3、T1处理下地径分别相较对照提高了22.06%、15.53%和11.47%。
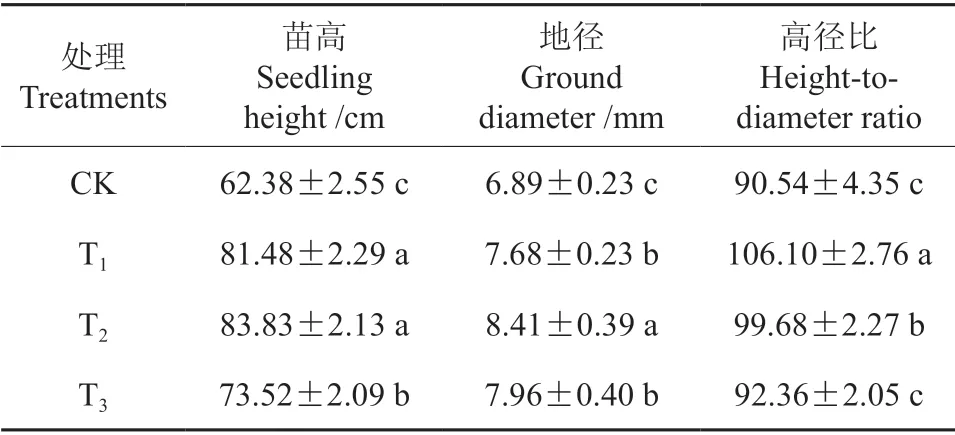
表1 氯化锌处理对榉树容器苗苗高、地径、高径比的影响†Table 1 Effects of zinc chloride treatments on the height,diameter and height-diameter ratio of Z.serrata container seedlings
高径比由大到小依次为T1>T2>T3、CK,T1、T2明显增加了榉树容器苗的高径比,分别提高了17.19%和10.09%。
2.1.2 氯化锌控根对榉树容器苗生物量的影响
氯化锌处理对榉树容器苗各部分生物量的影响如表2所示。地上部分生物量和地下部分生物量由大到小依次都为T2>T1>T3>CK,且对于两部分生物量,各处理与对照均差异显著。T2、T1、T3处理下地上部分生物量比对照分别增加了106.07%、73.99%和53.74%,地下部分生物量比对照分别增加了82.75%、67.69%和42.36%。
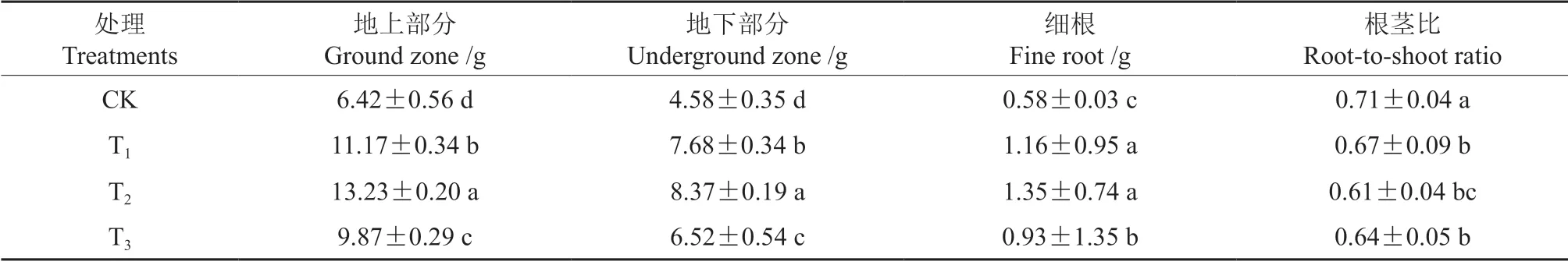
表2 氯化锌处理对榉树容器苗生物量的影响Table 2 Effects of zinc chloride treatments on the dry weight of Z.serrata container seedlings
细根生物量由大到小依次为T2、T1>T3>CK,且各处理与对照均差异显著。T2、T1、T3处理下细根生物量比对照分别增加132.76%、100.00%和60.34%。
根茎比由大到小依次为CK>T1、T3>T2,T2、T3、T1处理下的根茎比相较于对照处理分别降低了14.08%、9.86%和5.63%。
2.1.3 氯化锌控根对榉树容器苗根系形态的影响
氯化锌处理对榉树容器苗根系形态指标的影响如表3所示。一级侧根数由大到小依次为T2、T1>T3>CK,各处理与对照差异显著,T2、T1、T3处理下一级侧根数比对照分别增加了65.02%、47.70%和37.10%。

表3 氯化锌处理对榉树容器苗根系形态指标的影响Table 3 Effects of zinc chloride treatments on the root morphological indexes of Z.serrata container seedlings
根系总长和根系表面积由大到小依次均为T2>T3、T1>CK,且各处理与对照差异显著,T2、T3、T1处理下根系总长比对照分别增加了50.12%、34.97%和31.54%。
根系总体积由大到小依次为T2、T1>T3>CK,各处理与对照差异显著,T2、T1、T3处理下根系总体积比对照分别增加了72.97%、58.38%和33.82%。
2.1.4 氯化锌控根对榉树容器苗不同直径根系长度的影响
氯化锌处理对榉树容器苗不同直径的根系长度的影响如表4所示。直径在0 至0.5 mm 的根系长度由大到小依次为T2>T3、T1>CK,T2、T3、T1处理下根系长度比对照分别增加了41.97%、24.62% 和23.24%;直径在0.5 至1.0 mm 的根系长度由大到小依次为T2、T1、T3>CK,T2、T1、T3处理下根系长度比对照分别增加了50.10%、46.57%和44.25%;直径在1.0 至1.5 mm的根系长度由大到小依次为T2>T3、T1>CK,T2、T3、T1处理下根系长度比对照分别增加了89.45%、61.30% 和54.90%;直径在1.5 至2.0 mm 的根系长度由大到小依次为T2、T3、T1>CK,T2、T3、T1处理下根系长度比对照分别增加了36.13%、30.26%和21.52%。对于直径在0 至0.5 mm、0.5 至1.0 mm、1.0 至1.5 mm 和1.5 mm 至2.0 mm 的根系长度,各处理组与对照组均有显著性差异。直径在2.0 至2.5 mm 的根系长度由大到小依次为T2>T3>CK、T1;直径在2.5 至3.0 mm 的根系长度由大到小依次为T2、T3>CK、T1;直径在3.0 至3.5 mm 的根系长度由大到小依次为T1>T3、T2>CK;直径在3.5 至4.0 mm 的根系长度由大到小依次为T2>T3>T1>CK;直径在4.0 至4.5 mm 的根系长度由大到小依次为T2>T3、T1>CK;在直径大于4.5 mm 的根系长度方面,由大到小依次为CK>T1、T2>T3,对照组显著大于处理组,说明氯化锌处理会抑制主根的生长。总体来说,氯化锌的控根处理对细根(直径≤2.0 mm)的生长有明显的促进作用,对主根(直径>4.5 mm)的生长有明显的抑制作用。

表4 氯化锌处理对榉树容器苗不同直径根系长度的影响Table 4 Effects of zinc chloride treatments on the root length of Z.serrata container seedlings with different diameters
2.2 氯化锌控根对榉树容器苗根系生理状况的影响
2.2.1 氯化锌控根对榉树容器苗根系营养状况的影响
氯化锌处理对榉树容器苗根系营养物质含量的影响如表5所示。可溶性糖含量由大到小依次为T2、T1、T3>CK,对照组与处理之间差异显著,T2、T1、T3处理下可溶性糖含量相较于对照分别增加了24.19%、22.63%和16.33%。淀粉含量由大到小依次为T1>T2、T3>CK,对照组与处理之间差异显著,T1、T2、T3处理下淀粉含量相较于对照分别增加了145.05%、99.54%和68.95%。而对于可溶性蛋白含量,各处理和对照间均没有显著性差异。
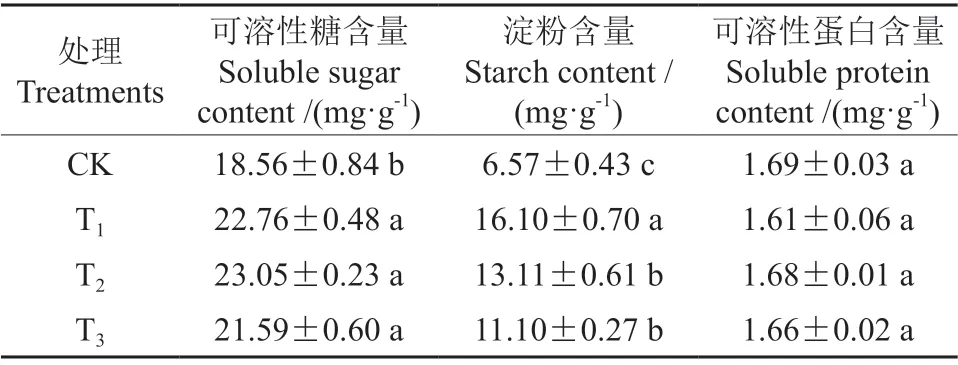
表5 氯化锌处理对榉树容器苗根系营养状况的影响Table 5 Effects of zinc chloride treatments on the root nutritional status of Z.serrata container seedlings
2.2.2 氯化锌控根对榉树容器苗根系保护酶活性及丙二醛含量的影响
氯化锌处理对榉树容器苗根系过氧化物酶(POD)和超氧化物歧化酶(SOD)活性及丙二醛(MDA)含量的影响如表6所示。POD 活性由大到小依次为T2、T3、T1>CK,SOD 活性由大到小依次为T3>T2>T1>CK,且各处理结果均与对照存在显著性差异。说明氯化锌处理下,榉树容器苗根系中POD 和SOD 的活性有显著地增加。且SOD 的活性随氯化锌浓度的增大而显著地增大,POD 的活性受氯化锌浓度的影响不大。MDA 含量大小为T1、T3、T2>CK,各处理均与对照存在显著性差异。且榉树容器苗根系的丙二醛含量受氯化锌浓度的影响不大。

表6 氯化锌处理对榉树容器苗根系保护酶活性及丙二醇含量的影响Table 6 Effects of zinc chloride treatments on the protective enzyme activities and MDA content in roots of Z.serrata container seedlings
3 结论与讨论
苗木的根系有固定植物的机械功能和吸收、运输植物生长所需的水分及养分的生理功能,还是促进芽和叶生长的激素来源,生长较快的根系能够从更广阔的土壤区域吸收养分,苗木的田间表现直接受其根系形态的影响,根系完整是容器苗优于裸根苗的主要特点[12,19-20]。本研究中,氯化锌控根处理能显著地促进榉树容器苗根系生长及其形态的改善,主要体现在显著增加了榉树容器苗的一级侧根数、根系的总长、表面积和体积,这可能有助于提高其移栽后的田间表现。本研究中,氯化锌控根处理显著地增加了榉树容器苗的苗高和地径,这可能对幼苗的田间生长有益,因为树液流量与木质部中可用的面积成正比,茎直径的增加则意味着更多的木质部结构,使得从根部到叶片的树液流量更高,同时地径与苗木根系大小及抗逆性关系紧密;而苗高的增加也意味着更高的生产力[12,14]。碳水化合物是苗木非常重要的组成物质,苗木被起出后至造林前,其生命活动全靠贮藏的碳水化合物所维持。苗木体内的非结构性碳水化合物主要包括可溶性糖和淀粉,是参与植株生命代谢的重要物质[21]。更大的根系和茎直径分别增加了水分的吸收和向叶面的运输,从而赋予了苗木更大的抗逆能力并且促进了苗木的生长[22]。这可以解释为何在本试验中,氯化锌处理能显著增加榉树容器苗根系中可溶性糖和淀粉的含量及其抗逆能力(通过根系中POD 和SOD的活性的显著增加体现)。
树木的细根(直径≤2mm)是树木与土壤物质交换的活跃部位,在树木从土壤吸取养分和水分的过程中发挥着重要的作用[23-24]。树木的细根通过物理作用等方式嵌入土壤,有生长快,寿命短,更新快的显著特点,是植物与环境之间养分和水分交换的主要器官,其快速死亡的特点还有助于土壤中有机物质的积累和物种多样性的丰富,从而促进森林系统的碳循环[25-28]。本试验中,氯化锌控根处理对细根(直径≤2.0 mm)的生长均有明显的促进作用,对主根(直径>4.5 mm)的生长均有明显的抑制作用;而对于直径在2.0 到4.5 mm 之间的根系来说,氯化锌处理对其生长的影响结果比较复杂,目前还难以得出明确结论,需要进行更多的研究加以探究和证实。以往的研究结果表明,化学控根会改变苗木新根生长点在垂直方向上的分布,增加根系中上层的新根生长点数量,使得根系生长更接近于自然状态,这不仅促进了土壤表面附近的根生长,还可能会改善其茎的垂直稳定性[14,29]。本试验中,氯化锌处理可能也改变了榉树容器苗根生长点的位置分布,使得其集中于根的上半部分。作为一种植物必需元素,生长环境中适当的锌浓度有利于植物的生长发育。Tang 等[30]对圆锥南芥Arabis paniculata的水培试验结果表明,营养液中加入适当的锌时,可以刺激其生物量和叶绿素浓度的增加。Liu 等[31]对毛竹Phyllostachys pubescens的研究结果也显示,毛竹的根系形态参数在低锌处理下有所增加。而据Palusińska 等[32]对烟草Nicotiana tabacum的水培试验结果显示,大量的基因参与调控了烟草根的不同部位对培养液中锌的吸收、保留或有效的重新分布以及向枝条的转移,导致烟草根的顶部、中部和基部中的锌含量并不相同。故笔者大胆推测,可能榉树根系对于生长环境中锌的吸收、保留或转运也具有纵向特异性,这使得根系中上部分,即根生长点较为集中的地方锌的含量有利于榉树容器苗根系的生长发育,进一步促进了榉树容器苗细根的生长发育。当然,还需要进一步的试验才能证明此猜测是否正确。
一般认为植物体内的丙二醇(MDA)含量可反映其膜脂过氧化的程度[33]。本试验中,氯化锌处理显著增加了榉树容器苗体内的MDA 含量,这可能是因为试验所用的化学试剂对榉树容器苗有轻微的重金属胁迫作用,导致其体内产生了大量的活性氧。而当植物处于胁迫状态,使得体内活性氧增加时,其体内的抗氧化物质和抗氧化酶也会相应地增加,以继续维持体内活性氧产生与清除之间的平衡[34]。但是当活性氧过多,以至于超出抗氧化系统的清除能力时,会导致其膜系统遭到破坏或损伤,细胞中的电解质外渗,影响正常的生理代谢活动,最终导致植物部分受损、生长受到抑制甚至整体死亡[33]。故判断能否选用某一浓度的化学试剂在控根时使用的一条重要依据,就是看它对苗木的重金属胁迫是否在苗木的可接受范围内。当植物体内的活性氧过多,以至于抗氧化酶无法将其及时清除时,MDA 作为过氧化产物与酶结合抑制酶活性,会导致POD 和SOD 活性的降低[35]。故可从测定苗木体内POD 和SOD活性的角度入手,对能否使用该化学试剂来控根做出初步的判断。本试验中,氯化锌处理显著增加了榉树容器苗根系中POD 和SOD 的活性。高浓度的氯化锌处理下,POD 的活性虽然比中等浓度氯化锌处理下的活性有所降低,但并没有显著性的差异。故180 g/L 的氯化锌对榉树容器苗的重金属胁迫作用仍在可接受的范围内。
综合来看,本试验中,氯化锌控根处理对榉树容器苗的生长发育和根系形态改善的促进效果,基本上随着浓度的增加呈现先上升后下降的趋势。120 g/L 的氯化锌处理最有利于榉树容器苗的生长发育和根系形态的改善,与对照相比,其一级侧根数增加了65.02%,根系总长增加了50.12%,根系表面积提高了38.85%,根系体积提高了72.97%,细根生物量增加了132.76%,细根长度增加了44.95%。故建议使用120 g/L 的氯化锌作为榉树容器苗化学控根的试剂。

