腹股沟疝无张力修补术后血清IL-17 IL-8 hs-CRP及TIMP-2水平与预后关系
汤 勇, 赵 洋, 何 兵
(四川省阆中市人民医院检验科, 四川 阆中 637400)
腹股沟疝是腹腔内脏器经缺损、破损或薄弱处外突出皮下,至腹股沟区域的一种疾病,其初期仅表现为轻微坠胀感,后期可产生较为严重的疼痛症状[1]。腹股沟疝在临床较为常见,大多均需采取手术进行治疗,近年来,为提高腹股沟疝治疗效果,临床多采用无张力修补术进行治疗,术中应用的补片可有效减轻术后疼痛,提高治疗效果[2]。但手术创伤和应激引起的炎症反应,可导致感染等并发症的发生,增加复发风险。既往报道显示,无张力修补术患者并发症和复发的发生与术后炎症因子和胶原蛋白代谢紊乱等有关[3]。血清白介素17(Interleukin 17,IL-17)、白介素8(Interleukin 8,IL-8)、超敏C-反应蛋白(High-sensitivity C-reactive protein,hs-CRP)为较为常见的炎症因子,在评估机体炎症程度和损伤方面效果显著,与术后并发症的发生有关。组织金属蛋白酶抑制剂(TIMP-2)为胶原蛋白代谢相关因子,可间接反映体内胶原蛋白代谢情况。然而目前对于腹股沟疝无张力修补术后血清IL-17、IL-8、hs-CRP、TIMP-2水平与预后关系的报道非常少,因此,笔者对腹股沟疝无张力修补术后血清IL-17、IL-8、hs-CRP及TIMP-2水平与预后关系进行分析,以为改善预后提供科学依据。
1 资料与方法
1.1一般资料:选取2019年6月至2020年6月我院收治的135例行无张力修补术的腹股沟疝患者。纳入标准:①符合《成人腹股沟疝诊断和治疗指南(2018年版)》[4]中诊断标准,经临床症状和影像学检查确诊;②年龄>18岁;③满足无张力修补术治疗指征,且自愿进行手术;④初发单侧腹股沟疝者;⑤自愿签署《知情同意书》。排除标准:①妊娠或哺乳期妇女;②既往腹腔手术史者;③术区局部严重感染或严重外伤者;④伴随嵌顿疝、股疝或绞窄者;⑤合并血液系统、自身免疫系统及严重肝肾功能异常者。所有患者术后随访12个月,根据术后是否出现并发症和复发情况进行预后判定。切口感染:切口处有红、肿、热、痛等表现,引流液细菌培养可见细菌生长;血肿:查体可探及皮下存在波动感包块,无发热、红肿,B超咳痰机液性暗区;急性尿潴留:排尿困难、腹部胀气、下腹部疼痛;复发:术后手术区域出现和术前相同或相似的明显包块,B超排除积血、积液或疝修补材料突出至皮下。其中111例无术后并发症及复发纳入预后良好组,24例出现术后并发症及复发纳入预后不良组(包括切口感染11例、血肿4例、急性尿潴留1例、复发8例)。本研究经医院伦理委员会批准[审批件(2019)伦审第(05)号]。
1.2方法:患者入室后,硬膜外全麻,取平卧位,术区常规铺巾消毒,于患者脐孔处作长10mm的切口(观察孔),置入腹腔镜,另在脐下病变侧和病变对侧分别作5mm切口,作为腹直肌外侧缘手术操作孔。确认疝的位置后,沿腹膜翻开疝囊,将疝囊充分剥离至腹膜盆壁化,分离腹膜前间隙,暴露生殖血管,取合适大小聚丙烯补片,覆盖于腹直肌、耻骨梳韧带和联合肌腱处,并固定,蛋白线缝合切口,敷料包扎。
1.3观察指标:①一般资料收集:记录两组患者性别、年龄、体质量指数(BMI)等指标。②血清IL-17、IL-8、hs-CRP及TIMP-2水平检测:术后24h,采集两组患者清晨空腹静脉血5mL,加速离心后,分离上层血清,IL-17、IL-8、hs-CRP采用免疫比浊法检测,TIMP-2采用酶联免疫吸附法检测,试剂盒均由武汉赛培生物提供,并严格按照试剂说明书进行操作。③术后随访:术后随访1年,记录术后并发症和复发情况。

2 结 果
2.1两组一般资料比较:预后不良组和预后良好组性别、年龄、BMI比较,差异无统计学意义(P>0.05);预后不良组直疝占比较预后良好组高,差异有统计学意义(P<0.05)。见表1。
表1 两组一般资料比较[n(%),±s]
2.2两组血清IL-17、IL-8、hs-CRP及TIMP-2水平比较:预后不良组血清IL-17、IL-8、hs-CRP水平高于预后良好组,TIMP-2水平低于预后良好组,差异均有统计学意义(P<0.05)。见表2。

表2 两组血清IL-17 IL-8 hs-CRP及TIMP-2水平比较±s)
2.3血清IL-17、IL-8、hs-CRP及TIMP-2对预后不良预测价值的ROC曲线分析:ROC曲线分析显示,IL-17、IL-8、hs-CRP、TIMP-2对腹股沟疝无张力修补术后预后不良预测的AUC分别为0.967、0.792、0.827、0.960,且Z检验AUC差异显示,IL-17的AUC显著较IL-8、hs-CRP高(Z=3.099、2.795,P<0.05),TIMP-2的AUC显著较IL-8、hs-CRP高(Z=3.053、2.744,P<0.05);根据最佳临界值,当IL-17高于42.41ng/L时,其敏感度为95.8%,特异度为90.1%;当IL-8高于25.43ng/L时,其敏感度为91.7%,特异度为54.1%;当hs-CRP高于40.14mg/L时,其敏感度为95.8%,特异度为64.9%;当TIMP-2低于70.72μg/L时,其敏感度为91.9%,特异度为91.7%。见表3、图1。
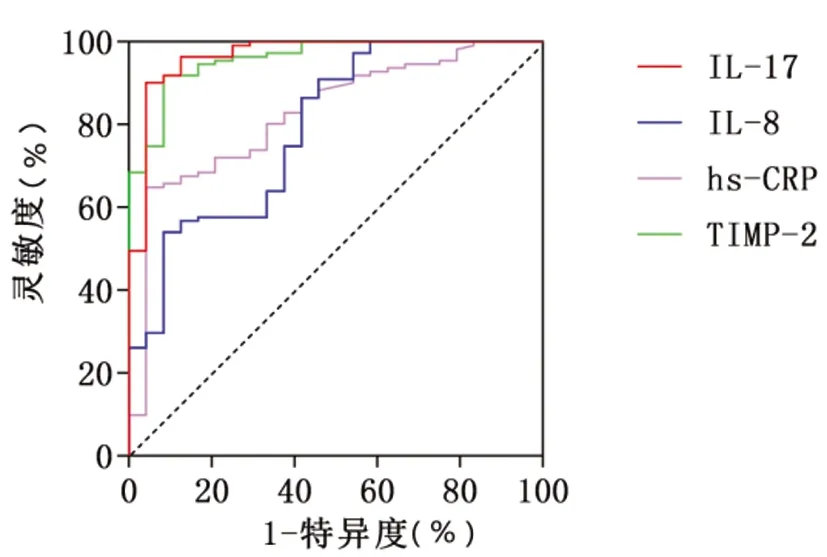
图1 血清IL-17、IL-8、hs-CRP及TIMP-2对预后不良预测价值的ROC曲线
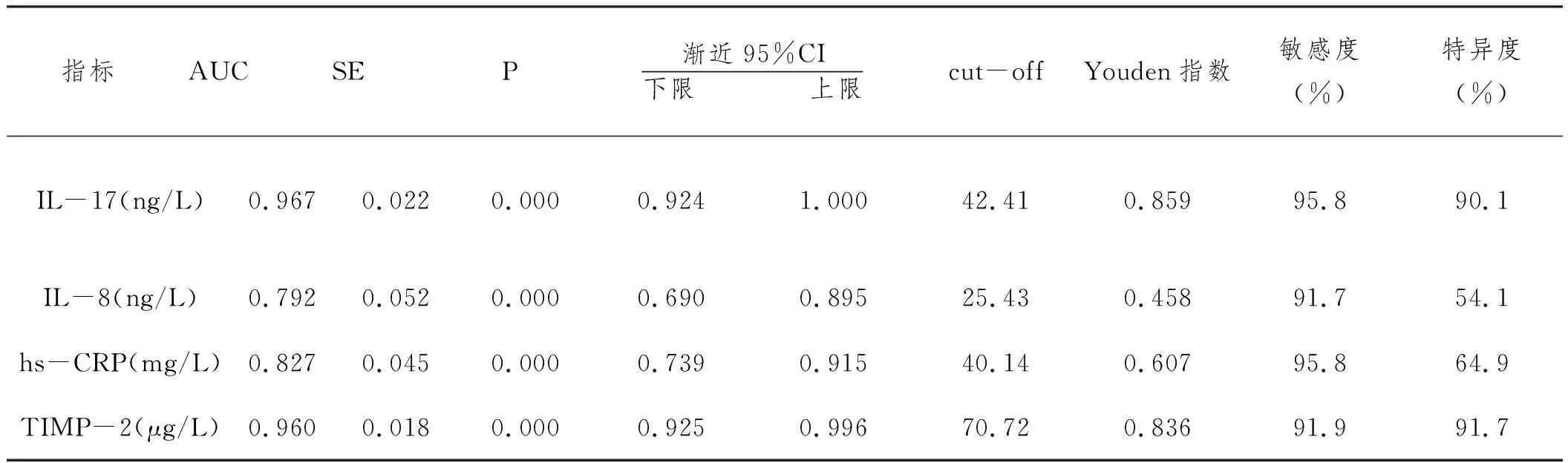
表3 血清IL-17 IL-8 hs-CRP及TIMP-2对预后不良预测价值的ROC曲线分析
3 讨 论
腹股沟疝在临床较为常见,通常需要外科手术治疗才能治愈。随着近些年医疗技术的发展,腹股沟疝的手术方法已由张力性修补术逐渐转变为无张力修补术,并且相比而言,其更符合患者生理解剖结构,术中应用的人工合成补片,可加强腹股沟后壁,有效避免局部高压和异物感[5]。既往报道[6]显示,无张力修补术治疗腹股沟疝的并发症发生率和复发率明显低于传统张力性修补术,但仍难以避免并发症和复发的出现。而王萌等[7]报道表示,白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)与C反应蛋白(C-reactive protein,CRP)等炎症因子水平降低者,往往术后并发症发生率也较低,提示腹股沟疝无张力修补术后炎症因子水平与预后有关。因此,本研究将135例患者根据预后情况分为预后不良组和预后良好组,分析血清IL-17、IL-8、hs-CRP与预后的关系。
IL-17为CD4+T细胞分泌的促炎因子,可诱导多种细胞合成分泌IL-6、IL-8等炎症因子,参与炎症反应[8]。IL-8为单核-巨噬细胞产生的趋化因子,其可吸引和激活中性粒细胞,释放一系列促炎症因子,引发局部炎症反应,达到杀菌作用。hs-CRP为急性时相反应蛋白,当机体出现创伤或感染时,分泌量迅速升高,可有效反映机体炎症程度。本研究中,预后不良组血清IL-17、IL-8、hs-CRP水平显著高于预后良好组,且与预后不良呈正相关,提示高水平血清IL-17、IL-8、hs-CRP患者预后不良风险更大。原因可能为:腹股沟疝无张力修补术后,因手术创伤和应激,机体会出现全身炎症反应,而术后24h炎症症状激烈,提示患者或许存在手术应激性强,手术创伤较大及早期感染等状况,从而导致预后不良[9]。有研究[10]指出,腹股沟疝的发生与胶原代谢紊乱密切相关,而基质金属蛋白酶(Matrix metalloproteinase,MMPs)和金属蛋白酶组织抑制因子(Tissue inhibitor of metalloproteinases,TIMPs)为调节胶原代谢的主要物质。TIMP-2是MMPs的特异性抑制剂,在胶原蛋白代谢中起着至关重要的作用[11]。本研究中预后不良组TIMP-2水平显著低于预后良好组,且与预后不良呈负相关。其原因可能为:TIMP-2作为基质金属蛋白酶-2(Matrix metalloproteinase-2,MMP-2)的抑制剂,可有效抑制MMP-2穿透基质较为突出处,而研究中不良预后组TIMP-2降低,对MMP-2的抑制作用减弱,MMP-2穿透细胞基底膜,从而导致胶原蛋白分解增加,机体腱膜组织强度下降,进而增加术后复发风险。研究中进一步采用ROC曲线分析腹股沟疝无张力修补术后血清IL-17、IL-8、hs-CRP对预后不良的预测价值发现,IL-17、IL-8、hs-CRP、TIMP-2对预后不良预测价值的AUC分别为0.967、0.792、0.827、0.960,且IL-17、TIMP-2的AUC显著较IL-8、hs-CRP高,根据最佳临界值,IL-17、IL-8、hs-CRP、TIMP-2的敏感度分别为95.8%、91.7%、95.8%、91.9%,特异度为90.1%、54.1%、64.9%、91.7%。提示临床可根据术后24h IL-17、IL-8、hs-CRP、TIMP-2水平辅助判断预后,以便尽早进行预防措施,改善预后。
综上所述,腹股沟疝无张力修补术后血清IL-17、IL-8、hs-CRP与预后不良呈正相关,TIMP-2水平与预后不良呈负相关,且均对预后不良有一定预测价值,其中IL-17、TIMP-2预测价值较高。本研究中仍有一定限制性,例如IL-17、IL-8、hs-CRP均为术后24h水平,而术后这些指标并非处于同一水平,可能术后6h、12h、36h、48h等对不良预后的评估价值更高,此外本次研究中心单一,可能会对研究结果造成一定影响。

