SNHG15-lncRNA ceRNA网络靶向miR-451a促进胶质瘤增殖
吴伟川, 门东海, 刘磊峰, 梁兴波, 陈银慧, 李承燕
(广东医科大学附属医院, 广东 湛江 524000)
胶质瘤作为神经系统最常见的脑肿瘤,患有此病的患者预后极差,尽管近几年治疗手段不断提升,但5年的整体生存率仍不理想[1]。现阶段胶质瘤的发病机制已证实与原癌基因的异常激活和抑癌基因的失活相关,但具体机制还有待进一步阐明。非编码RNA(ncRNA)特别是长链非编码RNA (long non-coding RNA,lncRNA)lncRNA已证实在胶质瘤发病机制中起重要作用[2,3]。近年来研究指出小核仁RNA宿主基因15(Small nucleolar RNA host gene 15,SNHG15)在多种恶性肿瘤中表达异常,可能在胶质瘤发生发展过程中有重要作用,但具体机制仍未阐明[4]。本研究探讨SNHG15- miR-451a调控网络参与胶质瘤发生发展的作用机制。
1 材料与方法
1.1材料:人脑神经胶质细胞系HEB(永生细胞)和神经胶质瘤细胞系(U87、U251和Hs683)购自上海酶联生物科技有限公司。增殖细胞核抗原(PNCA,1∶100稀释使用)购自美国Invitrogen公司及BCA蛋白浓度测定试剂盒购自中国beyotime公司。Lipofectamine 3000试剂盒购自美Thermo公司,DeadEndTM 荧光测定TUNEL系统购自Promega公司,TRIZOL购自美国Invitrogen公司及PrimeScriptTMRT reagent Kit购自中国Takara公司。0.25%胰酶Trypsin-EDTA、四氮唑蓝(MTT)、EDTA、PS(青霉素+链霉素)、DMEM、二氯乙酸钠(DAC)及二甲基亚矾(DMSO)等均购自美国Invitrogen公司;胎牛血清购自Gibco公司。全自动酶标仪(BIO-RAD550)、Real-time PCR仪及荧光显微镜购自美国BIO-RAD公司。
1.2方 法
1.2.1研究样本采集:本研究选用的临床组织标本收集于广东医科大学附属医院20例胶质瘤患者(男12例,平均年龄52.2±7.5岁;女8例,平均年龄47.4±6.8岁)。在知情同意的情况,经手术切除肿瘤标本及癌旁组织(大于3cm),研究涉及所有组织样本均得到了本院伦理委员会批准。
1.2.2细胞培养和转染:细胞实验选用U87细胞进行研究。转染前24h,将U87细胞按5×105个/孔接种到6孔板,使用转染试剂LipofectamineTM 2000 试剂分别将 SNHG15 小干扰 RNA(siRNA)、阴性对照序列(NC)、miR-141 抑制剂(miR-141 inhibitor)对U87细胞进行转染。细胞随机分为转染阴性对照序列(siNC)组、转染 SNHG15 siRNA (siSNHG15)组、转染SNHG15 siRNA和 miR-141 inhibitor(siSNHG15+miR-451a inhibtor)组。转染48 h,收集细胞用于后续研究。
1.2.3RNA 提取及实时定量聚合酶链式反应:使用Trizol从细胞系或组织中提取总RNA,紫外分光光度法测定RNA的含量,琼脂糖凝胶电泳检测其完整性。采用逆转录试剂盒将提取的总RNA合成cDNA,根据qRT-PCR试剂盒制造商指示,进行实验。SNHG15:正向引物 5'-CAACCATAGCGGTGCAACTGTGC-3',反 向 引 物 3'-GGCTGAACCAAGTTGCAAGTCATG-5'。SNHG15内参GAPDH :正向引物 5'-CAGTGCCAGCCTCGTCTA T-3',反向引物:3'-AGGGGCCATCCACAGTCTTC- 5'。miR-451a的正向引物序列为5'-GGTGGTGAATACCCTCCTG-3';反向引物序列为5'-GTCTGTCCGTGGTGCTGA-3'。miR-451a 内参 U6 :正向引物 5'-CTCGCTTCGGCAGCACATATACT-3',反向引物3'-ACGCTTCACGAATTTGCGTGTC-5'。实验结果以2-△△CT值形式得到。每组设置 5 个复孔,实验重复3次。
1.2.4双荧光素酶报告基因实验:构建SNHG15的的野生型和突变质粒。分别提取SNHG15-WT和SNHG15-Mut的质粒,与miR-451a inhibtor共同转染U87细胞。然后上机检测荧光素酶的活性。
1.2.5Transwell侵袭实验:转染后,收集各组细胞,Matrigel凝胶于4℃条件下过夜,次日Matrigel 胶对 Transwell 小室进行预包被,将细胞调整为1×106个/mL。在上室加入100μL 细胞悬液;在下室加入600μL 含10%胎牛血清的培养基;随后恒温培养箱培养24h。将小室置于95%乙醇中固定 5 min;在0.5%结晶紫染色液中染色10min后,用棉签轻拭去小室滤膜上层的细胞,在显微镜下观察滤膜下层细胞。
1.2.6细胞划痕实验:收集每组转染的细胞并再次在恒温培养箱中培养。当细胞融合率达到约90%时,使用垂直于6孔板底部的200μL移液管吸头进行水平划线。24h后使用光学显微镜进行观察,使用Image J软件测量划痕的宽度。
1.2.7Tunel实验:在4%多聚甲醛中固定各组U87细胞30~60 min,在0.3% H2O2中孵育(37℃,20 min),PBS洗涤3次。加50μL生物素标记液孵育(37℃,60 min)。用PBS洗涤1次,滴加0.1-0.3mL标记反应终止液,37℃孵育10min,加50μL Streptavidin-HRP工作液,37℃,30 min,滴加0.2-0.5mL DAB显色液,用苏木素染色液进行细胞核染色。用95%乙醇脱水5 min,随后100%乙醇脱水2次(3 min/次),最后甲苯透明 2次(5 min/次),显微镜下观察切片。
1.2.8体内增殖细胞核抗原:选取BALB/c裸鼠20只,所有裸鼠随机分为siNC组、 siSNHG15组、NC inhibtor组、miR-451a inhibtor组和siSNHG15+miR-451a inhibtor组及对照组,每组4只。转染U87细胞,然后配置成浓度约为1×107个/mL单细胞悬液并按0.2mL/只接种到对应小鼠左前上肢腋部皮下。21d后处死5组小鼠,剥离瘤体称重,选取组织切片进行免疫组化实验。

2 结 果
2.1检测临床组织标本和细胞系中SNHG15和miR-451a的表达量:通过LncExpDB和GeneCards数据库发现SNHG15定位于染色体7p13上,且在多种疾病和肿瘤中呈现表达差异,包括胶质瘤(图1.A)。采用qRT-PCR检测SNHG15在胶质瘤组织中的表达情况发现,SNHG15在胶质瘤组织中(2.85±0.43)表达高于癌旁组织(1.12±0.31),差异具有统计学意义(P<0.05);同时SNHG15表达量在胶质瘤细胞系(U87、U251、Hs683)(3.14±0.36,2.24±0.21,1.85±0.19)中均高于HEB细胞(1.08±0.11),差异具有统计学意义(P<0.05)(图1.B)。通过TargetScan数据库,找到miR-451a相关信息和茎环结构(图1.C)。miR-451a在胶质瘤组织中(0.45±0.14)表达低于癌旁组织(0.98±0.22),差异具有统计学意义(P<0.05);而miR-451a表达量在胶质瘤细胞系(U87、U251、Hs683)(0.41±0.09;0.55±0.11;0.72±0.13)中均低于HEB细胞(1.05±0.19),差异具有统计学意义(P<0.05)(图1.D)。

图1 检测临床组织样本和细胞系中SNHG15和miR-451a的表达量(A,C)SNHG15和miR-451a基本生物信息。(B)SNHG15在临床组织样本及细胞系中表达水平。(D)miR-451a在临床组织样本及细胞系中表达水平。(**,表示P<0.05)
2.2ceRNA调控机制:通过ENCORI和LncRNABase数据库发现,发现miR-451a与SNHG15存在结合位点(图2.A)。然后将SNHG15或miR-451a inhibitor质粒转染进U87细胞后,验证转染成功(图2.B)。在U87细胞中,双荧光素酶报告基因结果显示转染miR-451a inhibitor后SNHG15荧光素酶活性增加,差异具有统计学意义(P<0.05);而对SNHG15的突变型质粒连接的荧光素酶活性无影响,差异无统计学意义(P>0.05)(图2.C)。采用Pull down生物素化实验结果发现,miR-451a降低U87细胞中SNHG15的表达水平,差异有统计学意义(P<0.05)(图2.D);而U87细胞中转染SNHG15质粒后miR-451a水平表达降低,差异有统计学意义(P<0.05)(图2.E)。这些结果提示SNHG15作为ceRNA,与miR-451a之间存在负调控关系并竞争性结合。
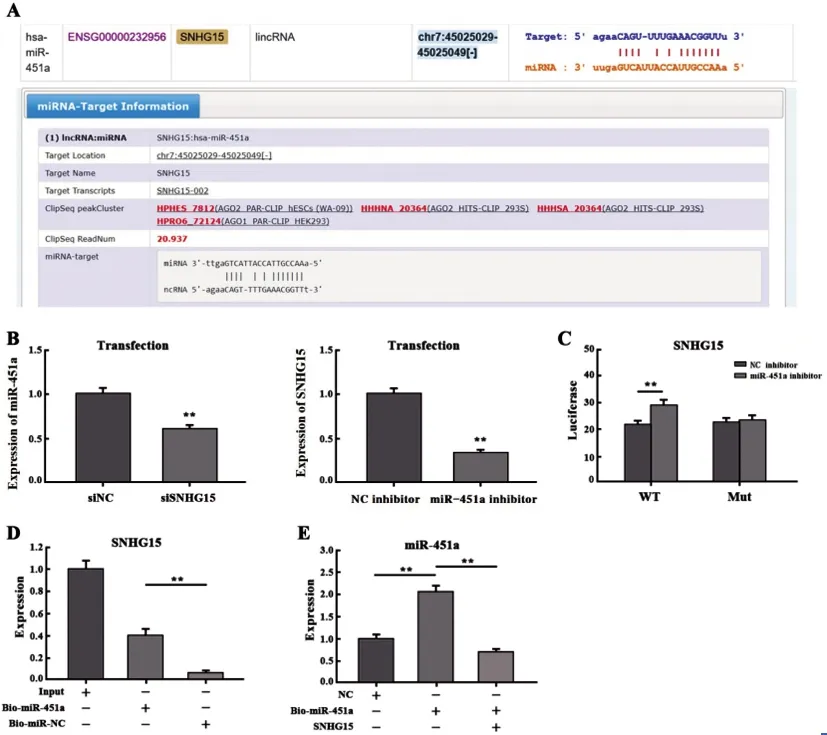
图2 ceRNA调控机制(A)数据库预测miR-451a与SNHG15存在结合位点。(B)检测敲低SNHG15和miR-451a inhibitor转染成功。(C)双荧光素酶报告基因实验检测SNHG15荧光素酶活性。(D,E)Pull down和qRT-PCR检测SNHG15和miR-451a调控机制。(**,表示P<0.05)
2.3U87细胞生物学功能调控情况:通过Tranwell细胞侵袭、细胞划痕及Tunel细胞凋亡实验(图3),发现抑制SNHG15表达后U87细胞侵袭和迁移距离及细胞凋亡率降低;而转染miR-451a inhibitor后U87细胞的侵袭和迁移距离及细胞凋亡率均增加。
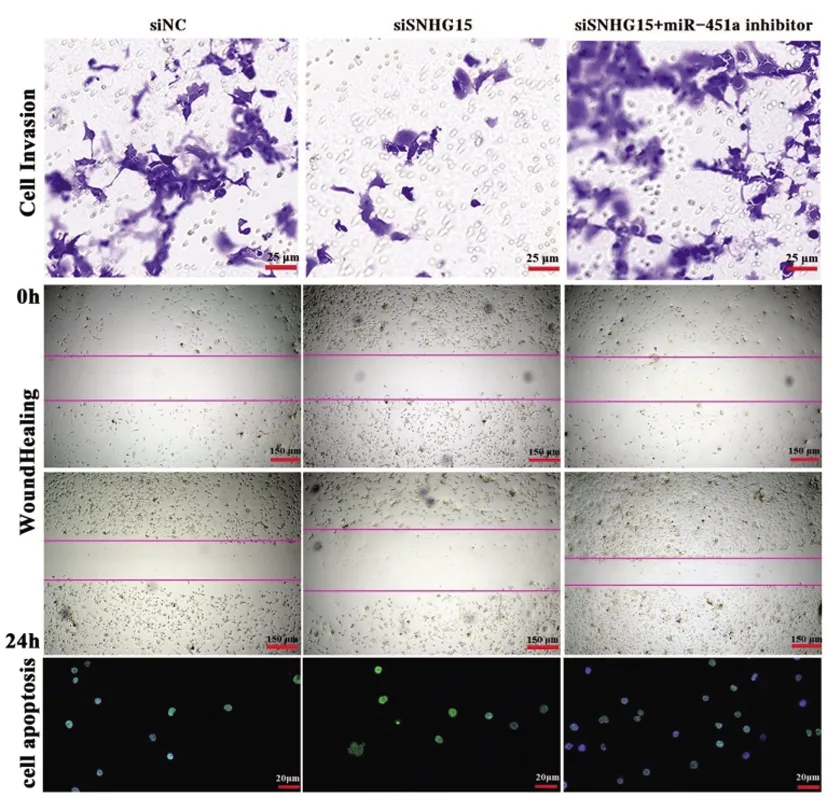
图3 U87细胞生物学功能调控情况Tranwell侵袭实验,Scale bar=25 μm,×400倍镜;细胞划痕实验,Scale bar=150 μm,×100倍镜;Tunel细胞凋亡实验。Scale bar=20 μm,×500倍镜。
2.4皮下肿瘤生长及体内细胞增殖情况:构建胶质瘤裸鼠皮下移植瘤模型,对皮下肿瘤生长情况进行检测。结果显示SNHG15组移植瘤重量较NC组增加,差异具有统计学意义(P<0.05)(图4.A),而miR-451a组移植瘤重量较miR-NC组降低,差异具有统计学意义(P<0.05)(图4.B)。采用多组增殖细胞核抗原PCNA实验发现,siSNHG15组PCNA表达低于siNC组及siSNHG15+miR451a inhibitor组,而转染miR-451a inhibitor则降低siSNHG15的抑制PCNA表达作用(图4.C);miR-451a inhibitor组PCNA表达高于NC inhibitor组及siSNHG15+miR451a inhibitor组,而共转染siSNHG15及miR-451a inhibitor后,抑制了 miR-451a促进PCNA表达作用(图4.D)。
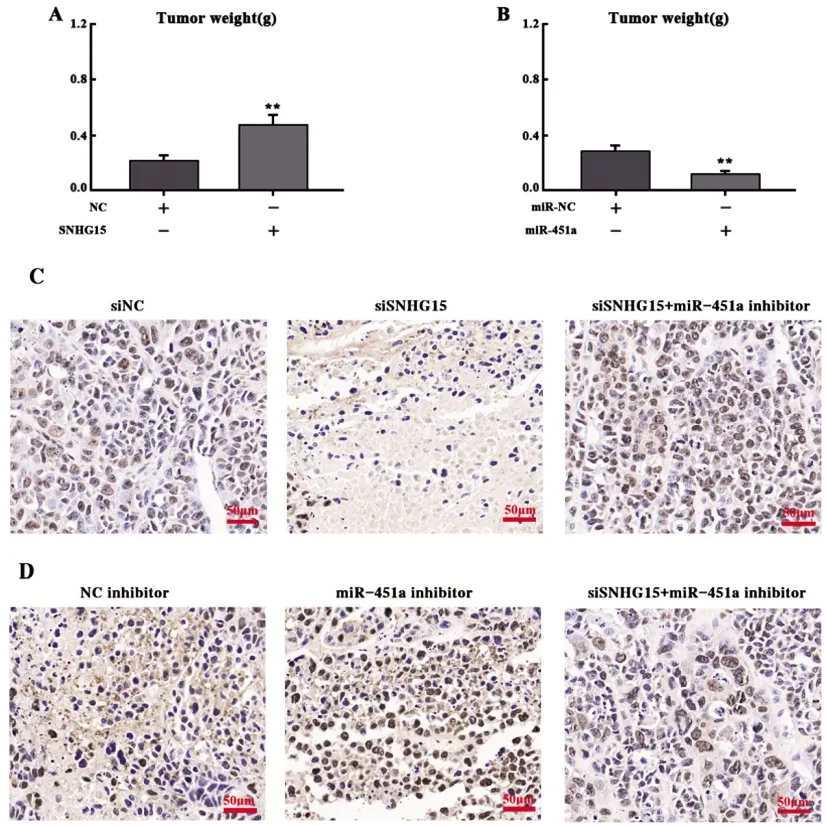
图4 皮下肿瘤生长及体内细胞增殖情况(A,B)各组皮下移植瘤重量比较。(C,D)增殖细胞核抗原PCNA实验检测细胞增殖情况,Scale bar=50μm,×200倍镜。(**,表示P<0.05)
3 讨 论
近年来,有关lncRNA在胶质瘤中的研究越来越多,SNHG15在lncRNA家族中也占据重要位置,已证实与多种癌症发病机制相关[5]。Li等研究显示LncRNA-SNHG15通过抑制miR-338-3p促进结直肠癌细胞增殖[6];Dong等研究显示长链非编码RNA SNHG15可影响非小细胞肺癌预后不良,促进细胞增殖和侵袭[7];但关于SNHG15与胶质瘤相关报道甚少,具体调控机制更加不清楚,本研究就此开展深入研究。
Li的研究团队曾通过公共数据库发现,SNHG15在胶质母细胞瘤(GBM)细胞中上调,并与GBM患者的不良预后相关[8]。与以往研究结果类似,本研究中,通过LncExpDB和GeneCards数据库发现SNHG15定位于染色体7p13上,且在多种疾病和肿瘤中呈现表达差异,包括胶质瘤。本研究检测发现SNHG15在20例胶质瘤患者组织样本和细胞系中均呈高表达,同时还能促进皮下肿瘤生长。这些结果说明,SNHG15在胶质瘤组织中表达上调,同时以何种调控机制参与了胶质瘤的发生发展。
肿瘤恶性生物学行为,是影响肿瘤患者预后的关键因素,为了进一步了解SNHG15在胶质瘤中的工作机制,研究SNHG15对胶质瘤细胞恶性生物学行为的影响。本研究发现敲低SNHG15能有效的抑制U87细胞侵袭和迁移,促进凋亡,且抑制体内细胞增殖。这些发现说明敲低SNHG15可能对抗胶质瘤产生一定调控作用。
关于lncRNA调控机制,lncRNA可以根据碱基互补配对的原理与DNA和RNA相互作用,研究显示胶质瘤lncRNA被证实可通过ceRNA机制调控miRNA的表达,进而调控胶质瘤的发生发展[9,10]。因此为了进一步探究SNHG15在胶质瘤中的作用,本研究通过软件预测发现miR-451a、SNHG15可能存在配对区域,随后检测发现miR-451a在胶质瘤组织以及细胞中均表达明显降低并抑制皮下肿瘤生长。然后验证了SNHG15与miR-451a之间的靶向关系、竞争性结合及负调控关系。体内外细胞实验发现敲低SNHG15显著减少了U87细胞侵袭、迁移距离、体内增殖及促进凋亡率增加。而miR-451a抑制物则能抵消敲低SNHG15的调控效果,且相对拉回了敲低SNHG15对胶质瘤细胞的生物学功能调控的能力。这些结果提示SNHG15可能是通过竞争性结合miR-451a参与胶质瘤细胞侵袭、迁移、凋亡及体内增殖的调控机制。
综上所述,本研究发现SNHG15通过ceRNA机制调控miR-451a的表达,作为胶质瘤诊断和治疗潜在靶点的价值提供数据支撑和理论依据。

