骨髓间充质干细胞外泌体miR-25-3p调控骨肉瘤细胞增殖迁移及侵袭能力的功能与机制研究
刘汉涛, 赵良虎, 秦宏敏
(攀枝花学院附属医院骨科, 四川 攀枝花 617099)
骨肉瘤是一类常发病于青少年或儿童膝关节周围的原发性恶性肿瘤[1],具有高侵袭性和高转移性。据统计,世界范围内骨肉瘤的发病率正在逐渐增加。目前骨肉瘤的主要治疗方法有化疗和手术切除,但是治疗效果并不十分理想,仍然存在严重的远端转移以及肿瘤复发,所以需要探究更多的骨肉瘤的发展机制[2]。骨髓间充质干细胞(Bone Marrow Mesenchymal Stem Cells,BMSC)是一类多能干细胞,存在于骨髓基质中,可分化为成骨细胞以及脂肪细胞,可转移至肿瘤组织而调控肿瘤进程[3]。间充质干细胞外泌体是一类由间充质干细胞分泌的纳米级囊泡,可携带间充质干细胞的遗传信息,如miRNA、lncRNA、脂质等[4],研究表明BMSC exo可促进多种肿瘤的进程,例如,缺氧条件下BMSC exo miRNA通过STAT3诱导的EMT而促进肺癌的转移[5]。MiRNA-25-3p已经被报道可调控多种肿瘤的病理进程,例如,外泌体MiR-25-3p可诱导肿瘤血管形成以及肿瘤转移前肿瘤微环境的形成,亦可促进乳腺癌的生长和转移[6]。然而BMSC exo中miR-25-3p是否对骨肉瘤的发生发展产生影响及机制尚无报道,本研究旨在阐明BMSC exo中miR-25-3p对骨肉瘤生长和转移的作用,并深入探讨其作用机制。
1 材料与方法
1.1材料:骨髓间充质干细胞(Bone Marrow Mesenchymal Stem Cells,BMSC)(购自广州赛业生物科技有限公司),骨肉瘤细胞MG-63(购自中科院上海细胞库),Lipofectamine 2000 转染试剂(购自美国Thermo Fisher Scientific公司),miRNA逆转录试剂盒和qRT-PCR试剂盒(购自美国Thermo Fisher Scientific公司),Trizol试剂盒(购自上海联迈生物工程有限公司),CD29-APC、CD90-FITC、CD45-PE、PTEN、GAPDH、CD9、CD63、TSG101抗体(购自美国Cell Signaling Technology公司),CCK8试剂盒(购自英国Abcam公司),RIPA试剂盒(购自沈阳万类生物技术有限公司)。
1.2细胞培养:BMSC培养于含10%FBS、10ng/mL bFGF、20μg/mL Vitamin C的DMEM/F12培养基中,MG-63培养于含10%FBS的DMEM培养基中,细胞培养于5% CO2、37℃的细胞培养箱中,隔天更换培养基,培养至细胞汇合率80%时进行细胞传代。
1.3细胞分组与转染:BMSC分为miR-NC组和miR-25-3p组(转染miR-25-3p mimic Negative Control和miR-25-3p mimic)。提取miR-NC组和miR-25-3p组BMSC分泌的外泌体记为miR-NC exo和miR-25-3p exo。MG-63分为miR-NC组和miR-25-3p组(转染miR-25-3p mimic Negative Control和miR-25-3p mimic),PBS组和BMSC exo组(MG-63与PBS以及10μg/mL的BMSC exo共孵育48h),miR-NC exo组、miR-25-3p exo组(分别与10μg/mL的miR-NC exo和miR-25-3p exo共孵育48h)以及miR-25-3p exo+PTEN组(与10μg/mL miR-25-3p exo共孵育48h后转染PTEN质粒)。按照上述分组使用Lipofectamine 2000 转染试剂进行转染,qRT-PCR鉴定转染效果。
1.4外泌体的提取与鉴定:将各组BMSC培养基更换为含10%无外泌体FBS的培养基,培养48h后取上清,使用差速离心法提取外泌体,300g离心10min,取上清,2000g离心10min,取上清,10000g离心70min,取上清,100000g离心70min,收集沉淀,PBS重悬后继续100000g离心70min以清洗外泌体,收集沉淀后用100μL无菌PBS重悬。透射电镜观察外泌体的结构,Western blot鉴定外泌体标志蛋白CD9、CD63、TSG101。
1.5qRT-PCR:Trizol试剂盒提取各组细胞的总RNA,使用核酸定量仪进行核酸定量,根据逆转录试剂盒取1μg的RNA逆转录为cDNA,根据qRT-PCR试剂盒进行PCR扩增反应,反应条件为:95℃预变性30s,95℃ 5s,60℃ 30s,共40个循环,数据处理采用 2-ΔΔCt法,计算miR-520a-3p 表达的水平。引物序列如下:
miR-25-3p-F:5’-CATTGCACTTGTCTCGGTCTGA-3’
miR-25-3p-R:5’-GCTGTCAACGATACGCTACGTAACG-3’
U6-F:5’ -CTCGCTTCGGCAGCACA-3’
U6-R:5’-AACGCTTCACGAATTTGCGT-3’
1.6CCK8法检测细胞增殖:将转染后以及与外泌体共孵育后的MG-63细胞接种至96孔板中,每孔5000个细胞,每孔100μL,分别于培养0、24、48、72h,取出对应的96孔板,每孔加入10μL的CCK8溶液,混合均匀后使用酶标仪在450nm处检测各组细胞吸光度(OD)值。
1.7Transwell小室法检测细胞迁移和侵袭:取转染或与外泌体孵育后的MG-63细胞用DMEM空白培养基稀释后接种于Transwell小室中(或铺Matrigel胶的Transwell小室),每孔接种1×104个细胞,小室放置于24孔板中,24孔板每孔加入含10%FBS的DMEM 600μL,然后继续培养72h后,小室用PBS清洗后用无水甲醛固定30min,底部滴加结晶紫溶液染色10min,清洗后于显微镜下观察拍照。
1.8双荧光素酶报告基因实验:TargetScan数据库预测PTEN与miR-25-3p结合位点,将PTEN野生型(pGL3-PTEN WT组)、突变型质粒(pGL3-PTEN MUT组)以及空白质粒(pGL3-control组),使用Lipofectamine 2000将上述质粒转染至293T,用Lipofectamine 2000 转染试剂将miR-25-3p mimic和miR-NC转染至上述293T细胞,使用双荧光素酶报告基因检测试剂盒检测荧光强度。
1.9Western blot:取各组6孔板中培养的MG-63,加入200μL RIPA,裂解30min,12000×rpm,离心15min,取上清液为细胞总蛋白,取10μg蛋白,SDS-PAGE凝胶电泳分离蛋白,然后转膜,封闭2h,PVDF膜与PTEN、CD9、CD63、TSG101、GAPDH抗体4℃过夜孵育,TBST洗膜后,二抗室温孵育1.5h,洗膜后用ECL试剂盒显影,拍照,用Image J软件对曝光结果进行定量分析。
1.10统计学分析:采用SPSS22.0软件进行统计分析。所有数据以均值±标准差表示,多组间差异使用单因素方差分析(one-way ANOVA),两组间比较采用LSD-t检验法。P<0.05为差异具有统计学意义
2 结 果
2.1外泌体鉴定结果:本文所提取的BMSC exo粒径在100nm左右,具有双层膜结构,形态呈“杯托”样,并且表达外泌体标志蛋白CD9、CD63、TSG101,符合外泌体的结构及生物学特征(图1)。
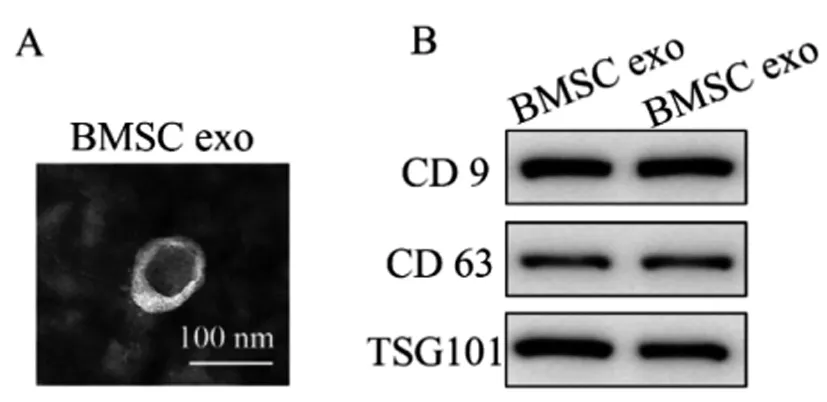
图1 透射电镜(A)和Western blot(B)鉴定外泌体结果
2.2miR-25-3p促进骨肉瘤细胞增殖、迁移和侵袭:相比于miR-NC组,miR-25-3p mimic组MG-63细胞OD值在24h、48h、72h均显著增加(P<0.05),细胞迁移和细胞侵袭数目亦显著增加(P<0.001),说明miR-25-3p显著促进骨肉瘤细胞的增殖、迁移和侵袭能力(图2)。
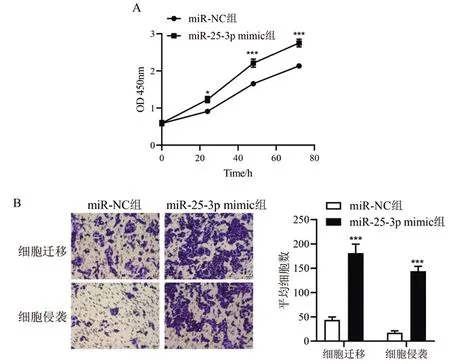
图2 miR-25-3p对骨肉瘤细胞的增殖、迁移和侵袭能力的影响A:CCK8法检测细胞增殖能力;B:Transwell小室法检测细胞迁移和侵袭能力(×20倍)相比于miR-NC组,*P<0.05,**P<0.01,***P<0.001
2.3间充质干细胞外泌体促进骨肉瘤细胞增殖、迁移和侵袭:相比于PBS组,BMSC exo组MG-63细胞OD值均显著增加(P<0.05),MG-63细胞迁移数和细胞侵袭数亦显著增加(P<0.001),说明BMSC exo可显著促进骨肉瘤细胞的增殖、迁移和侵袭能力(图3)。
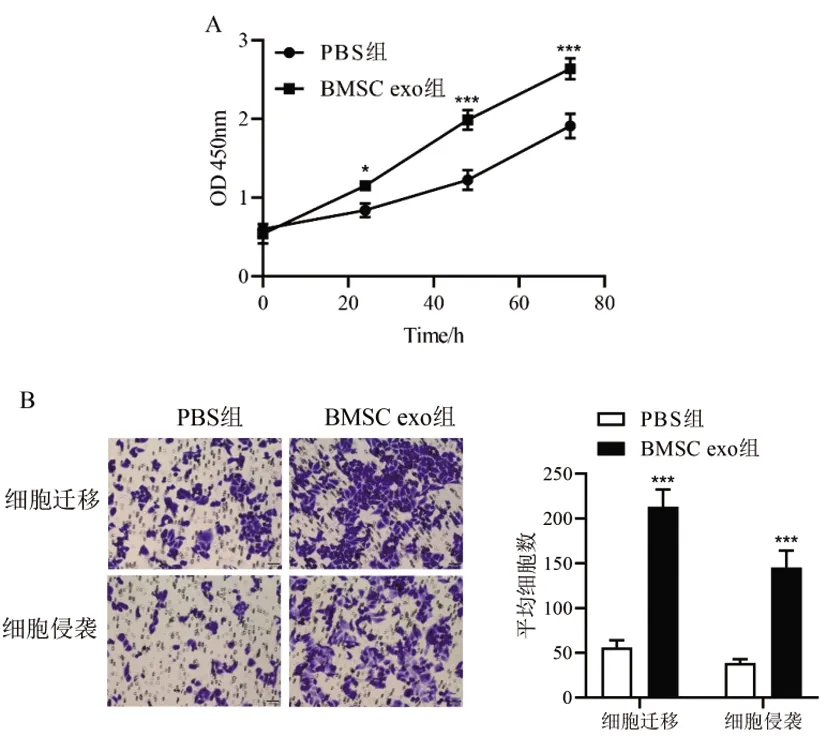
图3 间充质干细胞外泌体对骨肉瘤细胞增殖、迁移和侵袭能力的影响A:CCK8法检测细胞增殖能力;B:Transwell小室法检测细胞迁移和侵袭能力(×20倍)相比于PBS组,*P<0.05,**P<0.01,***P<0.001
2.4间充质干细胞外泌体转移miR-25-3p至骨肉瘤细胞:相比于PBS组,BMSC exo组MG-63细胞miR-25-3p表达显著上调(P<0.001)(图4A),miR-25-3p exo中miR-25-3p表达显著高于miR-NC exo(P<0.001)(图4B),而miR-25-3p exo组MG-63细胞中miR-25-3p表达显著高于miR-NC exo组(P<0.001)(图4C),说明间充质干细胞外泌体可转移miR-25-3p至骨肉瘤细胞。
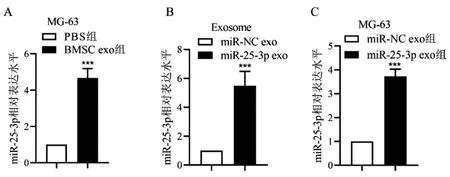
图4 间充质干细胞外泌体转移miR-25-3p至骨肉瘤细胞A,C:qRT-PCR检测细胞中miR-25-3p表达;B:qRT-PCR检测外泌体中miR-25-3p表达 相比于PBS组/miR-NC exo/ miR-NC exo组,*P<0.05,**P<0.01,***P<0.001
2.5PTEN为miR-25-3p靶基因:TargetScan数据库预测PTEN和miR-25-3p结合位点如图5A所示,双荧光素酶报告基因检测结果显示,PTEN-WT组细胞转染miR-25-3p mimic后,相对荧光强度显著低于miR-NC组(P<0.001),而PTEN-MUT组细胞转染miR-25-3p mimic和miR-NC后细胞相对荧光强度无显著差异,证明PTEN为miR-25-3p靶基因(图5B)。miR-25-3p mimic组MG-63细胞PTEN表达水平显著低于miR-NC组(P<0.001)(图5C),miR-25-3p exo组MG-63细胞PTEN表达水平显著低于miR-NC exo组(P<0.001)(图5D),说明外泌体miR-25-3p可显著抑制PTEN表达。
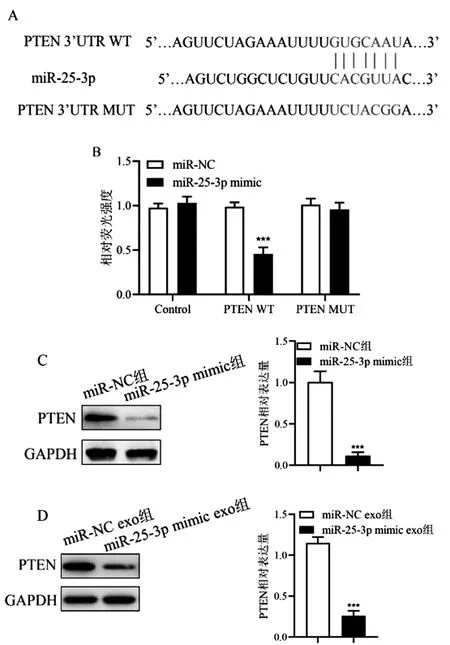
图5 miR-25-3p对PTEN表达的调控A:数据库预测miR-25-3p与PTEN结合位点;B:双荧光素酶报告基因实验检测miR-25-3p与PTEN结合位点;C,D:Western blot检测各组细胞PTEN蛋白表达相比于miR-NC组或miR-NC exo组,*P<0.05,**P<0.01,***P<0.001
2.6外泌体miR-25-3p靶向PTEN促进骨肉瘤的增殖、迁移和侵袭:相比于miR-NC exo组,miR-25-3p exo组MG-63细胞24h、48h、72h MG-63细胞OD值显著增加(P<0.05),细胞迁移和侵袭数显著增加(P<0.001),说明BMSC exo能够显著促进骨肉瘤细胞的增殖、迁移和侵袭能力。而miR-25-3p exo+PTEN组MG-63细胞OD值、细胞迁移和侵袭数显著低于miR-25-3p exo组(P<0.05),说明外泌体miR-25-3p通过抑制PTEN表达而影响骨肉瘤细胞的增殖、迁移和侵袭能力(图6)。
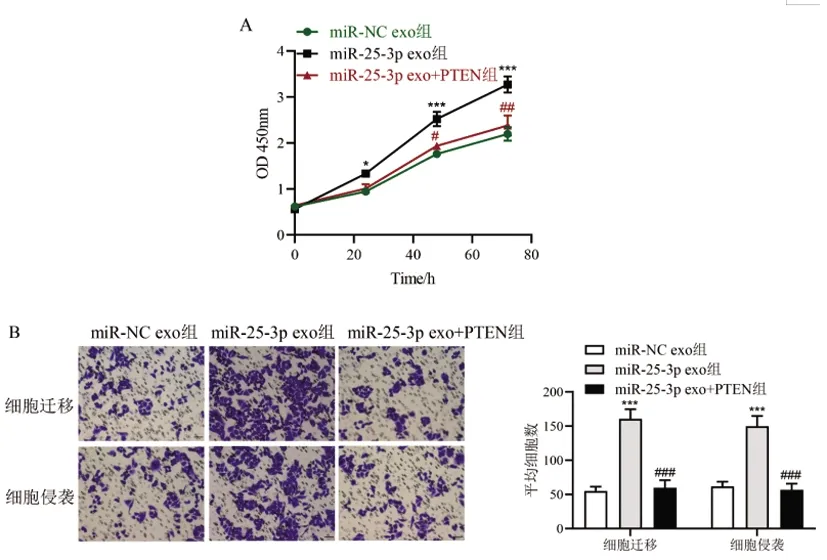
图6 外泌体miR-25-3p对骨肉瘤细胞增殖、迁移和侵袭能力的影响A:CCK8法检测细胞增殖能力;B:Transwell小室法检测细胞迁移和侵袭能力(×20倍)相比于PBS组,*P<0.05,**P<0.01,***P<0.001
3 讨 论
肿瘤的生长和转移受多种机制的调控,包括血管新生、免疫逃逸、侵袭和转移能力等[7]。研究表明[8],肿瘤的生物学功能不仅与肿瘤细胞自身有关,还与肿瘤微环境中的非肿瘤细胞相关,间充质干细胞是重要的非肿瘤细胞之一,间充质干细胞及其分化的基质细胞在肿瘤的发生发展中发挥重要的功能。研究表明[9],实体瘤组织中可分离出BMSC,肿瘤组织中的BMSC与正常组织中的间充质干细胞具有相同的形态、表型以及分化能力,但是其生物学功能亦有显著差异。肿瘤中BMSC可分化为肿瘤相关成纤维细胞,而诱导血管内皮生长因子、转化生长因子-β、白介素-10等细胞因子的分泌而促进肿瘤的生长和转移。研究表明[10],BMSC可通过激活Jagged1/Notch1信号通路而促进前列腺的细胞干性。但是BMSC对骨肉瘤的生长和转移的影响及机制尚无研究。
外泌体是一类由多种活细胞分泌的纳米级囊泡,研究表明,人BMSC外泌体可促进前列腺癌的发生发展[11],亦可通过激活PI3K/AKT信号通路而促进头颈癌的病理进程[12]。本文提取并鉴定了BMSC外泌体,并且发现BMSC exo可促进骨肉瘤细胞的增殖、迁移和侵袭能力,说明BMSC exo可促进骨肉瘤的生长和转移能力。
外泌体内含多种遗传物质包括miRNA、lncRNA、circRNA等,间充质干细胞外泌体可携带间充质干细胞的遗传物质,如miRNA等。间充质干细胞外泌体miRNA有望成为肿瘤治疗的新靶点。MiR-25-3p被报道可调控多种肿瘤的发生发展,例如,外泌体miR-25-3p和miR-92a-3p可促进脂肪肉瘤的进程[13],循环miR-25-3p作为新的骨肉瘤诊断和预后生物标志物[14]。本研究发现,过表达miR-25-3p后骨肉瘤细胞的增殖、迁移和侵袭能力均显著增加,说明miR-25-3p可促进骨肉瘤的生长和转移。
miRNA对靶基因的调控表现在转录后水平上,通过对靶基因mRNA的切割或对其翻译抑制两种机制来下调靶基因的表达,在哺乳动物细胞中,miRNA可结合于靶基因mRNA的3’UTR区域,而抑制靶基因的翻译[15]。双荧光素酶报告基因实验检测发现,PTEN为miR-25-3p的靶基因,MiR-25-3p以及BMSC exo中的miR-25-3p可抑制骨肉瘤细胞中PTEN的表达。本研究发现,外泌体可转移miR-25-3p至骨肉瘤细胞,并且发现BMSC exo miR-25-3p可促进骨肉瘤细胞的增殖、迁移和侵袭能力。而过表达PTEN后外泌体miR-25-3p对骨肉瘤细胞增殖、迁移和侵袭能力的促进作用被显著抑制,说明骨髓间充质干细胞外泌体miR-25-3p可靶向PTEN而促进骨肉瘤的生长和转移,提示外泌体miR-25-3p或可作为骨肉瘤治疗的新靶点。
综上所述,骨髓间充质干细胞外泌体可转移miR-25-3p至骨肉瘤细胞,并抑制其靶基因PTEN的表达而促进肿瘤的生长和转移,但是骨髓间充质干细胞外泌体miR-25-3p是否能作为骨肉瘤治疗的新靶点还需进一步探究。
——外泌体与老年慢性疾病相关性的研究进展

