急性缺血性脑卒中患者发生抑郁的危险因素分析及预测指标探究
王 宁, 和 杰, 郭 娜
(保定市第四中心医院,河北 保定 072350)
急性缺血性脑卒中(AIS,acute ischemic stroke) 是临床最常见卒中类型,也是全球第二并在中国居首的致死性疾病,其发病率、致死率和致残率均处于较高水平[1]。近年来,受生活压力增大、饮食习惯改变和人口老龄化进程加剧等因素影响,急性缺血性脑卒中患病率呈升高趋势[2]。卒中后抑郁(PSD,post-stroke depression)常继发于卒中后1年内,可引发局灶性神经功能缺损症状,并有情绪低落、兴趣缺失、消极悲观和睡眠障碍等临床表现,严重影响急性缺血性脑卒中患者身心健康、生存质量乃至预后转归[3]。PSD起病隐匿,影响因素众多,目前其发病机制仍未完全阐明,现有研究认为可能与神经生物学和社会心理学机制有关[4-5]。在临床实践中卒中发生后通常重视恢复其神经功能,但由于缺乏明确的PSD诊断标准及特征性预测指标,PSD的诊断率偏低,易出现漏诊或误诊[6],进而延误治疗。因此有必要分析PSD的相关危险因素及特征性预测指标,以提高对PSD的早期预测及诊断水平,为临床治疗提供依据。以保定市第四中心医院神经内科2019年1月—2020年6月收治的急性缺血性脑卒中患者为研究对象,收集其临床资料和实验室指标进行对比分析,探讨了PSD发生情况、相关危险因素及预测指标,旨在为临床早期识别PSD和及时治疗提供参考。
1 资料与方法
1.1 一般资料
选取保定市第四中心医院神经内科2019年1月—2020年6月收治的急性缺血性脑卒中患者116例。患者均符合《中国急性缺血性脑卒中诊治指南2018》中诊断标准[7]并开展常规治疗,且有明确AIS临床症状或体征;入院时均意识清楚,入院时间均为发病后2周内;经头颅CT排除脑出血。排除标准:①合并其他神经系统疾病或影响血清尿酸、炎症指标水平的其他疾病;②病情危重、伴失语或存在严重认知障碍者,无法配合调查;③既往或当前伴精神疾病(抑郁症、精神分裂症、癫痫等)者。于发病后6个月采用汉密顿抑郁量表(HAMD,Hamilton depression scale)进行评定,将量表总分≥7分者纳入抑郁组(PSD)(42例),将量表总分<7分者纳入无抑郁组(NPSD,non-post-ischemic stroke depression)(74例)[8]。该研究经医学研究伦理委员会审核同意,入选患者均签署知情同意书。
1.2 研究方法
(1) 收集资料 收集两组患者的一般资料,包括性别、年龄、体质指数(BMI)、血压(收缩压、舒张压)、卒中发生次数、合并慢性病、精神疾病家族史等。
(2) 测定相关实验室指标 患者入院后第2天晨起空腹采集静脉血送至院检测中心,采用全自动生化分析仪检测总胆红素(TBIL,total bilirubin)、总胆固醇(TC,total cholesterol)、甘油三酯(TG,triglyceride)、低密度脂蛋白胆固醇(LDL-C,low density lipoprotein cholesterol)、高密度脂蛋白胆固醇(HDL-C,high density lipoprotein cholesterol)、空腹血糖(FPG,fasting plasma glucose)、糖化血红蛋白(HbA1c,glycosylated hemoglobin A1c)、白细胞计数(WBC,white blood cell count)、中性粒细胞计数(NEU,neutrophil)、超敏C反应蛋白(Hs-CRP,high-sensitivity C-reactive protein)、纤维蛋白原(FIB,fibrinogen)、尿素氮(BUN,blood urea nitrogen)、肌酐(SCr,serum creatinine)、同型半胱氨酸(Hcy,homocysteine)等相关实验室指标。
1.3 统计学方法
2 结果分析
2.1 两组相关指标比较
两组性别、年龄、NIHSS评分、合并冠心病、合并高脂血症、卒中首次发病占比、既往精神疾病家族史占比、TC、Hs-CRP、Hcy差异均有统计学意义(P<0.05),一般资料和实验室指标比较分别见表1和表2。
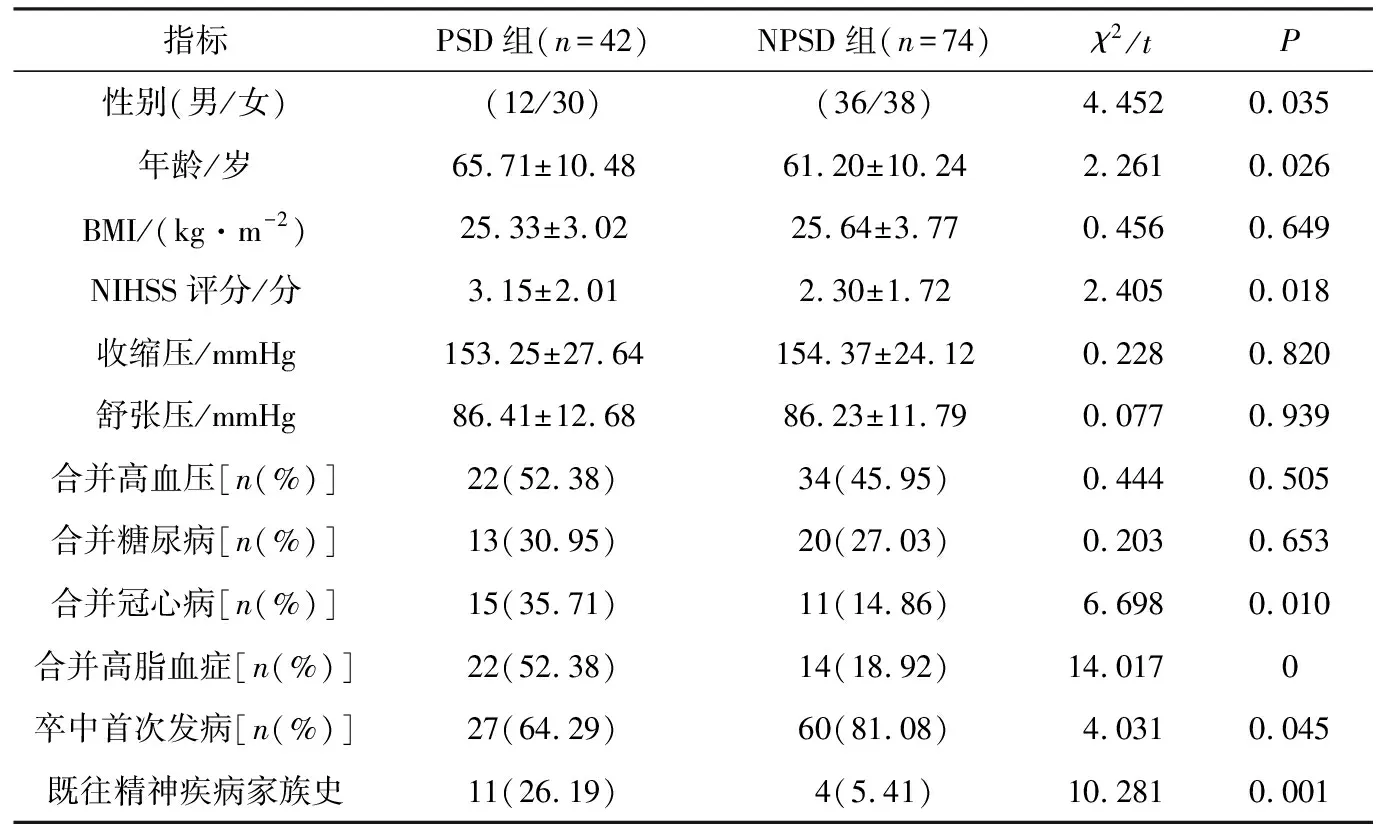
表1 两组相关指标比较
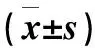
表2 两组实验室指标比较
2.2 PSD发生相关因素的Logistic回归分析
Logistic回归分析结果显示合并冠心病、卒中发生次数、NIHSS评分、Hcy、Hs-CRP为PSD发生的独立危险因素(P<0.05),见表3。
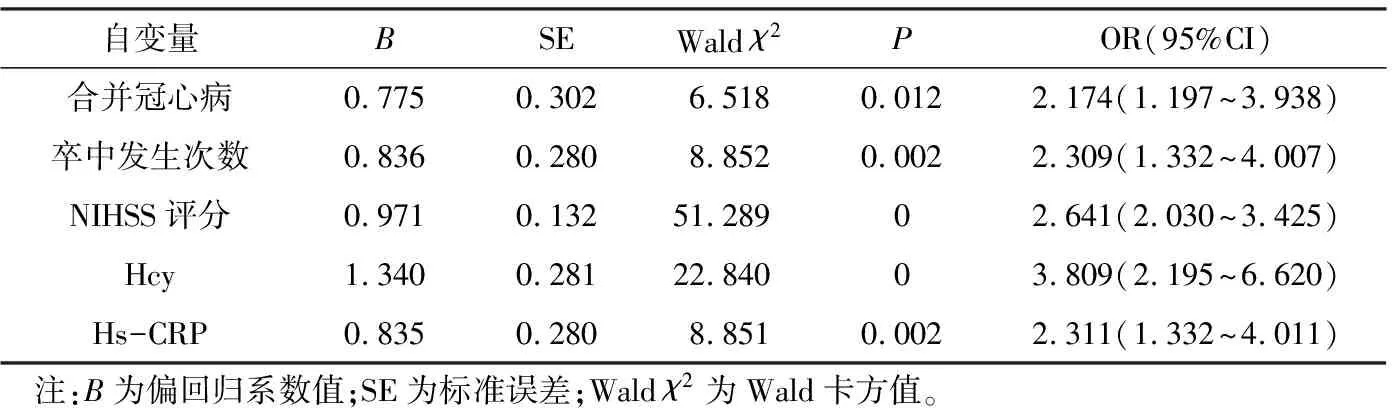
表3 PSD 相关因素的Logistic回归分析
2.3 相关性分析
相关性分析显示HAMD评分与Hcy、Hs-CRP均呈正相关(r取0.541和0.489,P<0.05)。
2.4 ROC曲线分析结果
由ROC曲线分析得知Hcy联合Hs-CRP预测PSD的效能均优于单一指标:ROC曲线下面积(AUC,area under curve)为0.870,并以0.275为截点时约登指数处于最高水平,灵敏度为78.5%,特异度为78.9%,Hcy、Hs-CRP单独预测AUC分别为0.768和0.798。ROC曲线分析结果如图1所示。
3 讨论
PSD属继发性抑郁,是一种在脑血管疾病基础上发生的情感障碍。近年来,随着医疗技术的进一步发展,脑血管疾病的治疗及管理手段日益完善,其发病率及死亡率均呈下降趋势,但仍有部分脑卒中患者遗留永久性残疾需接受康复治疗[9]。PSD会在一定程度上影响卒中后期康复治疗效果,与神经功能缺损和认知功能障碍的产生及加重亦密切相关,因而会对神经功能康复产生负面影响,加大卒中患者死亡风险[10-11]。鉴于此,研究对PSD的发生情况、危险因素及预测指标进行重点探讨,旨在尽早预测PSD并及时干预治疗,以期降低其发病率和死亡风险。
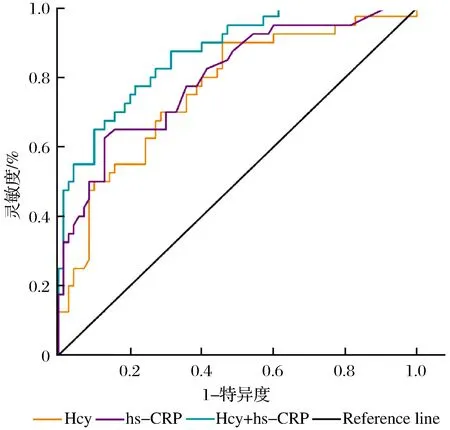
图1 ROC曲线分析结果Fig.1 ROC curve analysis results
有报道指出[12],PSD的平均发病率为30%~35%,卒中后首个5年累积发病率介于39%~52%,卒中后2周PSD发病率浮动在6%~41%,卒中后1~2个月其发病率呈不断上升态势,直至卒中后3~4个月达到顶峰,长期随访多数患者仍存在抑郁症状。研究结果显示缺血性卒中后6个月发生PSD 42例,发生率为36.21%(42/116),与文献[13-14]中的研究结果基本一致。受研究对象、设计方法、评估时间等因素影响,国内外有关PSD的发生率存在差异,但基本波动均在20%~60%[15],这表明PSD是卒中患者较常见并发症之一,其持续时间长,久之可影响预后,增加死亡风险,应予以重视。
研究发现合并冠心病、卒中发生次数(以首次发病为对照)、NIHSS评分是PSD的独立危险因素,这与既往多数研究相一致[4-5,13]。其中急性缺血性脑卒中合并冠心病者抑郁发生风险升高可能与下丘脑-内分泌反射轴紊乱等因素有关[16]。Hcy属含硫氨基酸,研究证实高半胱氨酸水平会加大脑血管疾病发生风险,导致神经递质匮乏,造成情绪低落[17],因此认为其参与了PSD的发病机制。研究发现抑郁症的发生与Hcy等血管危险因子密切相关,其水平升高会增加抑郁症发生风险,因此可作为预测老年PSD发生的重要指标。研究还发现,急性缺血性脑卒中患者Hcy、Hs-CRP水平明显高于NPSD组,且与HAMD评分呈正相关,Logistic回归分析显示Hcy、Hs-CRP为PSD的独立危险因素,该结论与李霞等[18]的研究结果一致。
目前Hcy与PSD的关系及其作用机制仍未完全阐明,Hcy水平升高引发抑郁可能涉及2个方面:(1)Hcy升高后体内叶酸与维生素B12含量下降,抑制神经递质生成诱发内源性抑郁[19];(2)Hcy升高会促进氧化物、自由基生成乃至血管内皮素分泌,进而减少舒张血管因子,引发血管舒缩功能障碍,导致血栓形成,加大心脑血管疾病发生风险[8]。同时还可增加氧化应激反应损伤中枢神经元,诱发神经再生障碍而引发PSD。Hs-CRP水平高低与脑血管疾病发生、发展及预后密切相关,PSD组Hs-CRP明显升高可能与卒中发生后机体释放大量炎症因子,导致神经递质减少等有关。本研究还发现,Hcy、Hs-CRP联合预测PSD的效能优于单一指标,二者水平升高会破坏血脑屏障,大量增加活性氧进而促进神经变性及神经递质分布,二者相互作用共同增加PSD的发生风险在生物学上具有可行性,因此联合监测其指标水平可用于预测PSD发生。
综上所述,急性缺血性脑卒中后抑郁与性别、年龄、神经功能缺损程度、Hcy和Hs-CRP水平密切相关,检测血清Hcy和Hs-CRP水平可预测PSD发生风险。对于存在上述危险因素者应及早识别并给予早期抗抑郁治疗,以改善卒中患者的生活质量及预后。

