他克莫司联合NB-UVB治疗成人AD对血清IL-25、TSLP及其受体水平的影响
于英瑶,夏 莉,王 媛,李可心
(宁夏医科大学总医院,宁夏 银川 750004)
特应性皮炎(AD,atopic dermatitis)是一种临床常见的慢性炎症性皮肤病,该病易反复发作,常伴有剧烈瘙痒,严重影响患者生活质量。据报道AD在儿童中的患病率可达15%~30%,成人患病率则为2%~10%[1]。近年来,针对AD免疫机制的研究揭示该病是炎症反应恶性循环的结果[2]。相关研究认为AD发病与环境因素造成遗传易感性个体皮肤屏障功能障碍以及免疫反应调节失常有关,Th1/Th2细胞因子表达失衡是其主要发病机制[3]。急性期时多表现为Th2细胞反应并介导体液免疫,慢性期时则表现为Th1细胞反应并参与细胞免疫反应。白细胞介素-25(interleukin-25,IL-25)、胸腺基质淋巴细胞生成素(TSLP,thymic stromal lymphopoietin)均属Th2型细胞因子,既往研究证实其能促进Th2型免疫应答[4]。窄谱中波紫外线(NB-UVB,narrow-band ultraviolet B)是治疗AD的有效手段,但作用机制目前仍不明确。他克莫司属外用钙调磷酸酶抑制剂(TCIS,topical calcineurin inhibitors),具有免疫抑制作用,是治疗中重度儿童AD的常用药物[5]。本次研究旨在探讨他克莫司联合NB-UVB治疗成人AD对血清IL-25、TSLP及其受体水平的影响,以观察其疗效,分析其治疗作用机制,为临床治疗成人AD提供参考。
1 资料与方法
1.1 一般资料
选取宁夏医科大学总医院皮肤科门诊2019年1月—2020年6月收治的48例成人AD患者为研究对象,设为AD组,其中男26例,女22例,年龄18~54岁,平均(28.14±9.42)岁,病程1~28年,平均(16.39±8.11)年。纳入标准:(1)年龄≥18岁;(2)符合Williams诊断标准[6]并确诊为AD;(3)近3个月内未接受光疗或外用钙调磷酸酶抑制剂治疗;(4)无心、肝、肾等重要脏器严重疾病;(5)自愿参加研究并签署知情同意书。排除标准:(1)年龄<18岁者;(2)合并严重器质性疾病者;(3)入组前3个月曾接受光疗、糖皮质激素或免疫抑制剂治疗者;(4)对紫外线或他克莫司过敏者;(5)孕妇或哺乳期妇女等特殊人群。选取同期入院健康体检者48例作为对照,设为对照组,体格及实验室检查正常,近期无局部或全身感染性疾病、系统性严重疾病,无个体或家族性遗传过敏史,其中男25例,女23例,年龄18~56岁,平均(27.94±9.81)岁。2组年龄、性别对比无明显差异(P>0.05),有可比性。该研究经院医学伦理委员会审核批准。
1.2 仪器与试剂
IL-25、TSLP试剂盒(美国RD公司)、RNAisoTMPlus提取液(宝生物工程有限公司)、紫外分光光度仪(上海元析仪器有限公司)、SYBR Green荧光定量聚合酶链式反应(PCR,polymerase chain reaction)试剂盒(成都福际生物技术有限公司)、NB-UVB光疗仪(德国 Waldmann 公司,波长310~315 nm,峰值311 nm)。
1.3 治疗方法
AD组患者均接受他克莫司联合NB-UVB治疗:(1)他克莫司使用方法:选择0.1%他克莫司软膏(日本藤泽公司),于确诊为AD处外涂一薄层,每日2次,间隔10~14 h;(2)NB-UVB治疗:以最小红斑量(MED,minimum erythema dose)测试附件测定脐两侧MED,以该参考剂量减少20%为初始照射剂量,平均0.6 J/cm2,后依据治疗后皮肤反应程度适当调整照射剂量,如前次照射无红斑反应可在原有照射剂量基础上增加20%,最大3.5 J/cm2。治疗时按要求佩戴UV防护镜。2组疗程均为3个月。
1.4 评价标准
(1) 采用欧洲AD评分系统(SCORAD,European atopic dermatitis scoring system)[7]评估病情严重度,含皮损范围、严重度、瘙痒症状和睡眠受影响程度:①皮损范围:分为头颈部(9%)、臂(9%)、躯干前后(各13.5%)、下肢(各22.5%),评分1~100分;②严重度:采用4级评分法进行评估,评分范围含红斑、表皮剥脱、皮肤干燥、苔藓化、渗出或结痂、水肿或丘疹6项体征,依据皮损严重程度评分0~18分;③瘙痒症状和睡眠受影响程度:以最近3昼夜瘙痒症状和睡眠状况评分0~10分。依据公式①/5+7②/2+③计算SCORAD总分,评分低提示病情较轻。(2)采用视觉模拟评分(VAS,visual analog scale)评估治疗前后AD患者的瘙痒程度,其中0分表示无瘙痒,10分则表示存在剧烈瘙痒,评分低提示瘙痒程度较轻[8]。(3)疗效判定标准[9]:痊愈:积分下降指数(治疗前后SCORAD总分之差/治疗前SCORAD总分×100%)>90%;显效:积分下降指数70%~90%;有效:积分下降指数30%~69%;无效:积分下降指数不足30%。计算总有效率。
1.5 检测方法
于治疗前后抽取2组肘静脉血5 mL,其中2 mL离心处理后取上清液待测;3 mL离心处理后取上中层界面白色云雾层狭窄带待测。(1)血清IL-25、TSLP水平检测:采用双抗体夹心酶联免疫吸附试验(ELISA,enzyme linked immunosorbent assay)法检测2组血清IL-25、TSLP水平;(2)外周血单个核细胞(PBMC,peripheral bloodmononuclear cells)中IL-25RmRNA、TSLPRmRNA表达水平检测:采用RT-PCR法检测。
1.6 统计学方法
2 结果
2.1 治疗前后AD组SCORAD积分、VAS评分比较及临床疗效
治疗3个月后AD组患者SCORAD积分、VAS评分均明显低于治疗前(P<0.05),详情见表1。48例AD患者均完成治疗,共治愈5例,显效16例,有效18例,无效9例,总有效率为81.25%。
2.2 各组血清IL-25、TSLP及其受体水平比较
治疗前AD组血清IL-25、TSLP水平及IL-25RmRNA、TSLPRmRNA表达水平均明显高于对照组,治疗后上述指标水平均较治疗前显著下降(P<0.05);治疗后血清IL-25水平与对照组对比无统计学意义(P>0.05);治疗后TSLP水平、IL-25RmRNA、TSLPRmRNA表达水平仍明显高于对照组(P<0.05),详情见表2。
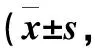
表1 治疗前后AD组评分比较分)
2.3 AD组患者外周血IL-25、TSLP水平与SCORAD总分的相关性
相关性分析显示治疗前AD组患者血清IL-25与TSLP水平呈正相关(r=0.53,P<0.01);血清IL-25、TSLP水平与SCORAD积分均呈正相关(r=0.30,P<0.05;r=0.58,P<0.01),详情见表3、图1。
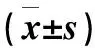
表2 2组血清指标水平比较
表3 AD组患者外周血指标与SCORAD总分的相关性
3 讨论
成人期AD临床可有皮肤干燥、剧烈瘙痒和慢性湿疹样皮样等多种表现,其皮疹形态以湿疹型、苔藓型为主,痒疹型则较少见,发病原因主要包括遗传、环境和心理因素。其中遗传因素多指AD患者皮肤屏障与免疫功能失衡,如Th2介导的免疫学异常、表皮中丝聚蛋白明显减少甚至丧失进而影响皮肤屏障功能[10];环境因素主要包括环境变化、接触感染源和变应原、过度洗涤、生活方式改变等;而焦虑、抑郁、紧张等心理因素则会引发或加重AD的发生[11]。
目前,药物治疗是临床治疗AD的常用手段,2014版指南提出外用润肤剂以及正确淋浴等基础治疗对于防治AD非常重要。可用于治疗AD的外用药物主要有类皮质激素、抗微生物制剂和钙调神经磷酸酶抑制剂等,其临床疗效已获得肯定,既往多项研究均证实环孢霉素、硫唑嘌呤、甲氨蝶呤等药物在AD治疗上有良好效果。此外,口服益生菌、紫外线治疗、维生素D和(或)维生素E补充治疗、中药治疗等辅助治疗手段亦可取得良好效果。NB-UVB照射可发挥免疫抑制作用,用于治疗成人AD具有疗效好、光毒反应轻等优点,且不增加皮肤癌发生率,是当前中重度AD的一线光疗法。但单纯使用NB-UVB照射周期相对较长,紫外线照射剂量较大,在提升治愈率方面并无明显优势[12]。他克莫司、吡美莫司等TCIS药物唯一准予使用的适应症为AD,既往研究证实TCIS能选择性抑制前炎症细胞因子释放,可阻断淋巴细胞因子合成,下调Th1、Th2细胞因子表达水平;且TCIS能选择性作用于肥大及T淋巴细胞,不诱导细胞凋亡,经皮肤吸收较少,抗炎活性强,副作用较少[13],现有大量长期临床观察亦证实TCIS治疗成人与儿童AD的疗效及安全性。他克莫司是一种治疗AD疗效确切的外用免疫调节剂,适用于身体各部位,除可能引发局部刺激之外整体安全性良好,其用于治疗AD的作用机制为:他克莫司能抑制磷酸酯酶活性及抗原特异性T细胞的活化、增殖,并能抑制免疫与炎症细胞因子转录。此外,他克莫司对胶原合成无不良影响,长期使用不会造成皮肤萎缩,也不增加感染风险,在AD维持治疗中有明显优势。
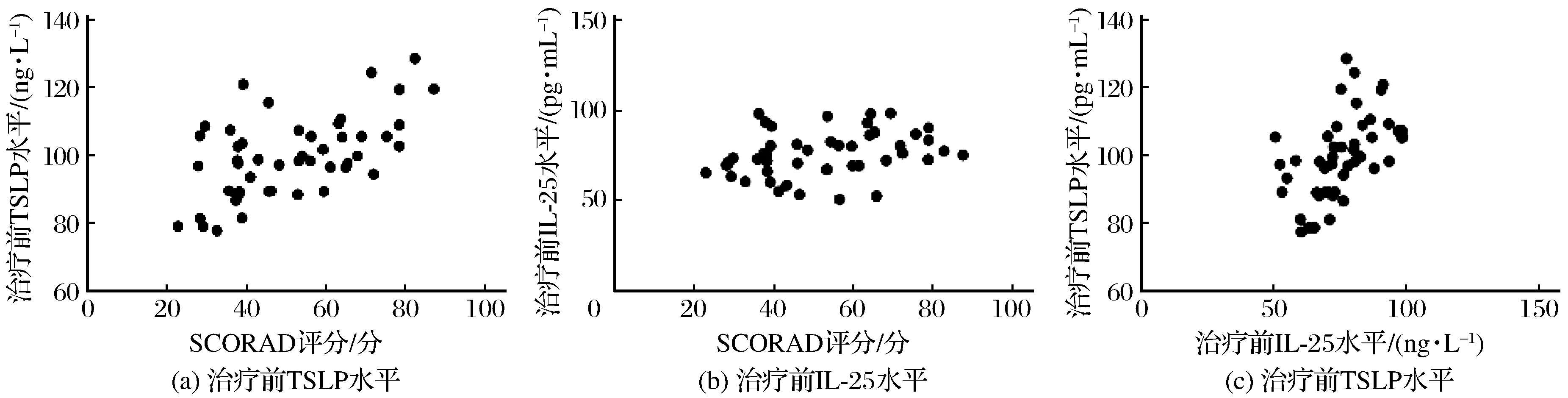
图1 AD组患者外周血指标与SCORAD总分的相关性Fig.1 Correlation between the peripheral blood indexes and the total score of SCORAD of the AD group
白细胞介素-25(IL-25)属IL-17家族新成员,多由活化的Th2细胞产生,但其与IL-17A同源性最小,其生物学功能亦与IL-17家族成员存在较大差异。相关研究证实IL-25能诱导嗜酸性粒细胞炎症,介导哮喘、特应性皮炎等过敏性疾病发病[14]。胸腺基质淋巴细胞生成素(TSLP)是一种可在皮肤黏膜天然免疫中发挥作用的IL-17家族成员,研究发现其在AD患者皮损处高表达,能促进Th2型免疫应答[15]。IL-25、TSLP能共同刺激Th2记忆细胞增殖,并最终造成Th1/Th2细胞平衡失调。本次研究发现,治疗前AD患者血清IL-25、TSLP水平及IL-25RmRNA、TSLPRmRNA相对表达量均明显高于对照组,且治疗前AD患者血清IL-25、TSLP呈显著正相关,提示上述因素均参与了AD的发生,与李玉娟等[16]研究结论基本一致。IL-25可能通过激活NF-κB及caspase-1途径上调TSLP表达,且二者均能通过介导相关因子表达促进Th2细胞生成以及Th2型细胞因子与促炎性因子释放,引发过敏性炎症反应[17],因此二者可能在Th细胞亚群平衡调节中发挥协同作用。PBMC中IL-25RmRNA、TSLPRmRNA相对表达量明显高于正常对照组,这提示IL-25、TSLP可能通过促进Th2细胞因子引发加剧变态反应性炎症并参与AD致病过程,提示其可能成为AD治疗的潜在靶点。研究发现,联合治疗后AD患者SCORAD积分、VAS评分均较治疗前明显下降,治疗总有效率达81.25%,与龚宇等[18]结论一致。提示联合治疗能减轻AD患者组织损伤和皮肤瘙痒等症状,疗效较理想,其原因在于联合治疗能有效降低IL-25、TSLP及受体水平,抑制Th2细胞分化、增殖以及Th2型细胞因子生成,有效改善Th2型免疫反应,减弱表皮屏障功能障碍,进而减轻皮肤炎症反应,缓解症状。

