基于PKCθ-Ikk-NF-κB信号通路研究白头翁汤介导NKT细胞抑制分泌IL-13因子治疗UC机制
王学伟,徐丽君,曹 勤,汪 涛,许 健
(上海中医药大学附属普陀医院消化内科,上海 200062)
炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD),是一种病因不明的慢性复发性炎症性疾病[1]。IBD的发病涉及遗传易感性、结肠上皮屏障、肠道菌群及黏膜免疫炎症4个环节[2]。CD的黏膜免疫特点符合典型的Th1淋巴细胞反应,表现为干扰素γ(IFNγ)表达增高;与CD不同,UC的黏膜免疫反应表现为一种非典型NKT细胞(natural killer T cell)介导的Th2淋巴细胞样反应[3]。根据其表面的T细胞受体(TCR)的不同,NKT细胞可分为典型的invariant NKT(iNKT)细胞和非典型的non-invariant NKT细胞两大类。UC黏膜免疫炎症的特征是:抗原递呈细胞,如树突状细胞或结肠上皮细胞表面的MHC-I类样分子CD1d将糖脂类(Glycolipid)抗原递呈给CD4+CD161+non-invariant NKT细胞,使其激活并分泌IL-13和IL-5[4]。研究发现UC患者结肠黏膜IL23和IL17 mRNA表达显著高于结肠CD患者,提示Th17细胞及其分泌的IL-17也参与UC黏膜免疫炎症[5]。NKT细胞分泌IL-13和IL-5是UC的初级炎症反应,IL-13更是关键的致病效应分子,这与之前研究结果相似[6],但其表达IL-13的信号通路和转录因子目前尚不明确。研究通过体外特异性药理学抑制小鼠NKT细胞的方法初步阐明了影响IL-13表达的可能机制。
1 材料与方法
1.1 材料
(1) 药物制备及购买 白头翁汤由白头翁30 g、秦皮9 g、黄连5 g、黄柏12 g 4味药组成,购自上海普陀医院中药房;噁唑酮购于美国sigma公司;1640培养基、胰蛋白酶、抗生素、胎牛血清购于美国gibco公司;小鼠NK1.1+iNKT细胞分离试剂盒购买于美国Miltenyi Biotec公司;AEB071等抑制剂购买于美国MCE公司;CD3、CD28、GATA3、PLZF、T-bet、RORγτ、NF-κB等抗体购买于美国Cell Signaling Technology公司;其他生化试剂为国产分析纯。
(2) 主要仪器 倒置显微镜(Olympus公司);CO2恒温培养箱(Thermo公司);超净工作台(Baker公司);HH·W21·600S电热恒温水箱(上海跃进医疗器械公司);流式细胞仪(BD Biosciences FACSCalibur);移液器(Eppendorf公司);血球计数板(上海跃进医疗器械公司);酶标仪(Thermo公司);恒温孵育箱(上海精宏实验设备有限公司);低温高速离心机(Hettich);电泳仪(BIO RAD)等。
(3) 实验动物 健康普通级C57BL/6小鼠由上海斯莱克实验动物有限责任公司供应,生产许可证号码:SCXK(沪)2018-0002。小鼠购买后饲养于清洁明亮的动物实验室内,温度23~25 ℃,相对湿度40%~70%,中央空调集中通风8~10次/h,光照12 h暗12 h,自由进食及饮水。
1.2 实验方法
(1) 实验动物的造模及培养 采用体重约为20 g、雄性、SPF级C57BL/6小鼠,首先预适应1周。然后将噁唑酮溶于100%的乙醇溶液,制成3%(w/v)的溶液,作为致敏液;溶于50%乙醇溶液,制成1%(w/v)的溶液,作为灌肠液。第1天用0.2%戊巴比妥钠0.2 mL腹腔注射麻醉,在小鼠双肩之间的背部剃毛,暴露2 cm×2 cm的皮肤,取200 μL致敏液涂搽皮肤;第2天再次致敏一次;第5天开始禁食;第6天戊巴比妥钠麻醉后,将直径3.5 mm软管用无菌石蜡油润滑后,缓慢插入小鼠肛门4 cm,缓慢注入150 μL噁唑酮灌肠液,拔出导管,保持小鼠头朝下、垂直体位60 s,使噁唑酮溶液留置于肠腔内。将小鼠分为正常组10只、模型组10只、治疗组10只。正常组常规喂养,不作任何处理;模型组造模后,常规喂养;治疗组给予白头翁汤醇提物灌胃治疗。
(2) DAI评分方法 治疗过程中,每天记录小鼠的体重、大便性状及便血程度。大便隐血采用化学法测定。DAI评分标准[7]见表1,计算公式为
DAI=(体重下降百分数+大便性状评分+便血评分)/3。

表1 DAI评分标准
(3) NKT细胞的分离和鉴定 采用anti-NK1.1/FITC和anti-FITC包被的磁珠分离系统MACS(Miltenyi Biotec,美国),按操作说明,分离NKT细胞。在含5×105NKT细胞的50 μL提取液中,加入10 μL FITC-anti-NK1.1(绿色荧光),避光孵育30 min,PBS洗1次后,流式细胞仪检测NKT细胞纯度并分离出来培养。
(4) 结肠标本采集 组织取材及处理:疗程结束,断颈法处死小鼠,取出结肠,剔除脂肪组织,用含有10 μg/mL庆大霉素、100 U/mL青霉素、100 μg/mL链霉素的冰PBS充分洗净结肠,剪成0.5 cm长的肠段。每只小鼠部分肠段固定于10%中性福尔马林,石蜡包埋;部分肠段保存于-80 ℃;部分肠段用4%多聚甲醛固定1 h,做石蜡包埋。然后做常规病理切片,HE染色,进行组织病理学评分。
(5) 特异性激酶抑制剂方法 特异性激酶抑制剂及抑制浓度:FK506 1 nM抑制Calcineurin及PLCγ1-Calcineurin-NFAT信号通路;U0126 10 μM抑制MEK及MEK-ERK信号通路;LY294002 5 μM抑制PI3K及PI3K-Akt-mTORC1信号通路;AEB071 1 μM抑制PKCθ及PKCθ-Ikk-NF-κB。1×105个 NKT细胞培养于细胞培养板中,每孔加入0.2 mL含10%胎牛血清RPMI-1640完全培养基,用上述抑制剂预先干预NKT细胞30 min,再加入1 μg/mL抗CD3单克隆抗体及0.3 μg/mL抗CD28单克隆抗体,在37 ℃、5%CO2的细胞培养箱中培养24 h后,ELISA测定上清液中IL-13的浓度,收集细胞,采用RT-PCR测定IL-13 mRNA,Western-blot检测GATA3、PLZF、T-bet及RORγτ的表达。
(6) ELISA测定NKT细胞上清IL-13因子含量 按照说明书配置标准品。在空白孔、标准孔和样品孔分别加入50 μL样本、标准品和样本37 ℃孵育30 min。用洗液4次,每孔加入50 μL Biotin-Conjugate,37 ℃孵育30 min,然后用洗液4次。每孔加入100 μL TMB Substrate Solution避光37 ℃孵育15 min。每孔加入50 μL终止液,在450 nm处测吸光值。
(7) Western blot检测NKT细胞蛋白表达 取适量的NKT细胞,用冰PBS洗涤3次。取适量的裂解液,在使用前数分钟内加入PMSF,体积比为1∶100。在冰上裂解20 min。在11 000 r/min的4 ℃离心机离心10 min,取上清液。测定和调节蛋白浓度,保持每孔的加样量为30 μg。将准备好的样品和蛋白质marker(10~180 KD)分别上样电泳,电泳条件为前期在浓缩胶时电压为80 V,之后将电压升高至120 V直至电泳完全。然后将蛋白从凝胶转至NC膜上,5%脱脂奶粉室温封闭1 h,加入稀释好的一抗抗体,4 ℃过夜。二抗室温1 h振荡孵育。最后ECL化学发光曝光显色。
1.3 统计分析
采用SPSS 17.0软件,2组间比较采用t检验,多组间比较采用进行SNK-q检验,p<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠体重和DAI评分的比较
通过实验观察,发现小鼠造模24 h后,已经出现稀便症状,并且伴随有些许脓血,体温升高,接下来随机抽取2只模型组小鼠解剖观察小鼠结肠病变情况,确认已造模成功。治疗组每天给予中药白头翁汤治疗一周后,便血情况显著好转,并且发热逐渐消失。最终治疗完成后发现,和对照组相比,模型组DAI评分最高;和模型组比较,治疗组体重和DAI评分都接近对照组(P<0.01),如图1所示。
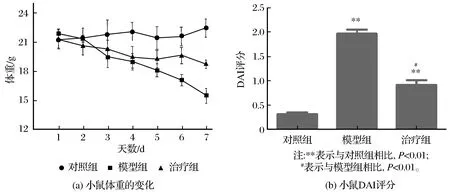
图1 造模后白头翁汤对溃疡性结肠炎小鼠体重和DAI评分的影响Fig.1 Influence of Pulsatilla decoction on body weight and DAI score in mice with ulcerative colitis after modeling
2.2 白头翁汤对溃疡性结肠炎小鼠组织病理结构的影响
HE染色光镜下观察发现,溃疡性结肠炎小鼠动物模型构建成功后,各组病理结构组织染色结果如图2所示。由图2可见,对照组的结肠组织黏膜结构清晰,无糜烂现象,并且腺体排列整齐、完整;模型组病理组织黏膜结构破损,组织糜烂现象严重,溃疡深大,腺体结构被显著破坏;治疗组结果显示,经过白头翁汤治疗可显著改善溃疡性结肠炎小鼠的炎症症状,具体表现为结肠炎组织结构显著恢复,糜烂现象基本消失,而且腺体结构也逐渐恢复完整。
2.3 白头翁汤对溃疡性结肠炎小鼠NKT细胞IL-13 mRNA水平和蛋白水平的影响
白头翁汤对上清IL-13蛋白水平和小鼠组织IL-13 mRNA基因水平及蛋白水平的影响如图3所示。模型组和对照组相比,表明小鼠溃疡性结肠炎造模成功后,IL-13的mRNA和蛋白表达水平明显升高(P<0.05);经过白头翁汤治疗后,中药组IL-13因子的表达水平明显降低(P<0.05)。
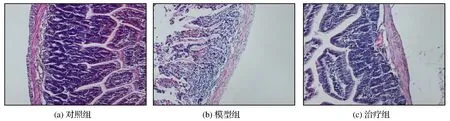
图2 HE染色观察白头翁汤治疗后小鼠结肠炎组织的变化Fig.2 Changing obsevation of HE staining of colitis tissues in mice treated with Pulsatilla decoction
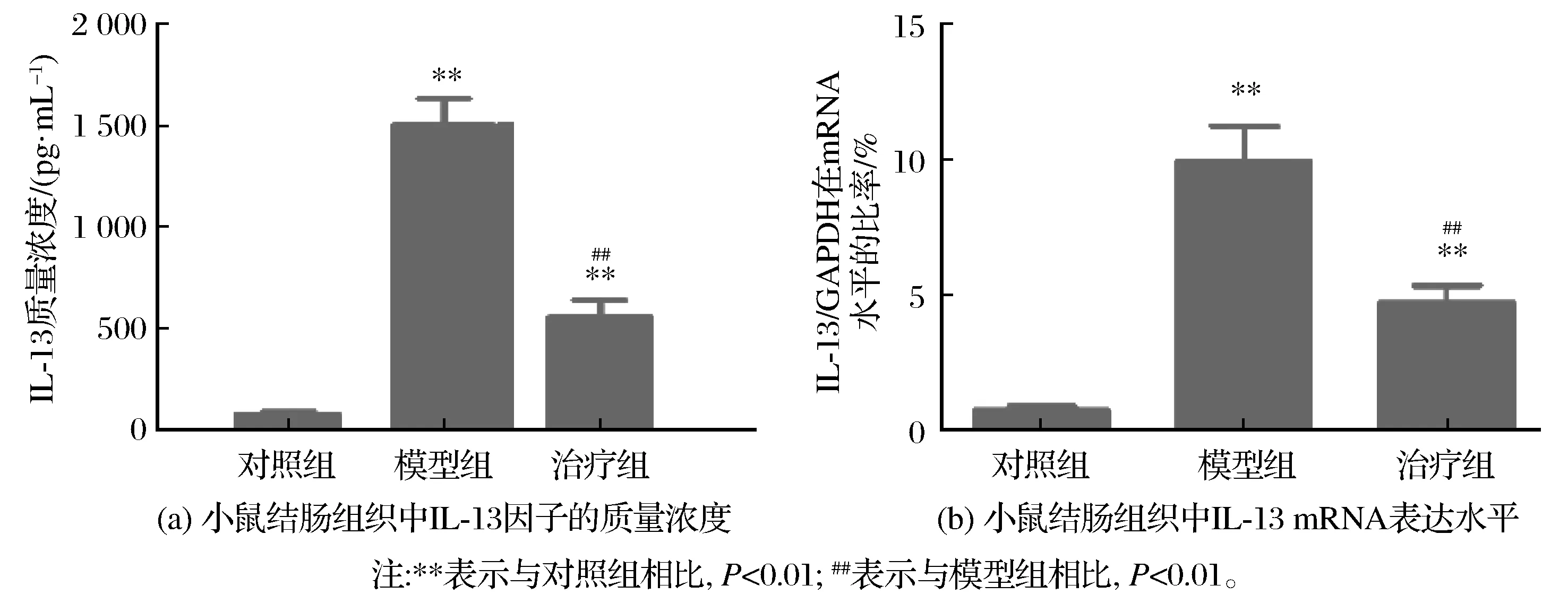
图3 白头翁汤对上清IL-13蛋白水平和小鼠组织IL-13 mRNA基因水平及蛋白水平的影响Fig.3 Influence of Pulsatilla decoction on IL-13 concentration and mRNA expression levels in colon tissues of mice in each group
2.4 Western blot分析激酶抑制剂处理后相关信号通路的变化
Western blot分析发现模型组NKT细胞先用AEB071 1 μM抑制PKLθ通过后,再加入1 μg/mL抗CD3单克隆抗体及0.3 μg/mL抗CD28单克隆抗体刺激NKT细胞,首先PKLθ、IKK、NF-κB水平显著降低(P<0.01),结果导致IL-13的蛋白水平变化也呈下降趋势,治疗组显著降低(P<0.01),治疗组与模型组+AEB071组相比,2组的蛋白表达水平基本无显著性差异(P>0.05),这表明白头翁汤可能通过PKLθ-Ikk-NF-κB通路介导IL-13因子的表达降低来治疗溃疡性结肠炎(见图4)。
3 讨论
溃疡性结肠炎是一种反复发作并且发病原因尚不完全明确的慢性炎症性肠道疾病,该病的主要临床表现为反复腹痛、腹泻黏液脓血便等症状,已被WHO列为现代难治病之一[8]。相关研究发现,溃疡性结肠炎的发生与多种因素有关,例如遗传易感性、环境、心理等,该病多见于20~40岁青壮年人群,是消化系统的常见病、多发病、疑难病[9],这个特点可能与我国生活条件的提高,人们的消费水平和消费方式有关,年轻人暴饮暴食可能加大患溃疡性结肠炎的风险。目前许多研究表明,UC患者结肠黏膜固有层内可见大量炎性细胞浸润,且在其发病过程中伴随有多种IL、TNF等炎症因子的表达异常[10-12]。免疫细胞作为机体免疫调节的核心环节,其在抑制炎症反应,避免免疫过度损伤机体中起着重要作用。而细胞因子作为免疫反应中的重要信号传递者,长期而持久的细胞因子分泌失衡可使炎症反应呈现慢性化表现。因此,实验提取溃疡性结肠炎小鼠NKT细胞,进行细胞因子IL-13表达检测。白头翁汤出自《伤寒论》,有清热燥湿、凉肝止痢的功效,目前大量研究表明白头翁汤治疗UC患者有较好的临床疗效,并对血清炎症因子水平产生影响[13]。
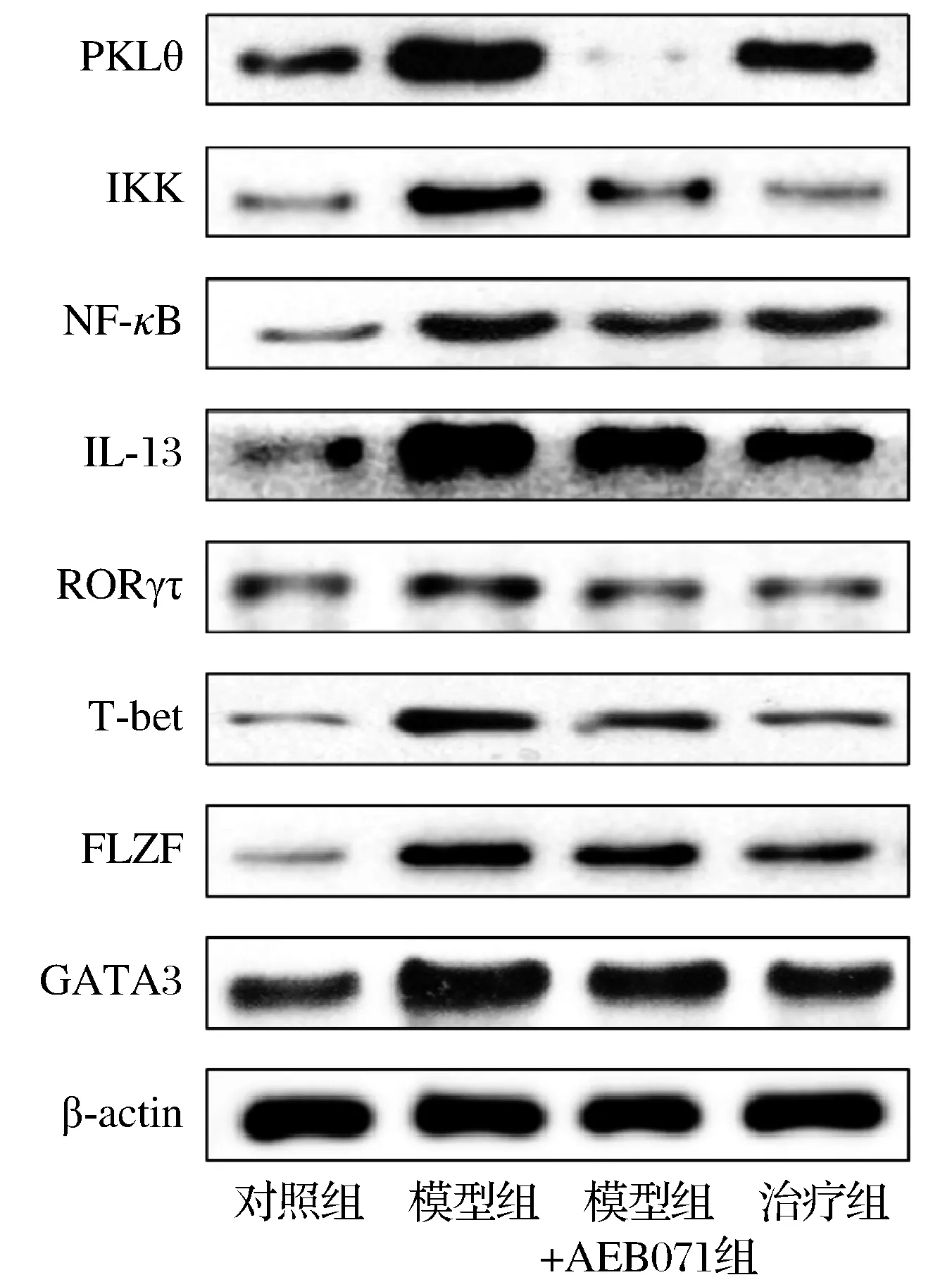
图4 Western blot分析:抑制剂处理后NKT细胞IL-13 因子相关通路蛋白表达水平的变化Fig.4 Western blot analysis of changes of protein expression level of IL-13 factor - related pathway in NKT cells treated with inhibitor
此次研究发现溃疡性结肠炎模型小鼠经白头翁汤治疗一周后,小鼠体重明显恢复(P<0.05);DAI评分明显下降(P<0.05);腹泻、黏液脓血便、黏膜充血糜烂等肠黏膜其他表征较治疗前显著好转,这些结果初步表明白头翁汤对溃疡性结肠炎有很好的治疗作用。HE染色结果表明UC小鼠模型结肠组织损伤严重,例如少量炎性细胞浸润,上皮屏障缺失,黏膜缺损、糜烂,腺体遭到破坏,但经白头翁汤治疗一周后,病理结构显著好转,表明白头翁汤能快速修复结肠的破损结构,炎症细胞浸润减少,这为后续的机制研究提供了有力证据。与UC密切相关的炎症因子有很多[14],实验选用IL-13因子进行研究是因为它是UC发病的关键因子。实验结果发现,UC小鼠IL-13因子的水平显著升高,用白头翁汤治疗后,IL-13的mRNA和蛋白水平明显降低(P<0.01),说明白头翁汤能改善患者免疫功能、调节机体炎症因子表达平衡。Western blot实验检测得出:用AEB071抑制剂处理NKT细胞后,NF-κB信号通路以及IL-13相关转录因子发生变化,实验结果表明用AEB071抑制PKLθ后,其下游Ikk-NF-κB信号通路蛋白显著降低,而且IL-13相关转录因子的表达水平也明显降低,用白头翁汤治疗后,IL-13、GATA3、PLZF、T-bet、RORγτ和NF-κB通路蛋白也显示出相同的趋势,这表明白头翁汤可能通过PKCθ-Ikk-NF-κB信号通路治疗溃疡性结肠炎小鼠。
对溃疡性结肠炎小鼠治疗后,小鼠的表型明显好转,而且治疗组IL-13因子明显降低,这说明白头翁汤可调节炎症因子的紊乱,使这些因子在体内重新达到稳态。而且药理学特异性激酶抑制实验表明PKCθ-Ikk-NF-κB信号通路可能参与了白头翁汤抑制炎症因子相关通路的变化,这为进一步的临床研究提供了新的治疗靶点和思路。

