基于Keap1/Nrf2信号通路介导的氧化应激损伤探讨三七总皂苷对七氟烷麻醉后大鼠认知功能障碍的影响
王帅,王佳佳,董梦真,李长生
(漯河市第二人民医院,河南 漯河 462000)
认知功能障碍是全麻手术患者术后常见麻醉相关并发症,多见于65 岁以上人群,重大手术术后1 周的发生率超过25%,以认知水平、注意力下降,记忆受损为主要临床表现[1]。七氟烷是吸入式全麻代表药物,以诱导迅速、刺激小、麻醉深度调节性好等优点,被广泛应用于多种全麻术中,但其对海马区的抑制作用可影响老年患者认知功能,导致预后不良,因而受到研究人员的普遍关注[2]。三七总皂苷(panax notoginseng saponins,PNS)是中药三七的主要活性物质,可通脉活络、活血祛瘀,常被用于治疗心脑血管类疾病,具有抗缺氧、抗衰老、提升机体免疫力等药理作用[3]。有研究表明[4],PNS 可促进卒中后抑郁模型大鼠海马区神经再生,从而提高其学习认知能力。然而,目前关于其对七氟烷麻醉后大鼠认知功能障碍的治疗作用报道尚少,且缺乏对应的机制研究。因此本研究通过建立七氟烷麻醉认知障碍大鼠模型,观察PNS 对七氟烷麻醉后大鼠认知功能障碍的改善作用,并探讨其相关机制。
1 材料与方法
1.1 实验动物
SPF 级健康SD 大鼠40 只,雄性,20月龄,体质量(550±50)g,购自北京科宇动物养殖中心,生产许可证号:SCXK(京)2018-0010。
1.2 主要药物、试剂和仪器
三七总皂苷(panax notoginseng saponins,PNS)(纯度:99%,上海依赫生物科技有限公司);七氟烷(上海百舜生物科技有限公司);Kelch 样环氧氯丙烷相关蛋白1(kelch-like ECH-associated protein-1,Keap1)/核因子E2 相关因子2(nuclear factor-E2 related factor2,Nrf2)信号通路抑制剂ML385(美国Sigma 公司);丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)比色法试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(上海泽叶生物科技有限公司);兔抗大鼠Keap1、Nrf2蛋白一抗(美国R&D公司)。
CX21 光学显微镜(日本OLYMPUS 株式会社);WD-9403 凝胶成像仪(北京六一生物科技有限公司)。
1.3 七氟烷麻醉认知障碍大鼠模型的制备
参考文献[5]取全部SD 大鼠,随机选取10 只设为Blank 组,其余30 只大鼠建立七氟烷麻醉认知障碍模型,将大鼠置于自制麻醉箱内,麻醉箱出口处连接气体监护仪监控箱内气体浓度,入口处连接七氟烷挥发罐及氧气瓶,接入2%七氟烷+ 50%空气氧气混合气体(氧流量2 L/min)4 h,等待大鼠苏醒后重新放回饲养箱,随机分为Sevoflurane组、PNS组、PNS联合ML385组,各10只;Blank 组麻醉箱不接入七氟烷挥发罐,其余操作同建模大鼠。
1.4 干预方式
参考文献[6-7],建模结束后次日,PNS 联合ML385组大鼠腹腔注射PNS生理盐水溶液(75 mg/kg),2 h 后腹腔注射溶于DMSO 的ML385(20 mg/kg);PNS组大鼠腹腔注射PNS 生理盐水溶液(75 mg/kg),2 h 后腹腔注射等量DMSO;Blank组、Sevoflurane组大鼠腹腔注射等量生理盐水,2 h 后腹腔注射等量DMSO。每日1次,持续14 d。
1.5 T迷宫实验检测认知功能
末次干预结束后,进行T 迷宫实验,在左右两臂任一臂末端放置少量食物,将大鼠放置于T迷宫入口处,观察大鼠行为,若其可一次性选择正确方向并进食视作成功,若无法一次性选择正确方向视为失败;成功则将食物放置另一臂重新测试,失败则不改变食物位置重新测试,直至其选择成功再改变食物位置,每只大鼠连续实验20次,计算成功率。
成功率(%)=选择成功次数/20×100%
1.6 组织取材
T 迷宫实验结束后,各组大鼠禁食、禁水12 h,麻醉后抽取腹主动脉血,脱颈处死,随机选取5 只剥离完整脑组织,置于4%多聚甲醛中固定24 h,常规脱水、透明、浸蜡、包埋,使用切片机切为4 μm 厚切片用于HE染色,剩余5只采集脑组织海马区,置-80 ℃冰箱保存待测。
1.7 血清氧化应激指标MDA、GSH、SOD检测
取腹主动脉血注入离心管内,冰上3 000 r/min 离心12 min(离心半径8 cm),取其上清,按照试剂盒说明书要求,使用TBA 法检测MDA 水平,比色法检测GSH活性水平,羟胺法检测SOD活性水平。
1.8 脑组织海马区病理变化
取脑组织切片常规脱蜡、水化,蒸馏水浸泡,苏木素浸染5 min,自来水冲洗2 min,加入分化液分化,自来水冲洗,移入促蓝液浸泡,自来水冲洗,伊红液浸染2 min,自来水冲洗,阶梯浓度酒精脱水,二甲苯透明,封片剂封片,置于光镜下观察脑组织海马区病理变化,并拍照记录。
1.9 脑组织中Keap1、Nrf2蛋白表达水平
取冷冻保存的脑组织,剪碎并充分研磨,加入PBS匀浆,移至离心管,加入RIPA 细胞裂解液,冰上10 000 r/min 离心8 min(离心半径10 cm),经BCA 试剂盒定量蛋白。取50 μg 待测蛋白,以1∶4 体积比与Loading Buffer 缓冲液融合,金属浴煮沸5 min 变性蛋白,同条件离心取其上清,恒压下进行凝胶电泳分离,湿转PVDF 膜,5%脱脂牛奶封闭1 h,TBST 洗膜,与工作浓度1∶500的兔抗大鼠Keap1、Nrf2混合,4 ℃摇床孵育过夜,TBST洗膜,加入二抗(1∶2 000),室温孵育2 h,加入发光液显色,置于暗室内曝光,凝胶成像分析仪拍照并分析结果,以Keap1、Nrf2 蛋白条带灰度值与内参GAPDH 条带灰度值的比值代表Keap1、Nrf2 蛋白相对表达量。
1.10 统计学方法
采用SPSS 19.0 统计学软件分析数据,以均数±标准差(±s)表示计量资料,以多因素方差分析检验多样本计量资料,方差齐采用LSD-t检验分析。P<0.05表示差异有统计学意义。
2 结果
2.1 各组T迷宫实验成功率比较
Blank、Sevoflurane、PNS、PNS 联合ML385 组大鼠T迷宫实验成功率分别为(95.00 ± 1.27)%、(50.00 ±5.68)%、(75.00 ± 6.92)%、(65.00 ± 6.39)%,与Blank 组比较,Sevoflurane 组大鼠T 迷宫实验成功率降低(P<0.05);与Sevoflurane 组比较,PNS 组大鼠T 迷宫实验成功率升高(P<0.05);与PNS 组比较,PNS 联合ML385组大鼠T迷宫实验成功率降低(P<0.05)。
2.2 各组血清MDA水平与GSH、SOD活性比较
与Blank组比较,Sevoflurane组血清MDA水平升高、GSH、SOD 活性降低(P<0.05);与Sevoflurane 组比较,PNS 组血清MDA 水平降低、GSH、SOD 活性升高(P<0.05);与PNS组比较,PNS联合ML385组血清MDA水平升高、GSH、SOD活性降低(P<0.05)。见表1。
表1 各组血清MDA水平与GSH、SOD活性比较(±s)
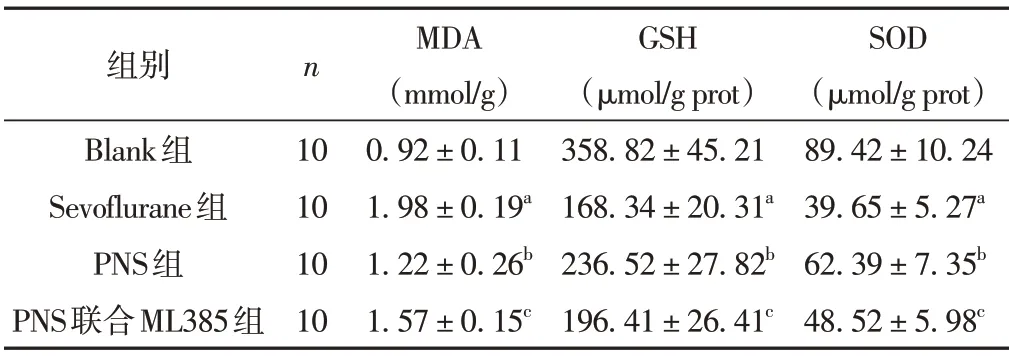
表1 各组血清MDA水平与GSH、SOD活性比较(±s)
注:与Blank 组比较,aP <0.05;与Sevoflurane 组比较,bP <0.05;与PNS组比较,cP <0.05。
组别Blank组Sevoflurane组PNS组PNS联合ML385组n 10 10 10 10 MDA(mmol/g)0.92±0.11 1.98±0.19a 1.22±0.26b 1.57±0.15c GSH(μmol/g prot)358.82±45.21 168.34±20.31a 236.52±27.82b 196.41±26.41c SOD(μmol/g prot)89.42±10.24 39.65±5.27a 62.39±7.35b 48.52±5.98c
2.3 各组脑组织海马区病理变化情况比较
HE 染色结果显示,Blank 组脑组织海马区结构正常,细胞排列整齐,神经元轮廓清晰,胞核大而圆,染色较浅;Sevoflurane 组脑组织海马区结构被破坏,细胞排列疏松,大量神经元缩小坏死,胞核固缩呈多边形,染色深;PNS 组、PNS 联合ML385 组脑组织海马区结构破坏程度较低,细胞排列不均,部分神经元肿胀、变性,胞核肿大,染色较深,PNS组比PNS联合ML385组病理改善更明显。见图1。
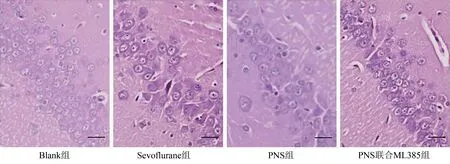
图1 HE染色观察各组脑组织海马区病理变化图(HE,×200,标尺50 μm)
2.4 各组脑组织Keap1、Nrf2蛋白表达比较
与Blank 组比较,Sevoflurane 组大鼠脑组织Keap1 蛋白表达降低,Nrf2 蛋白表达升高(P<0.05);与Sevoflurane 组比较,PNS组大鼠脑组织Keap1 蛋白表达降低,Nrf2 蛋白表达升高(P<0.05);与PNS 组比较,PNS 联合ML385 组大鼠脑组织Keap1 蛋白表达升高,Nrf2 蛋白表达降低(P<0.05)。见表2、图2。

图2 Western Blot法检测脑组织Keap1、Nrf2蛋白表达
表2 各组脑组织Keap1、Nrf2蛋白表达比较(±s)
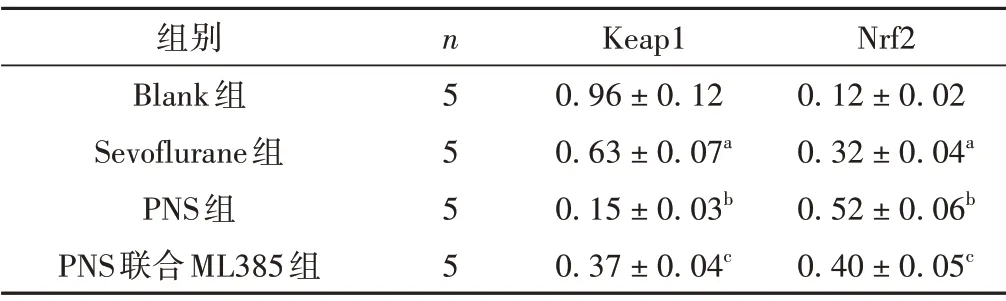
表2 各组脑组织Keap1、Nrf2蛋白表达比较(±s)
注:与Blank 组比较,aP <0.05;与Sevoflurane 组比较,bP <0.05;与PNS组比较,cP <0.05。
组别Blank组Sevoflurane组PNS组PNS联合ML385组n5 5 5 5 Keap1 0.96±0.12 0.63±0.07a 0.15±0.03b 0.37±0.04c Nrf2 0.12±0.02 0.32±0.04a 0.52±0.06b 0.40±0.05c
3 讨论
认知功能障碍是麻醉引发的中枢神经功能紊乱综合征,可导致术后患者记忆力降低、活动受限,由于老年人各项生理功能的退化,机体调节能力随之降低,使大脑对麻醉药物的敏感性增强,导致认知功能障碍[8]。年龄、手术类型、麻醉、基础代谢疾病是术后认知功能障碍的主要危险因素[9]。目前关于其发病机制尚未完全阐明,多认为与氧化应激损伤、炎症反应加剧、海马区神经元凋亡、神经递质异常等因素有关,其中氧化应激损伤是引发认知功能障碍的重要机制[10]。七氟烷麻醉可使机体产生应激反应,产生过量氧自由基,从而造成氧化应激损伤。LIU 等[11]研究认为,七氟烷可增强幼鼠海马组织氧化应激损伤,促进海马组织神经元凋亡。因此,探究高效、安全的抑制氧化应激损伤的药物或手段,对于降低老年患者术后认知功能障碍发生率、改善预后具有积极作用。
中医古籍中对麻醉引起的认知功能障碍无明确记载,现代学者通常将其归于“健忘”“痴呆”“癫狂”等范畴,其病机主要为年老体弱、肾精亏虚,以致髓海失充、脑失所养、血气不足、气滞血瘀、脑络痹阻,以致发病,故治疗应以活血化瘀、益气健脾、滋阴养血为主[12]。三七是我国云南道地药材,取自五加科人参属植物三七的干燥根,性温,味甘、微苦,归肝经、胃经,可活血祛瘀、消肿止痛。清末名医张锡纯所著《医学衷中参西录》中记载:“三七善化瘀血,又善止血妄行,为吐衄要药,病愈后不至于瘀血留于经络”[13]。本研究结果显示,与Sevoflurane组比较,PNS组大鼠T迷宫实验成功率,血清GSH、SOD 活性升高,血清MDA 水平降低,提示PNS 可改善七氟烷麻醉后大鼠认知功能障碍,抑制其氧化应激反应。PNS是自三七中提取的多种单体皂苷及微量元素、多糖等多种活性成分的组分,其含量是判断三七品质的重要标准[14]。LIU等[15]研究认为,PNS可保护海马区神经元,逆转Aβ1-42诱导的大鼠认知障碍,提升其学习能力及记忆力,提示PNS具有神经系统保护作用。
Keap1/Nrf2 信号通路是迄今发现的最重要的抗氧化防御性通路,可抵御细胞氧化应激损伤,在神经性疾病发生和发展过程中发挥重要作用[16]。Nrf2 是CNC 转录因子家族成员,是抗氧化反应核心转录因子,Keap1 是Kelch 家族重要阻遏蛋白,是一种Nrf2 抑制多肽。正常生理条件下,Nrf2 与Keap1 在Neh2 结构域结合后存在于细胞质中,非激活状态Nrf2 被泛素化进而降解,当机体发生氧化应激时,Nrf2 被激活与Keap1 解离,转移至细胞核内,与核内抗氧化反应元件(antioxident response element,ARE)对应位点结合,激活通路下游抗氧化酶、解毒酶基因转录,与相关因子共同作用提升细胞抗氧化能力[17]。YAN 等[18]研究认为,激活Keap1/Nrf2 通路可减少细胞内活性氧积累,改善线粒体功能障碍,抑制细胞凋亡,从而保护神经组织,对阿尔茨海默病大鼠产生治疗作用,提示Keap1/Nrf2 通路可作为神经类疾病潜在治疗靶点。本研究结果显示,与Sevoflurane 组比较,PNS 组大鼠脑组织Keap1 蛋白表达降低,Nrf2 蛋白表达升高,且在PNS 基础上增用Keap1/Nrf2 信号通路抑制剂ML385 可减弱PNS 对七氟烷麻醉后大鼠认知功能障碍的改善作用,提示PNS 可能通过介导该通路,抑制脑组织氧化应激反应,从而对七氟烷麻醉后认知功能障碍大鼠产生治疗作用。
综上所述,PNS 可改善七氟烷麻醉后大鼠认知功能障碍,抑制脑组织氧化应激反应,推测其作用机制可能与激活Keap1/Nrf2信号通路有关。

